中国组织工程研究 ›› 2024, Vol. 28 ›› Issue (19): 2996-3002.doi: 10.12307/2024.159
• 牙髓及牙周膜干细胞 Dental pulp and periodontal ligament stem cells • 上一篇 下一篇
增龄因素对牙源干细胞生物学特性的影响
徐志国1,2,武艳飞3,任振辉2,杨旭巍2,钮移坤2,董志隆4,杜 为4,杨文玲4,徐 鑫5,朱 怡6,刘乐锋2,刘 超2
- 1湖州学院生命健康学院,浙江省湖州市 313000;2协和华东干细胞基因工程有限公司,浙江省湖州市 313000;3湖州市第一人民医院,浙江省湖州市 313000;4中源协和细胞基因工程有限公司,天津市 300384;5沈阳科技学院,辽宁省沈阳市 110167;6湖州师范学院,浙江省湖州市 313000
Effects of aging factors on biological characteristics of dental stem cells
Xu Zhiguo1, 2, Wu Yanfei3, Ren Zhenhui2, Yang Xuwei2, Niu Yikun2, Dong Zhilong4, Du Wei4, Yang Wenling4, Xu Xin5, Zhu Yi6, Liu Lefeng2, Liu Chao2
- 1College of Life and Health, Huzhou College, Huzhou 313000, Zhejiang Province, China; 2Eastern Union Stem Cell & Gene Engineering Co., Ltd., Huzhou 313000, Zhejiang Province, China; 3Huzhou First People’s Hospital, Huzhou 313000, Zhejiang Province, China; 4VcanBio Cell & Gene Engineering Co., Ltd., Tianjin 300384, China; 5Shenyang Institute of Science and Technology, Shenyang 110167, Liaoning Province, China; 6Huzhou University, Huzhou 313000, Zhejiang Province, China
摘要:

文题释义:
增龄因素:指提取牙源干细胞的牙齿样本所涵盖年龄区间不断递增:乳牙(6-13周岁)、少年恒牙(18周岁以下)、成年恒牙(18周岁及以上)。牙源干细胞:牙齿来源的间充质干细胞,其多向分化潜能不仅可向成牙细胞分化,还能向多种组织细胞分化,具有很高的增殖和自我更新能力。
背景:牙源干细胞在再生医学与组织工程等领域的研究不断深入,为牙相关组织修复及全身疾病治疗带来了希望。但目前对不同年龄区间牙源干细胞生物学特性上的差异缺少系统的分析。
目的:探讨脐血源血小板裂解液培养人乳牙、恒牙牙髓干细胞的生物学特性,为人血小板裂解液代替胎牛血清提供可靠依据。方法:取出乳牙、少年恒牙及成年恒牙牙髓组织,在含体积分数为10%胎牛血清或5%,10%,15%人血小板裂解液的DMEM/F-12培养基中培养,采用细胞计数法检测4组细胞增殖情况,选取最佳人血小板裂解液浓度进行后续实验。在最佳人血小板裂解液浓度条件下,体外培养乳牙、少年恒牙及成年恒牙牙髓干细胞,显微镜下观察细胞生长状态,流式细胞术检测细胞表面特异性抗原,细胞计数法和CCK-8法检测细胞增殖能力,三系分化实验观察细胞体外分化能力。
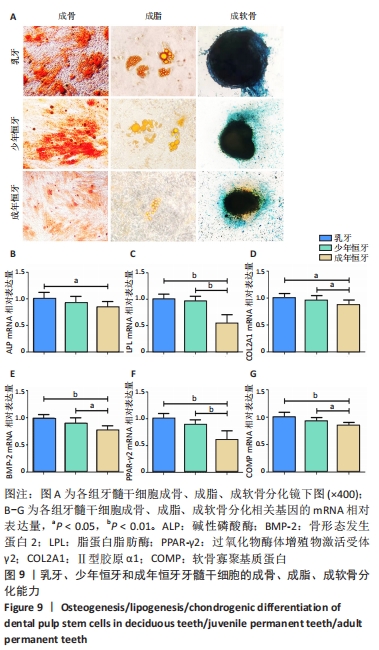
结果与结论:①10%人血小板裂解液组的细胞增殖速率最高;②各组牙髓组织块周围均有梭形成纤维状细胞生长并扩增,乳牙与少年恒牙细胞形态无明显差异;与同代次乳牙和少年恒牙细胞相比,成年恒牙细胞体积偏大;③流式细胞术检测结果显示乳牙、少年恒牙及成年恒牙牙髓干细胞均符合间充质来源干细胞的表型特征;④成年恒牙牙髓干细胞增殖能力明显低于乳牙及少年恒牙牙髓干细胞(P < 0.01);⑤成年恒牙牙髓干细胞中成骨相关基因碱性磷酸酶、骨形态发生蛋白2 mRNA表达,成脂相关基因脂蛋白脂肪酶、过氧化物酶体增殖物激活受体γ2 mRNA表达,成软骨相关基因Ⅱ型胶原α1、软骨寡聚基质蛋白mRNA表达均显著低于乳牙及少年恒牙牙髓干细胞(P < 0.01);⑥结果表明,人乳牙与少年恒牙牙髓干细胞相较于成年恒牙牙髓干细胞具有更强的增殖能力与多向分化潜能,更适用于临床研究和疾病治疗。
https://orcid.org/0000-0001-5460-7076 (徐志国)
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程
中图分类号: