2.1 间充质干细胞概述
2.1.1 间充质干细胞的生物学特性 间充质干细胞于20世纪60年代由德国学者Friedenstein首次发现并描述为骨髓来源的一种贴壁生长的成纤维细胞样细胞[10-11]。在此后的40余年中,各国学者围绕间充质干细胞的特性及应用进行了大量的研究,发现间充质干细胞不仅可以来源于骨髓,亦可从脂肪、脐血、胎肝、肺、胎盘、骨膜、滑膜、胸腺等多种组织中分离获得[12-14]。尽管间充质干细胞无特异性标志物,但多种细胞表面抗原的组合可用于细胞群的分离和鉴定,如:CD34、CD45、CD14、CD11等造血干细胞表面抗原阴性,CD80、CD86、CD40等共刺激分子及黏附分子CD31(PECAM-1)、CD56(neuronal cell adhesion molecule-1)、CD18(LFA-1)等表达也为阴性,而CD29、CD44(SH2)、CD73、CD90(Thy-1)、CD105、CD166(ALCAM)等标志物常为阳性表达[15-16],但不同物种之间有少量差异。新近研究指出,间充质干细胞亦表达多能干细胞相关的标记物如胚胎阶段特异性抗原(stage-specific embryonic antigen,SSEA)、胚胎干细胞关键蛋白Oct-4、Stro-1等[17-18]。
原代间充质干细胞经过平板培养贴附于培养容器表面,不贴壁的造血干细胞被逐渐冲洗掉,经过3次传代可得到纯度较高的间充质干细胞群,具有较强的扩增能力[19-21]。间充质干细胞不仅可分化为间叶组织来源的脂肪细胞、成骨细胞、软骨细胞等,在恰当的诱导条件下也可以跨系分化为神经细胞、肝细胞、肠上皮细胞、肾上皮细胞等[22-25]。此外,间充质干细胞可以通过表达及分泌多种细胞因子和生长因子,起到调控组织细胞增殖、造血功能和免疫功能的作用[26-28]。因此,间充质干细胞成为继造血干细胞后,最有希望成为进入临床应用阶段治疗免疫性疾病和多种组织损伤相关疾病的另一个成体干细胞。
2.1.2 间充质干细胞用于临床治疗的基本要求 根据国际细胞治疗协会间充质干细胞委员会的要求[29],间充质干细胞的认定需具备3个基本条件:①细胞在体外培养环境中贴壁生长。②细胞表型中CD73、CD105、CD90的阳性率大于95%,而CD34、CD45、CD14或CD11b、CD79a或CD19及HLA-DR阴性率大于95%。③细胞体外培养时具有分化为成骨细胞、脂肪细胞和软骨细胞的潜能。需要指出的是,随着间充质干细胞的大量体外扩增,以上表面分子的表达水平会有迅速的下降,分化能力逐渐降低,同时,生长环境的差异也会导致间充质干细胞体外培养出现明显的异质性,分化为不同种类的细胞[30-32],原有的细胞功能将大打折扣。因此,各国学者试图从细胞分离、培养等多方面进行方法学优化,发明了流式细胞免疫磁珠分选、三维动态培养等多种新技术,以在体外扩增过程中保持间充质干细胞的表型、分泌功能及分化潜能。有研究表明,间充质干细胞体内植入不需要进行主要组织相容性复合体(MHC)的匹配,亦不需使用免疫抑制剂[33-34],因此可来源于同种异体的捐赠者,且能够冻存复苏,可以方便地应用于临床。
2.2 间充质干细胞促进肝脏移植后功能恢复
2.2.1 间充质干细胞介导肝脏修复的相关机制 体外实验证明间充质干细胞具有一定的向肝细胞分化的潜能[35-36],在合适的诱导条件下能够成为肝祖细胞的前体,促进肝细胞再生和组织修复;另一方面,Vassilopoulos等[37]通过体内实验也证明了注射入受损伤肝脏部分的间充质干细胞也能分化为肝细胞。这一发现为治疗移植相关的肝功能衰竭提供了一种新的可能。此外,间充质干细胞所介导的肝脏修复机制还在于其强大的旁分泌作用。间充质干细胞能够分泌血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)、单核细胞趋化蛋白1(MCP1)、基质细胞源性因子1(SDF-1)等,发挥促进微血管重建和肝细胞增殖的功能。间充质干细胞还能够分泌存活素(Survivin)、Akt激酶等蛋白成分,从而抑制细胞凋亡[38]。
2.2.2 间充质干细胞改善移植肝功能 缺血再灌注损伤是影响边缘性供肝质量的重要因素[39],对移植后肝功能不全的发生具有重要的作用,显著增加受者死亡率。English等[40]发现间充质干细胞介导的缺血再灌注损伤保护作用能够在一定程度上消除利用边缘性供肝的不良影响,其机制可能与固有的免疫抑制作用有关。这种作用在炎性反应的环境中得到明显增强,从而减少细胞凋亡,刺激管状上皮细胞增生,进一步促进移植器官的功能修复。
其中,减体积肝移植因短暂性门脉高压和炎性反应易受到缺血再灌注损伤的影响,抑制了移植肝的再生。因此,其理想的治疗措施在于减小肝脏损伤,促进快速再生。Du等[41]在50%的减体积肝移植大鼠模型中应用间充质干细胞条件培养基处理,发现实验组血中炎性因子含量和转氨酶水平显著低于对照组,组织坏死更轻;同时,间充质干细胞促进了肝窦内皮细胞和肝实质细胞的增殖,而前者又能通过供氧和营养物质帮助肝细胞再生;实验组受体存活时间亦更长。还有学者利用基因工程的方法对间充质干细胞进行修饰,使其分泌目标因子,协同促进肝脏修复。例如,Yu等[42]将表达肝细胞生长因子的间充质干细胞通过门静脉注入30%减体积肝移植大鼠模型中,发现层粘连蛋白、透明质酸等纤维化指标明显优于对照组,血清肝酶及胆红素水平更低,从而明确了其抗纤维化的作用。
鉴于间充质干细胞强大的再生及分化潜能,有众多研究者将其用于组织工程肝脏的种子细胞,以构建肝样组织行肝脏辅助移植[43-45]。Jiang等[43]将骨髓间充质干细胞种植于脱细胞处理的小鼠肝脏支架上,经过体外诱导分化培养,移植入CCl4诱导的急性肝衰竭模型中,发现肝细胞坏死明显减轻,再生能力得到增强,受体生存时间亦显著长于对照组。可见,利用间充质干细胞构建组织工程肝脏的方案,有助于补充供肝的严重短缺。
2.3 间充质干细胞减小肝移植术后免疫排斥反应
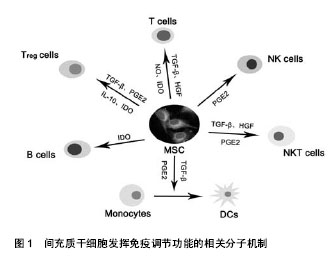
2.3.1 间充质干细胞的免疫调节功能 间充质干细胞能够发挥调节免疫反应的作用,已在免疫学和器官移植领域吸引了大量研究者的兴趣。其免疫耐受和调节机制可能与缺乏主要组织相容性复合体-Ⅱ、共刺激分子CD80、CD86、CD40等的表达及调节T细胞、B细胞、NK细胞、DC细胞的增殖和功能有关[46-48],但尚未完全清楚。研究表明,间充质干细胞能够抑制包括啮齿类、灵长类、人类在内的多物种外周血单核细胞、脾细胞、CD4+T细胞、CD8+T细胞、B细胞的增殖[49-51],同时还具有抑制树突状细胞的成熟和抗原呈递,抑制免疫细胞间相互作用的功能[52]。此外,间充质干细胞还通过诱导CD4+CD25+FoxP3+Tregs等细胞的增殖发挥免疫调节、辅助免疫耐受的作用。
近年来,由间充质干细胞所介导的免疫抑制作用的相关分子机制,尤其是其分泌的细胞因子在其中的功能已得到大量的研究证实(图1)。肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)、转化生长因子β1(TGF-β1)、肝细胞生长因子(HGF)、白细胞介素10(IL-10)、前列腺素E2(PGE2)、吲哚胺2,3双加氧酶(IDO)等分子参与了间充质干细胞介导的免疫抑制作用[53-56],但其中的关键因子仍然不明确。Sheng等[49]发现IFN-γ-/-小鼠来源的淋巴细胞增殖不能被间充质干细胞抑制,除非外源性添加干扰素γ。Aggarwal等[57]证实了前列腺素E2抑制剂能够部分阻断间充质干细胞对外周血单核细胞增殖的调控作用。朱金海[55]证明了门静脉输注人肝细胞生长因子修饰的骨髓间充质干细胞至大鼠同种异体肝移植模型能成功诱导免疫耐受,其免疫抑制作用与诱导Th1细胞向Th2细胞偏移、减少肝细胞凋亡、促进肝细胞增殖有关。
间充质干细胞在体内的免疫调节作用通过一系列动物模型和临床试验所证实。Zhou等[58]发现在大鼠心脏移植模型中于术前给予供者来源的间充质干细胞能够抑制体内T细胞应答,延长移植物寿命。在另一项关于自活化T细胞介导的自身免疫性脑脊髓炎小鼠模型研究中[59],系统应用间充质干细胞能够通过诱导外周免疫耐受显著改善相关症状。同样,人源间充质干细胞亦被用于治疗同种异体骨髓移植受者的移植物抗宿主病,改善患者预后[60]。需要强调的是,体外实验的研究结果并不能直接地应用于体内实验中,例如大量的细胞植入可能引起栓塞并发症,体内外细胞环境的差异也可能使间充质干细胞的免疫抑制作用发生不确定的变化。因此,严密追踪间充质干细胞体内移植的定位及功能变化是保证其有效性和安全性的一项重要的任务。
2.3.2 间充质干细胞用于肝移植术后免疫抑制 肝移植术后免疫排斥反应是尚未得到圆满解决的普遍问题。其中,超急性排斥反应多发生于移植术后48 h以内,由受者体内原有抗体针对移植物抗体产生作用;急性排斥反应多发生于术后1周至3个月内,由T细胞及抗体共同介导;慢性排斥反应多发生于移植3个月以后,是因为移植物免疫耐受平衡受到破坏导致,主要由抗体介导[61]。除超急性排斥反应外,其他大多数免疫排斥反应能够被常规免疫抑制剂所抑制。但是,目前仍然没有一种免疫抑制药物能够实现靶向性抑制宿主体内专门针对移植物抗原的排斥反应[62],因此长期服用免疫抑制剂会导致受者全身免疫系统的紊乱,出现一系列药物相关并发症。
间充质干细胞的免疫调节功能为肝移植后免疫抑制提供了新的解决方案。鉴于间充质干细胞在其他器官移植模型中的可靠表现,将其扩展到肝移植领域的尝试已在世界范围内获得广泛的重视和开展。来自匹兹堡大学的肝移植先驱Starzl教授等[63]发现骨髓间充质干细胞能够减少肝移植术后中性粒细胞浸润,他认为间充质干细胞是目前最具潜力的诱导肝移植术后免疫耐受的细胞。Niu等[64]学者在大鼠肝移植后30 min由颈静脉注入经过基因工程改造的MSCs-IL-10,受体生存期得到显著延长(112 d vs. 8 d,P < 0.000 1),免疫排斥反应明显减轻。但另一些研究者认为单独应用间充质干细胞并不能起到肝移植术后免疫抑制的作用[65-66],而必须与适量的免疫抑制剂如霉酚酸酯、雷帕霉素等联合使用,协同诱导免疫耐受的产生。
2.3.3 临床试验研究进展 尽管间充质干细胞在肾移植领域用于移植免疫排斥反应的临床试验已有多项完成或正在进行[67-69],但应用于肝移植的临床试验尚处于起步阶段。在欧洲进行的一项二期临床试验证实[70],HLA匹配的同胞供者或单倍体供者、及第三方HLA错配供者来源的间充质干细胞在治疗急性激素抵抗型移植物抗宿主病中,在半数以上受者体中均具有显著的疗效。另有几项间充质干细胞应用于肝移植的临床试验正在进行,包括德国雷根斯堡大学医院主持的“Safety and feasibility of Multipotent Adult Progenitor Cells for Immunomodulation Therapy after Liver Transplantation: A Phase I Study of the MiSOT Study Consortium”项目(注册号:Eudra CT 2009-017795-25,2011年)[71]和法国列日大学医院主持的“Mesenchymal Stem Cells After Renal or Liver Transplantation”项目(注册号:NCT01429038,2011年),亦有中国302医院的学者参与其中,但尚未见明确的试验结果公开报道。在每年召开的世界MISOT大会上也有大量关于间充质干细胞辅助实质器官移植的原理及应用讨论。相信更多临床试验的结果将会进一步阐明间充质干细胞用于肝移植术后免疫抑制的有效性和安全性。
