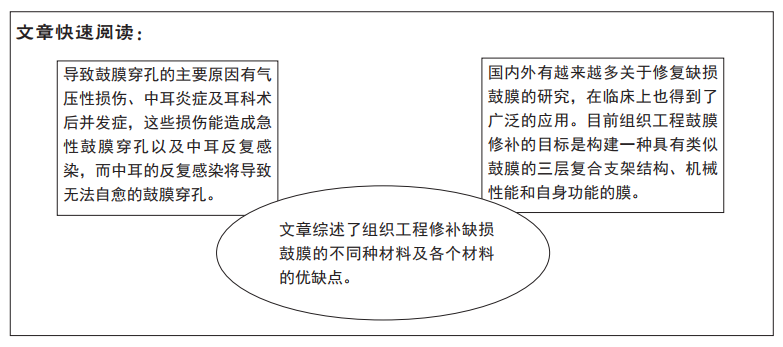
2.1 鼓膜穿孔的修补原理及现况 大多数鼓膜急性穿孔只要避免外耳道进水和感染就可以在几周以后自愈,持续存在的穿孔则需要修补。鼓膜穿孔部位的闭合首先通过上皮细胞的增殖和角蛋白聚集,然后由纤维层增生来完成。鼓膜穿孔初期边缘会有淋巴细胞、组织液及血液渗出,渗出液会形成一层膜,一方面避免破损处组织暴露在空气中而脱水,另外一方面为周围细胞游出作为支架;随后柱状上皮扩增,穿孔中央产生大量角蛋白,最后穿孔处由结缔组织修补[14]。
鼓膜修复主要是靠上皮细胞的迁移和扩增,而鼓膜修补的不同材料也就充当了支架的作用,即诱导穿孔边缘的细胞向中央生长修补穿孔。组织工程修补材料均可吸收,比如明胶海绵(Spongostan?)、胶原(Gelita?)及自体组织[5]。手术时将人工材料放置在穿孔部位,为鼓膜穿孔的修补提供支架,协助穿孔边缘的细胞迁移[15]。
目前临床上使用最多的鼓膜修补材料有颞肌筋膜、脂肪组织、软骨膜、耳屏软骨等,并有学者将以上诸类方法的疗效做过对比研究[16-17]。颞筋膜移植物仍是临床的金标准,其优点在于取材方便、植入方法简易,但具有术后容易卷曲、易感染和自体溶解等缺点。脂肪组织移植物的优点在于其获取方法简便快捷、复发率低,并且其修补成功率与颞筋膜修补的成功率相似;另外,脂肪组织可以分泌血管再生因子和生长因子,这些因子可以提高再血管化,增加穿孔周围血供,促进组织再生[18]。软骨膜移植物具有回弹率低、易获取、抗拉能力好、具有与鼓膜相似的传导性能等优点[19]。此外,软骨代谢缓慢,在负压、咽鼓管功能障碍等不良状态下较稳定[20]。软骨膜移植的缺点是其削弱了鼓膜的机械振动模式,导致高音调的功能损害以及并发胆脂瘤的潜在风险。
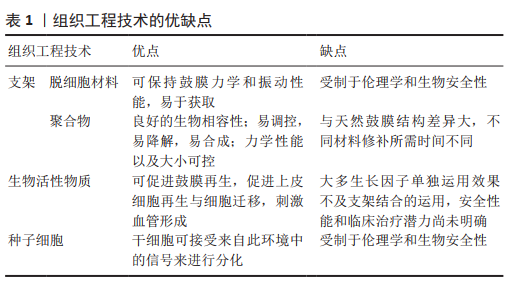
2.2 鼓膜修补的组织工程技术 组织工程技术的诞生为鼓膜修补提供了一条更有潜力的修补途径。目前组织工程鼓膜修补的目标是构建一种具有类似鼓膜的3层复合支架结构、机械性能和自身功能的膜。
目前组织工程鼓膜修补有3种方法:构建一种包含支架结构、种子细胞和生长因子的人工鼓膜;应用支架材料放置于穿孔部位,局部使用生长因子;将生长因子浸泡的支架材料修补鼓膜穿孔[2] 。近年来组织工程方法对鼓膜再生的研究逐渐兴起,已有学者利用外源性生物分子支架修复鼓室穿孔。然而,现在这项技术被用来指不同尺寸和形状的生物材料的设计。该综述将分别考虑3种可用来施行组织工程的材料(支架材料、生物分子和细胞),这3个因素可单独或结合使用[2,5]。
2.2.1 用于鼓膜修补的支架结构 鼓膜具有再生功能,但其再生过程与其他组织不同的是上皮层下无支撑,也正是由于这个原因,临床上鼓膜修补会应用各种支架材料或移植物以促进细胞及营养因子能够趋化到穿孔处进行修补[14]。
目前应用最多的移植物是颞肌筋膜、脂肪组织、软骨及软骨膜等,而组织工程则是大量的新型材料[5,13,18,21]。理想的组织工程支架需要具有跟鼓膜结构层次完全相同的特点,但事实上目前没有一种材料可以达到此特点,因此现代的组织工程旨在改善现有支架的性能,以获得最合适的材料和更好的鼓膜修复结果[2]。目前的组织工程支架材料主要分为脱细胞材料和聚合物两大类。
用于鼓膜修补的脱细胞材料:脱细胞材料是通过去除同种异体或异种异体的细胞,保留其天然三维空间结构、组织生长微环境和机械性能的外基质作为细胞组织重建的模板,比如胶原和蛋白多糖[2,5,22]。
目前已有报道的天然支架材料有:供体人或猪腹膜提取的脱细胞胶原[23]、供体人或猪皮肤提取的脱细胞真皮基 质[2,5]、脱细胞膀胱[20]、去细胞猪小肠黏膜下层以及牛或马的去细胞心包膜等[2,5,21,24]。运用脱细抱真皮基质修补慢性穿孔鼓膜,脱细胞真皮基质是彻底清除异体皮肤真皮中所有细胞成分,完好保留真皮的三位框架结构,移植后可作为上皮细胞、成纤维细胞、新生血管形成的一个良好支架,且具有良好生物和结构相容性。脱细胞真皮基质最大的优越性在于不需要依靠受体的血供成活,而是利用其特有的三维结构的天然细胞外基质引导宿主细胞长入,为细胞生长提供场所和空间,促进表皮细胞附着和增生[25]。脱细胞猪小肠黏膜下层制备的双层生物移植物用于鼓膜穿孔也有明显效果,该实验将双层该移植物植入鼓膜穿孔部位,结果显示穿孔病例都有明显的移植物内生血管征象,该移植物由4层脱纤维化组织组成。有研究采用冷冻干燥制备脱细胞猪小肠黏膜下层组织,并将其制备成合适大小的圆盘形或方形[26]。有学者称脱细胞小肠黏膜下层组织有助于组织重塑[27]。还有研究发现,使用来自于猪腹膜Ⅰ/Ⅲ型胶原脱细胞支架联合碱性成纤维生长因子,支架提供结构支持指导组织再生,生物活性分子促进细胞增殖和迁移。猪腹膜Ⅰ/Ⅲ型胶原脱细胞支架联合碱性成纤维生长因子有助于胶原再生,胶原是鼓膜的主要成分,在保持鼓膜的力学和振动性能方面起着至关重要的作用。猪腹膜Ⅰ/Ⅲ型胶原脱细胞支架联合碱性成纤维生长因子修复后的鼓膜,具有3层结构组织良好的胶原纤维和均匀的厚度,类似于正常的鼓膜,而不是自发愈合鼓膜中具有水肿的松散无序的胶原纤维。该实验仅用于急性穿孔,慢性鼓膜穿孔的修复还有待研究[28]。这些实验旨在通过这些材料构建出具有和鼓膜结构层次一致的再生鼓膜,以提高鼓膜修补的成功率和最大化恢复听力。但一些材料由于受制于伦理学和生物安全性等原因,临床试验目前开展仍十分困难。
用于鼓膜修补的聚合物:人工聚合物由于更易对其性质、大小及孔隙率进行调控,并且具有很好的生物相容性、易降解、易于合成、力学性能可控等优点,因此较天然支架结构更容易应用于临床。但是人工聚合物不能生成与鼓膜天然结构一致的新生膜[2,6]。
明胶海绵常用于外伤性鼓膜穿孔、鼓膜重建及听骨重建的支架材料[2,29],其具有生物相容性、促进鼓膜闭合、增加鼓膜闭合率等优点[24]。也有研究表明,在筋膜移植物的外层涂以橡胶树提取物多聚赖氨酸会促使鼓膜血管化[30];有可能存在血管生长因子通过促进血管生成使筋膜移植物血管化[29]。
丝蛋白也常用作鼓膜修补的支撑物,它是去除掉桑蚕丝里的免疫原性物质,其弹性好、可降解并具有生物相容性,作为缝合材料已运用于临床多年。丝蛋白比较容易贴附,因此可以促进细胞贴壁[2,31-32]。有研究表明,人角化细胞在丝蛋白补片支架上生长的更好。应用丝蛋白作为支架鼓膜修补所需时间明显减少,听力恢复较快[5,23,32-33],因此目前丝蛋白修补人工鼓膜已申请专利[15]。丝蛋白可以持续提供水合表面,新生鼓膜的透明度和3层结构与原始鼓膜相似,鼓膜闭合时间与听力恢复时间都较短[30-32]。
壳聚糖是一种黏多糖,具有抗菌能力,广泛存在节肢动物的骨骼中,可以提高皮肤、骨骼、肝脏的愈合能力。目前已经成功地合成了水溶性和非水溶性壳聚糖补片用于修补鼓膜缺损,并有研究表明其效果优于其他材料[5,34-36]。水溶性壳聚糖的治愈率堪比自愈率,比自然修复的鼓膜具有更高密度的胶原蛋白和更加规则的组织结构;非水溶性壳聚糖使鼓膜细胞更好地增殖,且具有生物相容性,与纸贴片相比其新生成的鼓膜质量更好;3D支架壳聚糖的细胞增殖良好,具有的多孔结构易于浸润细胞,新生成的3层膜结构与自然鼓膜类似[33-35]。
藻酸盐是一种海藻中提取的天然聚合物,可为黏膜上皮和角化上皮的再生提供支架,帮助组织再生,但其安全性还有待进一步研究[2,5,37]。透明质酸可以塑形成各种固体支架材料,也能被用作局部生物活性物质用于组织工程鼓膜缺损的修补[2]。有研究者使用细菌纤维素纳米贴片,其具有超微结构和高纯度纳米纤维网络结构、较好的生物相容性、透明性及适当的力学性能,所以可以作为一个有效的伤口愈合平台[38],因为细胞迁移到伤口部位是由细胞外基质的结构性质决定,而细菌纤维素贴片可引导鼓膜细胞的增殖和迁移,修复后的鼓膜使听力恢复至正常。该研究证明,使用细菌纤维素贴片再生的鼓膜比自发愈合的鼓膜具有更好的质量和结构。
还有研究者抽取患者自身的血液,通过离心、提取、压片得到厚度约为1 mm富含血小板的纤维蛋白膜,其具有良好的拉伸性,还可根据穿孔的大小定制膜的大小。该修补方法取材方法简易、成功率高,并发症概率小[39]。
用于鼓膜修补的生物活性物质:在大多数组织中生长因子可以刺激伤口愈合。动物实验表明,在鼓膜再生的过程中生物分子和其受体呈高表达[2,5]。鼓膜穿孔的愈合过程其实是一个上皮细胞再生和迁移的过程,因此外源性生长因子可以促进鼓膜再生[40]。目前生长因子可以分为以下五大类:上皮生长因子、纤维生长因子、血小板源性生长因子、转化生长因子、类胰岛素生长因子。目前用于鼓膜穿孔修补研究的生长因子主要是前两种。这类生长因子在使用时可以作为滴剂,也可以作为支架材料的浸泡液[2,5]。
表皮细胞生长因子可以刺激DNA、RNA、蛋白质及核酸的合成。研究发现,鼓膜损伤后其上皮细胞和基质细胞内表皮细胞生长因子受体含量增高,修复过程中表皮细胞生长因子也相应增加。有研究表明,表皮细胞生长因子通过刺激角化细胞的增殖和迁移促进鼓膜的愈合[41],并且可以刺激上皮细胞和角化细胞的增殖[42]。相应地,如果穿孔后表皮细胞生长因子受体的数量没有增加,那么鼓膜穿孔的愈合也会相应延迟[2]。生长因子一般在损伤后表达,但动物实验表明,局部使用生长因子可刺激新生血管和成纤维细胞形成,其应用后新生鼓膜组织学特征与原始鼓膜相似。有研究者运用生物羊膜结合人重组表皮生长因子的方法修补48例创伤性鼓膜穿孔,有效率达97.9%。该研究者认为生物羊膜为人类胎盘的基底膜胶原组织,它具有良好的附着力,能隔离外部的病原菌,促进上皮愈合,对人体具有极低的抗原性。人重组表皮生长因子是与天然表皮生长因子活性和结构高度一致的产物,对创面修复有明显的促进作用,它能使血管扩张、血流加快,促进组织代谢、再生[43]。转化生长因子α作为表皮细胞生长因子家族的一员也常用于鼓膜再生,在鼓膜再生中其表达与表皮细胞扩增相关[2,44-45]。在正常鼓膜中不存在转化生长因子α,但在穿孔后会出现,对比表皮细胞生长因子更有活性和动力[44,46-48]。转化生长因子β在鼓膜再生中具有趋化性诱导、产生细胞外基质、刺激血管生成等优点,但会导致瘢痕过多、鼓膜增厚[45]。
在成纤维细胞生长因子家族中,研究最多的是碱性成纤维细胞生长因子。在鼓膜损伤后,碱性成纤维细胞生长因子通过各种机制促进鼓膜愈合[2]。碱性成纤维细胞生长因子受体主要集中在上皮层和黏膜层,但碱性成纤维细胞生长因子主要在上皮层表达[49]。碱性成纤维细胞生长因子同时也可以诱导黏膜下结缔组织生长[50]。另一方面大量临床研究表明,在行鼓膜修补术前,将支架材料浸泡在富含碱性成纤维细胞生长因子液体中,术后鼓膜愈合率明显增高,但是这些结果在仅使用支架材料时是不显著的。人重组碱性成纤维细胞生长因子是一种细胞生长因子,通过与创面的相应受体结合促进中胚层和外胚层的细胞修复和再生,加速创面愈合。有研究者将人重组碱性成纤维细胞生长因子喷于明胶海绵后贴附于穿孔鼓膜表面,该方法与自然愈合相比明显愈合更快[51]。这些实验表明,使鼓膜愈合不是支架本身的原因,而是支架与生长因子的结合,这是修复鼓膜穿孔的关键[40]。
自体血清含有多种生长因子,维生素和免疫球蛋白,能够调节各种组织的增殖,促进伤口的愈合。自体血清滴耳液给药对人慢性穿孔的治疗是有益的;此外,它减少了手术程序,激活穿孔边缘,且患者自身也可以产生生长因子。然而,还需要更多的研究来证明这些结果是否是由于自体血清单独的作用所致[17]。
2.2.2 用于鼓膜修补的种子细胞 细胞在再生医学中起着核心作用。移植细胞可用于再生新组织,调节免疫反应,并通过旁分泌信号素改变固有细胞行为,这些因素可以在体外作为控制细胞行为的工具,也可以在体内改变再生的过程[52]。支架结构、生物分子和细胞相互作用,以实现鼓膜的再生。但由于鼓膜的自然修复能力和来自穿孔边缘的内源性细胞来源,大多数研究不使用细胞,因此通常只有能够为穿孔鼓膜召集细胞的支架结构和活性分子才会被使用[5]。细胞可以通过滴注或浸泡在支撑材料中。虽然有不同的细胞来源可以用于鼓室再生,但到目前为止只有少数动物研究得以实现[53-56]。
考虑到干细胞的再生能力,人们也对干细胞进行了研究。有研究者利用小鼠胚胎干细胞,这些细胞在穿孔鼓膜中的分化和整合,取得了很好的结果[55-56]。但人间充质干细胞的应用未见报道[56-57]。干细胞有一个关键的特征,那就是它们可以根据从接受来此环境中的信号来进行分化,因此干细胞的成熟可能会受到耳部微环境的影响。修复鼓膜的目的是使大多数细胞成为中间层的成纤维细胞,该层细胞的再生是最难实现的,因此干细胞与成纤维细胞生长因子的联合使用可刺激细胞分化为成纤维细胞。在生物相容性和可吸收性聚合物支架中植入骨髓间充质干细胞,加入生长因子在体外分化成纤维细胞。此外,这些生物结构在培养过程中经历机械压力,以促进成纤维细胞的分化。这一过程提高了Ⅱ型胶原蛋白的产量,该胶原蛋白是人类鼓膜中间层的组成蛋白[56]。
但是,使用干细胞也与安全性问题(例如感染、排斥和肿瘤形成)有关,还有道德和法律问题,因此对这一领域的研究较少;此外在锤骨柄中发现了干细胞,这表明鼓膜本身存在再生干细胞的可能性[58]。因此,如果残余的鼓膜有干细胞,也就没有必要加入外来细胞源来完成鼓膜修复[2]。尽管干细胞在实验研究中有很大的作用,但这一事实和使用干细胞的问题说明,应用干细胞治疗鼓膜穿孔或寻找其他细胞来源可能比较困难[5]。

 文题释义:
文题释义: