中国组织工程研究 ›› 2014, Vol. 18 ›› Issue (32): 5173-5177.doi: 10.3969/j.issn.2095-4344.2014.32.015
• 脂肪干细胞 adipose-derived stem cells • 上一篇 下一篇
豚鼠脂肪间充质干细胞植入耳聋模型修复听力的作用
王晓燕1,吉 彬1,李兵兵2,毕晓娟3,刘立中4
- 新疆医科大学第一附属医院,1耳鼻咽喉科,3医学研究中心,4干部保健特诊科,新疆维吾尔自治区乌鲁木齐市 830054;2莆田市第一医院骨科,福建省莆田市 351100
Hearing restoration in a deaf animal model with transplantation of adipose-derived mesenchymal stem cells from guinea pigs
Wang Xiao-yan1, Ji Bin1, Li Bing-bing2, Bi Xiao-juan3, Liu Li-zhong4
- 1Department of Otorhinolaryngology, 3Medical Research Center, 4Department of Cadres, First Affiliated Hospital of Xinjiang Medical University, Urumqi 830054, Xinjiang Uygur Autonomous Region, China; 2Department of Orthopedics, the First Hospital of Putian City, Putian 351100, Fujian Province, China
摘要:
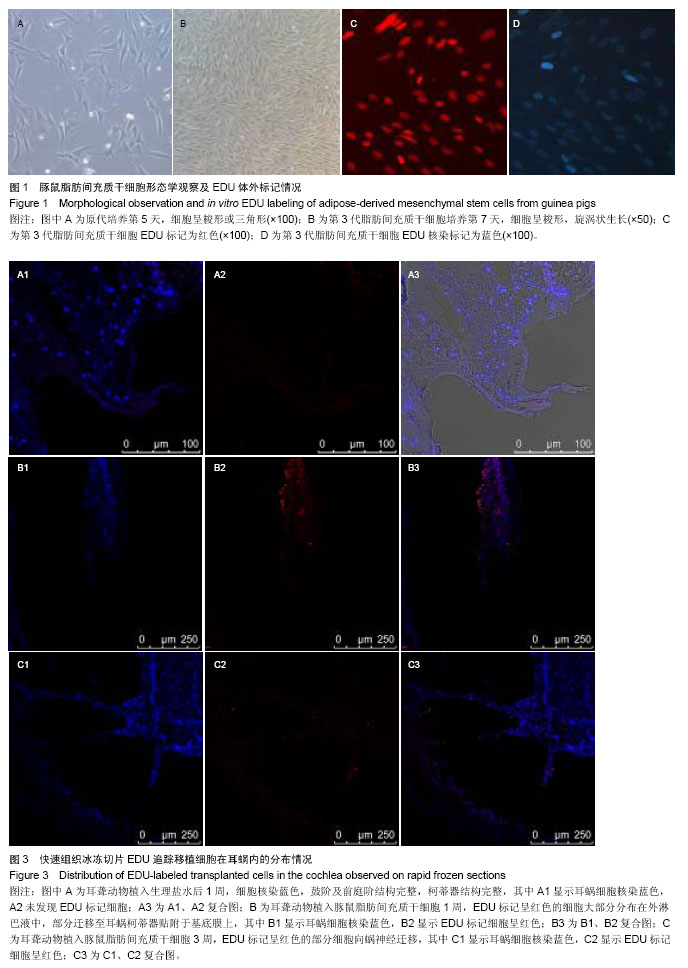
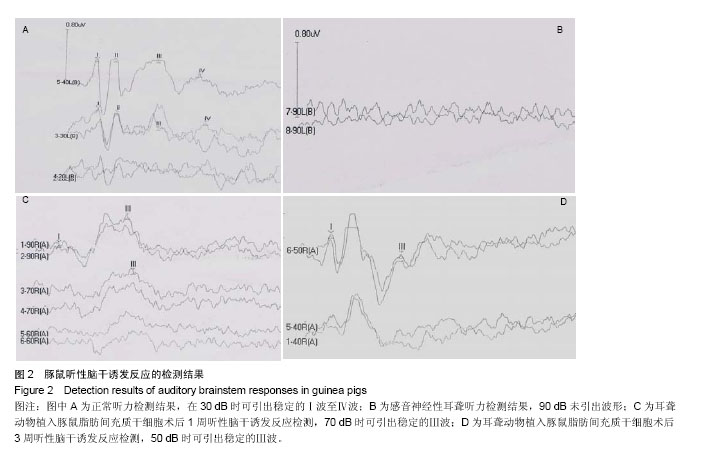
背景:脂肪间充质干细胞是否是治疗因毛细胞退化、缺失所造成的感音神经性聋的福音呢? 目的:探讨豚鼠脂肪间充质干细胞经耳蜗鼓阶途径植入感音神经性耳聋动物模型后对听力的修复作用。 方法:庆大霉素腹腔注射建立豚鼠感音神经性耳聋动物模型,耳蜗鼓阶途径植入豚鼠脂肪间充质干细胞,分别于植入后1,3周检测听性脑干反应,观察植入脂肪间充质干细胞后耳聋动物听力的变化;并追踪EDU标记的豚鼠脂肪间充质干细胞在耳蜗内的迁移及分布情况。 结果与结论:在植入后1周及3周进行听性脑干反应检测,听力较移植前逐渐好转。植入细胞后1周,细胞大多分布在外淋巴液中,部分迁移至耳蜗柯蒂器贴附于基底膜上,植入细胞后3周,细胞不仅迁移并贴附在Corti器基底膜发挥作用,而且部分迁移到蜗神经,植入时间越长,存活细胞越少。结果表明豚鼠脂肪间充质干细胞通过耳蜗鼓阶途径微孔植入,可以定向迁移并存活最终达到提高听力的目的。
中图分类号: