设计:细胞学体外观察实验。
时间及地点:实验于2013年9至12月在吉林省拓华生物科技有限公司细胞实验室完成。
材料:取自四平市中心医院足月健康剖宫产孕妇自愿捐献的胎儿脐带、药物流产胎儿(胎龄两三个月)。供者肝炎病毒标志物、梅毒、HIV检测均阴性。实验经医院伦理委员会批准。均在无菌环境下采集标本。
实验方法:
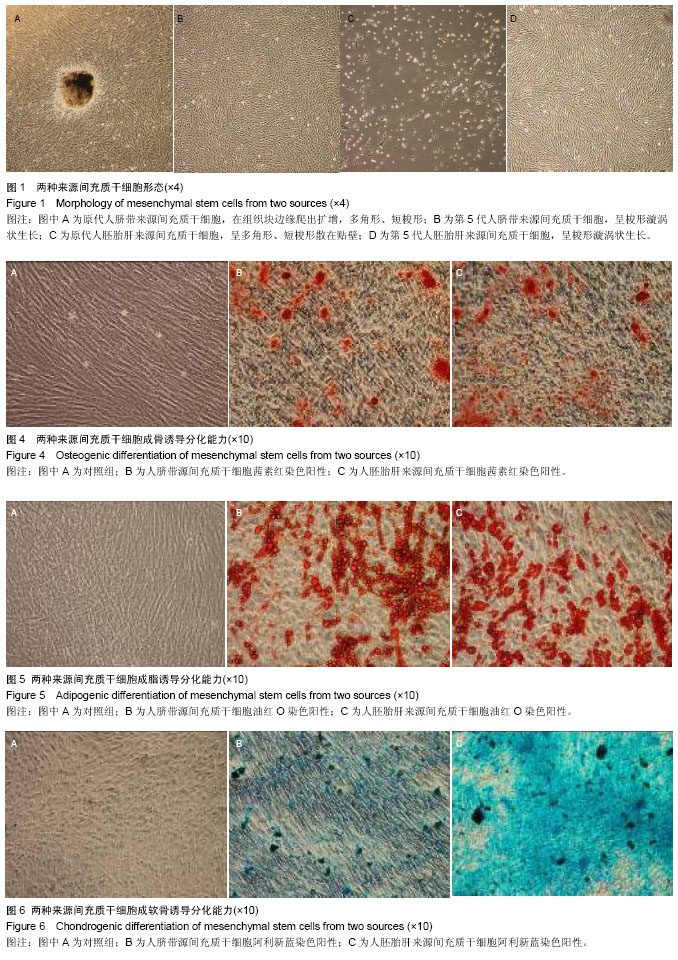
人脐带源、胎肝来源的间充质干细胞的提取及培养:按照本实验室建立的两种来源间充质干细胞的提取方法进行分离培养获得间充质干细胞[10-12]。实验所使用的完全培养基均为:α-MEM(包含体积分数为8%胎牛血清)。两种来源干细胞培养至第4代时,均以2×104/cm2的细胞密度接种于T75的细胞培养瓶中,分别观察细胞形态,细胞生长融合度。
|
间充质干细胞生长特性实验仪器与试剂:
|
|
试剂、仪器
|
来源
|
|
α-MEM培养基
|
Hyclone 公司,CAT: SH30265.01
|
|
特级胎牛血清
|
Hyclone 公司,CAT: SV30087.02
|
|
胰蛋白酶
|
GIBCO公司
|
|
细胞培养瓶、离心管
|
美国CORNING公司
|
|
二氧化碳培养箱
|
美国Thermo 371型
|
|
倒置显微镜
|
日本Olympus CKX41
|
|
流式细胞仪
|
美国BD FASCCalibur
|
|
离心机
|
美国Thermo Mutifuge 4KR
|
|
生物安全柜
|
北京东联哈尔仪器公司
|
|
程序降温盒
|
美国 Nalgene
|
|
细胞计数板
|
上海求精生化仪器有限公司
|
|
脐带源间充质干细胞的提取及培养:无菌取足月剖宫产健康胎儿脐带,采集后6 h内无菌环境下处理。用PBS洗涤剪成小段,再除血管后剪碎。用PBS洗涤3次,1 200 r/min离心10 min。将沉淀用少量培养基浸润混匀后,种到培养皿中于体积分数为5% CO2培养箱内培养。48 h首次换液,培养第5,8,11天再换液,第9天可看到有细胞从组织块边缘爬出,到第13天细胞长满皿底,此时用PBS冲掉组织块,0.25%胰酶消化贴壁细胞,用含体积分数为8%胎牛血清的α-MEM培养基进行传代培养。
胎肝来源间充质干细胞的提取及培养:无菌取出胎肝,用PBS冲洗数次,剪碎后用0.25%胰酶消化后4 ℃过夜。次日取出于37 ℃继续消化 5-10 min,吸出细胞悬液,在剩余组织中加入0.1%的Ⅱ型胶原酶,37 ℃中和10 min,消化后组织用200目筛网过滤,获得的细胞悬液1 000 r/min离心5 min,细胞沉淀用PBS洗2次。将细胞沉淀置于含体积分数为8%胎牛血清的α-MEM培养基中悬起接种到培养瓶中,置于37 ℃、体积分数为5% CO2培养箱中培养。48 h 后吸出悬浮细胞液体,更换新培养液;随后两三天换液1次,待细胞生长至10 d左右达80%以上融合后,用0.25%胰酶消化进行传代培养。
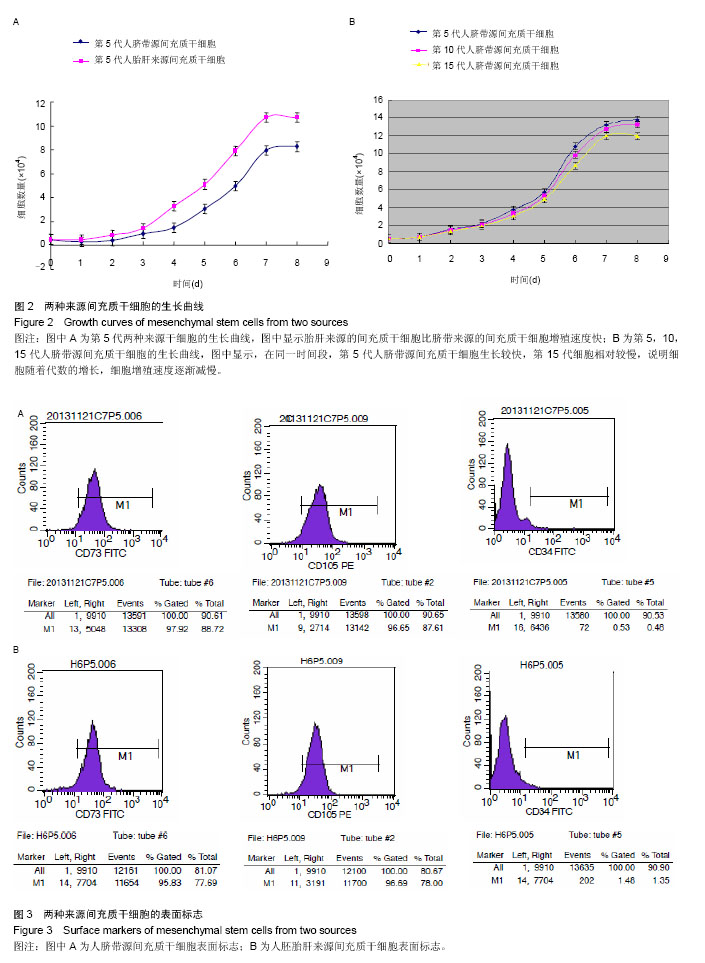
制作生长曲线[13-14]:分别收集生长融合90%的第4代两种来源间充质干细胞,调整细胞浓度,接种于24孔板中。每孔接种1 mL,细胞浓度为5×106 L-1,此时细胞已为第5代细胞。每日消化收集连续3个孔的细胞,由2名有多年细胞培养和计数经验的技师对收集的细胞进行双盲计数,每人每份细胞重复计数3次,最后计数平均值。按此方法连续培养8 d,并每日收集细胞并计数。以培养时间为横轴,细胞数为纵轴,绘制细胞生长曲线。
将脐带源间充质干细胞以1∶3的比例继续培养,培养至第9代和第14代分别再接种于24孔板中,按照第4代细胞接种并计数的操作方法绘制生长曲线。
计算群体倍增时间:根据生长曲线的对数增殖期计算群体倍增时间[15]。Patterson公式为Td=T×[lg2/lg (Nt2/Nt1)],T代表生长曲线中的对数增殖时间段(t2-t1),Nt1是对数增殖期起始时间拐点的细胞数,Nt2是对数增殖末期的细胞数。据此公式分别计算第5代两种来源间充质干细胞和第10,15代脐带源间充质干细胞的群体倍增时间。
细胞表面标志检测:两种来源第5代间充质干细胞分别用0.25%胰酶(含1 mmol EDTA)消化,PBS洗涤2次,制备成终浓度为1×109 L-1的细胞悬液,分装入试管中,每管0.1 mL。分别加入FITC标记的小鼠抗人CD34、CD73、PE标记CD105单抗,同时以加入α-MEM培养液作为阴性对照。黑暗中孵化15 min后,上流式细胞仪检测。
细胞分化能力检测:
成骨诱导:用0.25%胰酶(含1 mmol EDTA)消化两种第5代细胞后,以3×108 L-1的细胞浓度接种于预置多聚赖氨酸预处理盖玻片的6孔板内。加入含有1×10-8 mol/L地塞米松、1×10-2 mol/L β-甘油磷酸钠、1.5×10-4 mol/L维生素C的α-MEM培养液诱导培养,同时以单独加入α-MEM培养液作为阴性对照,每3 d换液1次。诱导14-21 d取出细胞爬片,进行茜素红染色。
成脂诱导:将消化后的第5代细胞接种于预制盖玻片的6孔板中,每孔约3×103个细胞,每孔加入2 mL完全培养基。放入37 ℃,体积分数为5%CO2孵箱中培养。24 h后,移去旧的培养液,实验组换成脂诱导液(含1 μmol/L地塞米松、0.5 mmol/L IBMX,10 mg/L胰岛素、100 mg/L吲哚美辛和体积分数为8%胎牛血清的α-MEM培养液),对照组仍用完全培养基培养。以此计为诱导第1天。每3 d换液,诱导14-21 d进行油红O染色。
成软骨诱导:收集第5代细胞接种于6孔板中,每孔3×103个细胞,将6孔板放入37 ℃,体积分数为5% CO2培养箱进行培养。3 d换液1次诱导液(含转化生长因子β1 20 μg/L、维生素C 10 mmol/L),诱导第15天进行阿利新蓝染色观察诱导细胞状态。
主要观察指标:两种来源间充质干细胞形态,增殖情况及诱导分化能力。