1.1 设计 静电纺丝膜的制备与表征,体外细胞实验,动物实验。
1.2 时间及地点 实验于 2024年6-10 月在苏州大学骨研所力学材料实验室完成。
1.3 材料
1.3.1 主要材料、试剂与仪器
材料: 聚醚碳酸酯脲(上海源叶生物科技股份有限公司);纳米羟基磷灰石(上海源叶生物科技股份有限公司)。
试剂:胎牛血清、胰蛋白酶、青霉素+链霉素(Gibco,美国);DAPI(Beyotime,中国);细胞毒性检测试剂盒(Beyotime,中国);鬼笔环肽染色试剂盒、茜素红染液(源叶,中国);CCK-8工作液(新赛美,中国);BCIP-NBT碱性磷酸酶显色液、碱性磷酸酶检测试剂盒(上海碧云天生物技术股份有限公司,中国);氯代十六烷基吡啶溶液(麦克林试剂,中国);六氟异丙醇(上海阿拉丁试剂有限公司);戊巴比妥钠(上海隆盛化工有限公司);成骨诱导培养基、α-MEM培养基(上海源培生物科技股份有限公司);苏木精-伊红、中性树脂(美国 Sigama Aldrich 公司);多聚甲醛(中国碧云天公司);脱钙液(中国索莱宝公司);Msson染色试剂盒(中国源叶公司);碘伏消毒液(中国索莱宝公司)。
仪器:扫描电子显微镜(FESEM,美国);EVOS倒置荧光显微镜(AMG,美国);水接触角测量仪(Data Physsics,美国);静电纺丝机(高压直流电源来源于天津东文高压电源厂,微量注射泵来源于保定精工泵业有限公司);Micro-CT(德国布鲁克公司);Zeiss Axiovert 40CFL显微镜(Zeiss,Oberkochen,德国);酶标仪(Molecular Devices,美国);高压灭菌锅(中国八金有限公司);高压汞灯电源(上海季光特种照明电器厂);细胞培养箱(美国THERMO公司);4 ℃冰箱(日本松下);-80 ℃超低温冰箱(日本SANYO);电子天平(北京赛多丽斯);等离子体原子发射光谱仪(美国Varian公司)。
1.3.2 实验动物 健康雄性SD大鼠30只,6-8周龄,体质量(200±50) g,SPF级,购自苏州大学实验动物中心,许可证号:SYXK(苏)2021-0065。喂养在 25 ℃和50%湿度的清洁通风环境中。实验方案已通过青海省人民医院伦理委员会批准[伦理号:科研伦审(2023)-262]。
1.4 实验方法
1.4.1 大鼠骨髓间充质干细胞的提取 参考文献[9]中的方法分离提取大鼠骨髓间充质干细胞。取8周龄雄性SD大鼠3只,腹腔注射过量戊巴比妥麻醉后处死,剔除后肢腿部毛发,取出完整的股骨,剔除周围肌肉,使用无菌剪刀剪开股骨近端和远端骨质髓腔,用注射器冲洗股骨髓腔,每个股骨冲洗3遍,将骨髓液最后转入37 ℃、体积分数5% CO2培养箱中培养。首次3 d后换液,之后每 2 d换一次液。后续实验使用第2代细胞。
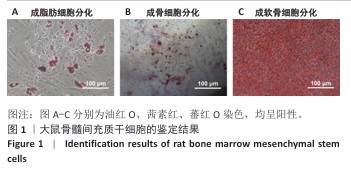
选取生长状况优良的第2代大鼠骨髓间充质干细胞,以3×105/孔的密度接种于12孔板,当细胞长满约60%时将培养基替换为专门的三系分化诱导液,分别进行茜素红、油红O和蕃红O染色,检测细胞的多向分化潜能。
1.4.2 静电纺丝液的配制
静电纺丝液的制备:称取0.450 g聚醚碳酸酯脲置于玻璃瓶中,加入2 mL六氟异丙醇磁力搅拌12 h,得到聚醚碳酸酯脲静电纺丝液;称取0.09 g纳米羟基磷灰石加入聚醚碳酸酯脲静电纺丝液中,磁力搅拌12 h,得到纳米羟基磷灰石-聚醚碳酸酯脲静电纺丝液。
静电纺丝膜的制备:取聚醚碳酸酯脲静电纺丝液、纳米羟基磷灰石-聚醚碳酸酯脲静电纺丝液,分别进行纺丝,连接好电源和接收滚轴,调整纺丝参数至适宜范围后启动纺丝机进行纺丝操作:使用5 mL注射器吸入2 mL静电纺丝液, 接上粗细大小为18 G的针头,电压12 kV,溶液流速1 mL/h,转轴与注射器针头之间的距离为15 cm,将铝箔固定在转轴上,转轴速率1 200 r/min。纺制结束之后,将收集到的静电纺丝膜放入真空干燥箱内室温真空干燥7 d,分别得到聚醚碳酸酯脲静电纺丝膜与纳米羟基磷灰石-聚醚碳酸酯脲静电纺丝膜,置于干燥器内储存备用。
支架的构建:将静电纺丝膜切成矩形条(长 8 cm,宽 1 cm),将上下2条膜进行斜交层叠,用5 mm消毒的打孔器制备成5 mm×1 mm的圆形支架,紫外照射灭菌。将2×104 个大鼠骨髓间充质干细胞分别接种于两种支架表面,待细胞贴壁后用于动物实验。
1.4.3 静电纺丝膜的性能检测
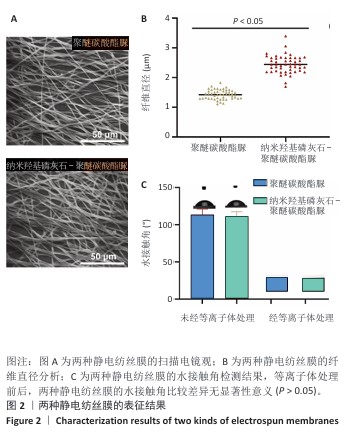
扫描电镜观察:将两种静电纺丝膜风干、去除表面水分,裁成小圆片,放置在载物台,用导电胶黏附表面进行喷金处理,利用扫描电镜观察表面形态。采集图像后,用Image J软件测量纤维直径(n=50)。
水接触角检测:将0.25 μL去离子水分别滴在两种静电纺丝膜表面,2 s后拍摄水滴与支架之间的角度照片,使用接触角测试仪检测水接触角;对两种静电纺丝膜进行等离子体处理1 min,将0.25 μL去离子水分别滴在两种静电纺丝膜表面,2 s后拍摄水滴与支架之间的角度照片,使用接触角测试仪检测水接触角。
1.4.4 静电纺丝膜的生物相容性检测
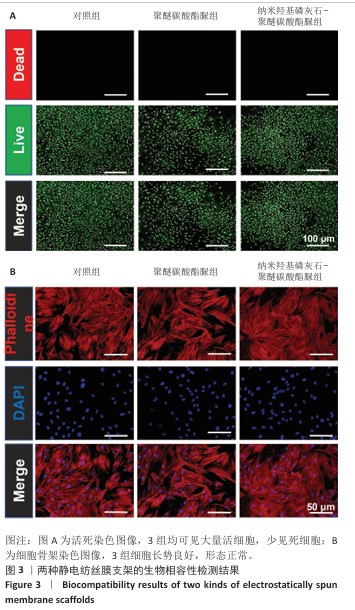
活死染色:将大鼠骨髓间充质干细胞接种于24孔板内,细胞密度为2×104 /孔,置于37 ℃、体积分数5% CO2培养箱中培养。观察细胞贴壁后分3组处理:对照组不加入任何材料,聚醚碳酸酯脲组和纳米羟基磷灰石-聚醚碳酸酯脲组分别加入对应的静电纺丝膜共培养。培养5 d后用PBS清洗,进行活死染色,置于37 ℃下孵育30 min,用PBS轻轻冲洗以去除未结合的染料,置于荧光显微镜下观察。
骨架染色:将大鼠骨髓间充质干细胞接种于24孔板内,细胞密度为2×104 /孔,置于37 ℃、体积分数5% CO2培养箱中培养。观察细胞贴壁后分3组处理:对照组不加入任何材料,聚醚碳酸酯脲组和纳米羟基磷灰石-聚醚碳酸酯脲组分别加入对应的静电纺丝膜共培养。培养 3 d后用PBS清洗3次,40 g/L多聚甲醛固定45 min,吸去多聚甲醛后用PBS清洗;根据鬼笔环肽染色试剂盒说明书进行染色,置于37 ℃
孵育1 h,用PBS轻轻冲洗以去除未结合的染料,用DAPI染细胞核,置于荧光显微镜下观察。
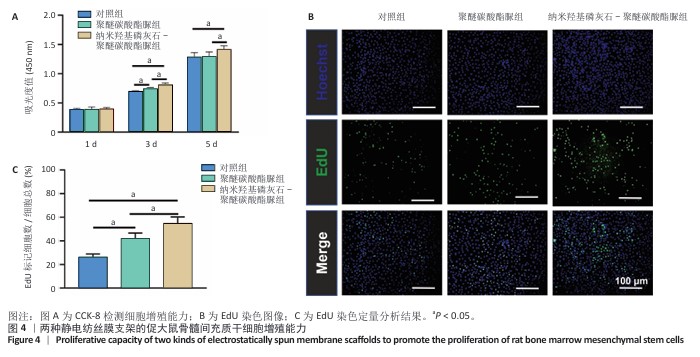
CCK-8检测:将大鼠骨髓间充质干细胞分别接种于96孔板内,细胞密度为7×103/孔,置于37 ℃、体积分数5% CO2培养箱中培养。观察细胞贴壁后分3组处理:对照组不加入任何材料,聚醚碳酸酯脲组和纳米羟基磷灰石-聚醚碳酸酯脲组分别加入对应的静电纺丝膜共培养。培养第1,3,5天,吸弃原培养基,每孔加入100 μL含CCK-8的培养基(CCK-8∶培养基=1∶10),轻轻摇匀后放回培养箱中继续培养2 h,使用酶标仪在450 nm波长处测定吸光度值。
EdU染色:将大鼠骨髓间充质干细胞接种于24孔板内,细胞密度为2×104 /孔,置于37 ℃、体积分数5% CO2培养箱中培养。观察细胞贴壁后分3组处理:对照组不加入任何材料,聚醚碳酸酯脲组和纳米羟基磷灰石-聚醚碳酸酯脲组分别加入对应的静电纺丝膜共培养。培养7 d后,按照EdU染色试剂盒使用说明书进行EdU染色,置于倒置显微镜下观察细胞增殖情况。采集图像后,使用Image J软件统计EdU标记阳性细胞数增殖比例。
1.4.5 静电纺丝膜支架体外促成骨性能检测
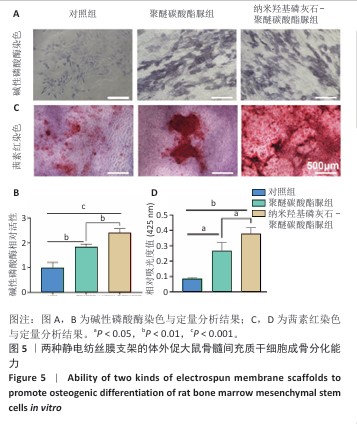
碱性磷酸酶染色:将大鼠骨髓间充质干细胞分别接种于6孔板内,细胞密度为1×105/孔,置于37 ℃、体积分数5% CO2培养箱中培养。观察细胞贴壁后更换为成骨诱导培养基,分3组处理:对照组不加入任何材料,聚醚碳酸酯脲组和纳米羟基磷灰石-聚醚碳酸酯脲组分别加入对应的静电纺丝膜共培养,隔天换液1次。成骨诱导培养7 d后,用PBS轻轻冲洗3次,每次5 min;加入40 g/L多聚甲醛于37 ℃固定15 min,用PBS冲洗3次,每次5 min;按照碱性磷酸酶染色试剂盒说明书配制碱性磷酸酶染色工作液,将支架浸入工作液中于37 ℃孵育1.0-2.0 h,用蒸馏水冲洗3次,每次5 min,置于光学显微镜观察并拍照。拍照完成后,在样品中加入BCIP-NBT 碱性磷酸酶显色液于37 ℃孵育1 h,加入终止液(如NaOH)停止反应,在405 nm波长处测定吸光度值,计算碱性磷酸酶活性。
茜素红染色:将大鼠骨髓间充质干细胞分别接种于6孔板内,细胞密度为1×105/孔,置于37 ℃、体积分数5% CO2培养箱中培养。观察细胞贴壁后更换为成骨诱导培养基,分3组处理:对照组不加入任何材料,聚醚碳酸酯脲组和纳米羟基磷灰石-聚醚碳酸酯脲组分别加入对应的静电纺丝膜共培养,隔天换液1次。成骨诱导培养21 d后,用PBS轻轻冲洗3次,每次5 min,加入40 g/L多聚甲醛固定液于37 ℃固定15 min,用PBS冲洗3次,每次5 min;浸入0.1%茜素红S溶液中室温下染色15-30 min,用蒸馏水冲洗3次,每次5 min,置于光学显微镜察并拍照记录。拍照完毕后将孔内液体吸干,每孔加入1 mL 10%氯代十六烷基吡啶溶液于室温下孵育15 min,每孔吸取150 μL溶液至96孔板,利用酶标仪在425 nm波长处测定吸光度值,评估细胞的矿化能力。
1.4.6 静电纺丝膜支架的体内成骨性能检测
颅骨缺损模型的建立:采用随机数字表法将27只 SD 大鼠随机分为对照组(n=9)、聚醚碳酸酯脲组(n=9)、纳米羟基磷灰石-聚醚碳酸酯脲组(n=9)。腹腔注射戊巴比妥麻醉大鼠,术区备皮、消毒及铺洞巾,切开皮肤、皮下,分离骨膜,充分暴露大鼠颅骨,使用电钻制备一个直径为5 mm 的颅骨全层缺损,术中保持脑膜完整性,防止破裂,对照组不植入任何材料,聚醚碳酸酯脲组、纳米羟基磷灰石-聚醚碳酸酯脲组分别植入聚醚碳酸酯脲-大鼠骨髓间充质干细胞支架、纳米羟基磷灰石-聚醚碳酸酯脲-大鼠骨髓间充质干细胞支架,逐层间断缝合骨膜、皮下组织、皮肤,无菌敷料包扎。
取材:术后8周,过量吸入二氧化碳后处死所有大鼠,利用手术刀片将颅骨皮肤切开,找到颅骨缺损的部位,完整取出颅骨,置于甲醛溶液中固定24 h。
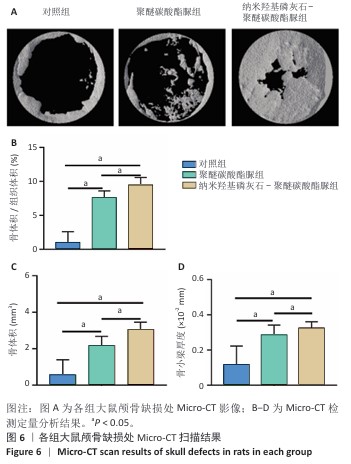
Micro-CT分析:取出固定后的颅骨标本,使用高分辨率Micro-CT进行扫描,使用Skyscan软件对扫描数据进行重建,通过CTAn、NRecon 软件分析骨体积、骨体积/组织体积与骨小梁厚度。
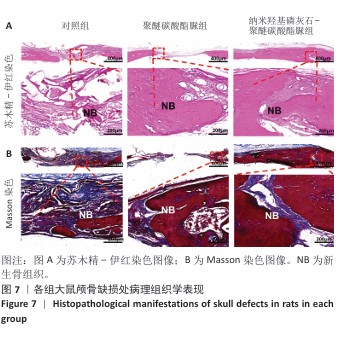
颅骨标本的病理组织学观察:将固定后的颅骨标本用PBS冲洗,放进装有脱钙液的离心管内,置于振动摇床上进行脱钙,每3 d更换一次脱钙液,待脱钙完全后进行脱水处理,放进包埋盒内依次经过不同浓度乙醇进行梯度脱水,二甲苯透明处理后包埋,利用石蜡切片机进行切片(切片厚度为6 μm),利用黏附载玻片捞取样本,进行烤片处理,分别进行苏木精-伊红染色与Masson染色。①苏木精-伊红染色:把石蜡切片放进烘箱将石蜡融化,温度60 ℃、时间 1 h,将融化的切片在二甲苯里浸泡30 min脱蜡;经梯度乙醇水化,苏木精染色5 min后水洗2遍,盐酸乙醇溶液分化10 s后水洗2遍,用PBS 洗30 s;伊红染色3 min后水洗 3 遍(每遍 10 s),梯度乙醇脱水处理后二甲苯透明处理5 min。②Masson染色:将石蜡切片脱蜡至水,用苏木精染色液染色5 min;用酸性乙醇分化液分化10 s,水洗3遍,使用 Masson蓝化液染色5 min,去离子水洗1 min;使用丽春红品红染色液染色8 min,用弱酸工作液清洗1 min,磷钼酸溶液清洗 2 min,直接放入苯胺蓝染色液中染色2 min,用弱酸工作液洗1 min,中性树胶封固。
1.5 主要观察指标 两种静电纺丝膜的微观形态、水接触角与体外生物相容性、促成骨分化能力,以及动物体内促成骨分化能力。
1.6 统计学分析 采用GraphPad Prism 8.0软件进行统计分析,各项数据以x±s表示。多组间比较采用单因素方差分析,两组间比较采用t检验。P < 0.05为差异有显著性意义。该文统计学方法已经苏州大学附属第一医院生物统计学专家审核。