1.1 设计 体外细胞分组对照观察实验。
1.2 时间及地点 实验于2019年3月至2020年1月在昆明市延安医院中心实验室完成。
1.3 材料
1.3.1 实验动物 云南小耳猪6只购买于昆明医科大学实验动物学部,雄性,猪龄2-4个月,体质量20-30 kg,检查无异常,毛色光亮,无脱毛,身体无炎性疾病,无传染性疾病,体内外无寄生虫。
1.3.2 实验试剂 胎牛血清、含双抗的RPMI1640培养基(上海信裕生物科技有限公司);Lipofectamine 2000(规格:
1.5 mL,货号:11668-019)转染试剂(上海翊圣生物科技有限公司);JNK特异性激活剂Anisomycin(规格:10 mg,货号:HY-18982)和JNK特异性抑制剂SP600125(规格:10 mg,货号:HY-12041)(MedChemExpress公司);ELISA试剂盒及SIAH1抗体(北京义翘神州科技有限公司);Hoechst 33258(规格:100 mg,货号:A3466)(美国APExBIO公司);一步法反转录试剂盒(北京百奥莱博科技有限公司);RIPA裂解液、Trizol试剂盒(Thermo Fisher公司);双荧光素酶报告基因试剂盒(江苏科特生物技术有限公司)。
1.4 实验方法
1.4.1 猪胰岛细胞和骨髓间充质干细胞分离、培养及转染 根据以前报道的方法分离和培养猪胰岛细胞[8]、猪骨髓间充质干细胞[9]。取处于对数生长期的猪胰岛细胞,接种于6孔板,置于37 ℃、体积分数为5%CO2培养箱中培养,待细胞汇合度到70%-80%时按Lipofectamine 2000转染试剂说明书将miR-299-5p mimics/inhibitor、NC-mimics及si-SIAH1转染至猪胰岛细胞,并于37 ℃、体积分数为5%CO2培养箱中继续培养48 h待用。
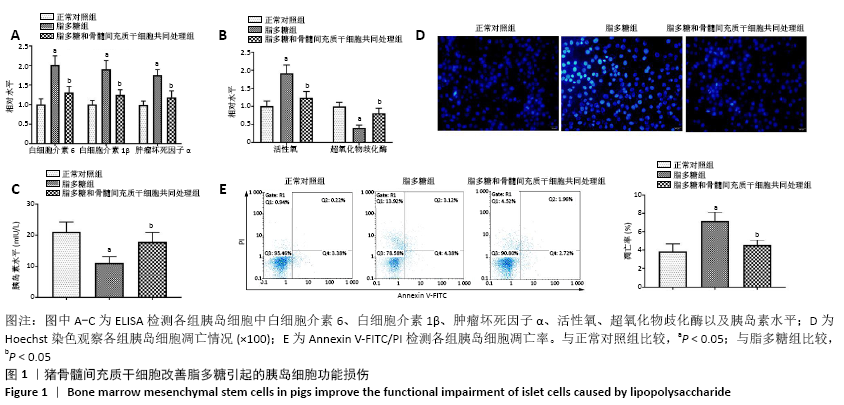
猪骨髓间充质干细胞改善脂多糖引起的胰岛细胞功能损伤实验分组:①正常对照组:猪胰岛细胞正常培养;②脂多糖处理组:猪胰岛细胞用10 mg/L脂多糖处理12 h;③脂多糖和猪骨髓间充质干细胞共同处理组:猪骨髓间充质干细胞与脂多糖处理12 h后的胰岛细胞共培养24 h。各组细胞分别进行ELISA检测、Hoechst 33258染色、Annexin V-FITC/PI检测。
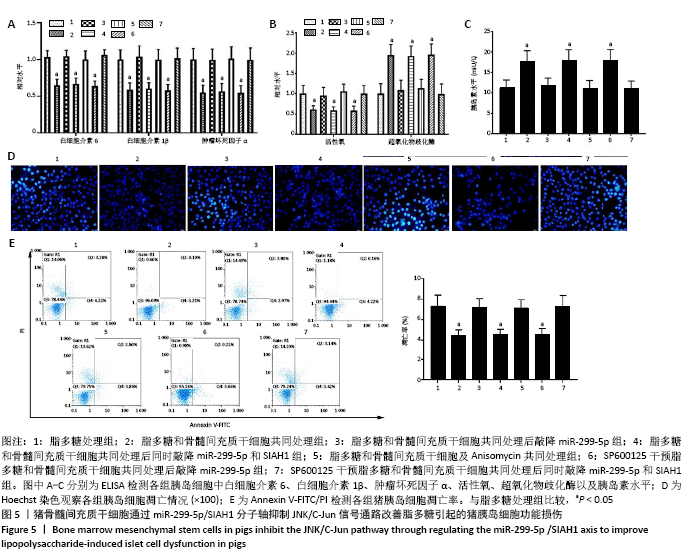
猪骨髓间充质干细胞通过miR-299-5p/SIAH1分子轴抑制JNK/C-Jun信号通路改善脂多糖引起的猪胰岛细胞功能损伤实验分组:①脂多糖处理组;②脂多糖和骨髓间充质干细胞共同处理组;③脂多糖和骨髓间充质干细胞共同处理后敲降miR-299-5p组;④脂多糖和骨髓间充质干细胞共同处理后同时敲降miR-299-5p和SIAH1组;⑤脂多糖和骨髓间充质干细胞及Anisomycin共同处理组;⑥SP600125干预脂多糖和骨髓间充质干细胞共同处理后敲降miR-299-5p组;⑦SP600125干预脂多糖和骨髓间充质干细胞共同处理后同时敲降miR-299-5p和SIAH1组。各组细胞分别进行ELISA检测、Hoechst 33258染色、Annexin V-FITC/PI检测。
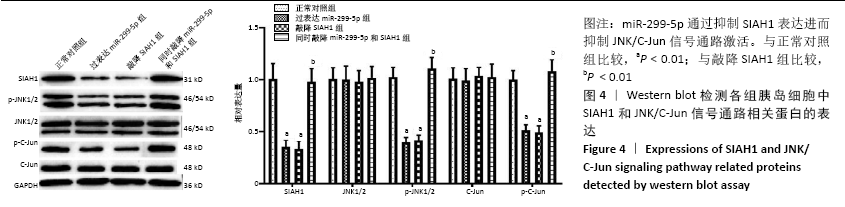
miR-299-5p抑制SIAH1表达进而抑制JNK/C-Jun信号通路激活实验分组:①正常对照组;②过表达miR-299-5p组;③敲降SIAH1组;④同时敲降miR-299-5p和SIAH1组。Western blot检测各组胰岛细胞中SIAH1和JNK/C-Jun信号通路相关蛋白的表达。
1.4.2 脂多糖诱导猪胰岛细胞功能损伤 取处于对数生长期的猪胰岛细胞,根据文献[10]用10 mg/L脂多糖处理12 h,模拟移植胰岛细胞所处的炎症和氧化应激环境,诱导猪胰岛细胞功能损伤。
1.4.3 骨髓间充质干细胞和猪胰岛细胞Transwell共培养 分别取第3代骨髓间充质干细胞与用脂多糖处理12 h后的猪胰岛细胞,将骨髓间充质干细胞按1×106密度接种于Transwell共培养系统的上室,在37 ℃、体积分数为5%CO2培养箱中培养过夜,再将猪胰岛细胞按1×106密度接种于Transwell共培养系统的下室,加入含体积分数为5%胎牛血清的DMEM/F12培养基1 mL,让上下室的培养液相互通融,从而建立起骨髓间充质干细胞与猪胰岛细胞的共培养体系,在37 ℃、体积分数为5%CO2培养箱中共培养24 h后检测猪胰岛细胞相关指标。
1.4.4 JNK特异性激活剂Anisomycin和JNK特异性抑制剂SP600125分别激活和抑制JNK信号通路 取脂多糖单独处理或者脂多糖和猪骨髓间充质干细胞共同处理后的胰岛细胞,过表达miR-299-5p、敲降SIAH1或同时敲降miR-299-5p和SIAH1,然后分别加入0.4 mg/L Anisomycin[11]和50 mmol/L SP600125[12],继续培养12 h后检测各项指标。
1.4.5 ELISA检测猪胰岛细胞中白细胞介素6、白细胞介素1β、肿瘤坏死因子α、活性氧、超氧化物歧化酶及胰岛素水平 收集各组待测猪胰岛细胞并制备成细胞悬液,根据相应的ELISA试剂盒说明检测猪胰岛细胞中白细胞介素6、白细胞介素1β、肿瘤坏死因子α、活性氧、超氧化物歧化酶及胰岛素水平。
1.4.6 Hoechst 33258染色检测猪胰岛细胞凋亡情况 收集各组猪胰岛细胞,在室温下用40 g/L多聚甲醛固定30 min,PBS冲洗3次,然后在室温下用Hoechst 33258(10 mg/L)避光染色5 min,PBS冲洗细胞3次,使用Eclipse TS100荧光显微镜观察各组猪胰岛细胞的核形态变化,明亮的蓝色核染表明核固缩。
1.4.7 Annexin V-FITC/PI检测猪胰岛细胞凋亡率 收集各组猪胰岛细胞,用0.25%胰酶消化后,1 000 r/min离心5 min,收集细胞,用500 μL Buffer液重悬细胞后加入5 μL Annexin V-FITC,充分混匀后室温避光孵育15 min,再加入5 μL PI染色液,混匀后室温避光孵育5 min,使用流式细胞仪检测猪胰岛细胞凋亡水平。
1.4.8 Western blot检测猪胰岛细胞中SIAH1和JNK/C-Jun信号通路相关蛋白的表达水平 收集各组猪胰岛细胞,PBS洗涤2次,加入RIPA裂解液,37 ℃水浴30 min,12 000 r/min离心10 min,取上清,使用BCA法测蛋白浓度。按50 μg蛋白量对应体积加入SDS-PAGE凝胶加样孔中,用电转移法将蛋白转移至PVDF膜上,5%脱脂奶粉封闭2 h后加入一抗(1∶1 000)4 ℃孵育过夜;次日,TBST洗涤3次,加入HRP标记的二抗(均1∶5 000),室温孵育2 h;TBST洗涤3次后加入ECL化学发光液进行显影,然后在凝胶成像仪上拍照,采用Image J灰度分析软件分析灰度值,计算相对表达量。
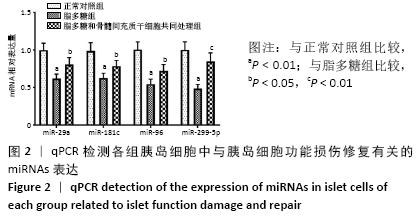
1.4.9 RT-qPCR检测猪胰岛细胞中与胰岛细胞功能损伤修复有关的miRNAs表达水平 通过查询文献,发现miR-29a、
miR-181c、miR-96、miR-299-5p均为促进胰岛细胞功能损伤修复的miRNAs,因此使用qPCR检测各组细胞中这些miRNAs
的表达水平。收集各组猪胰岛细胞,使用Trizol Reagent分别提取各细胞中总RNA,用一步法反转录试剂盒将全部RNA反转录成cDNA,以U6为内参,进行PCR扩增,扩增程序为:95 ℃预变性10 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸15 s,共50个循环,引物序列见表1,结果采用2-ΔΔCt表示。

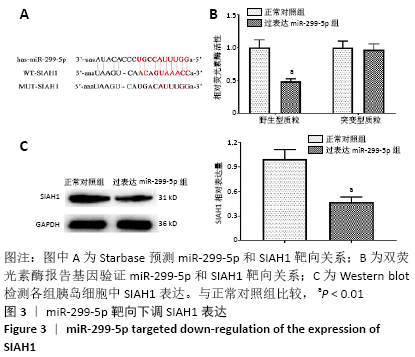
1.4.10 双荧光素酶报告基因验证miR-299-5p和SIAH1的靶向关系 StarBase数据库预测miR-299-5p和SIAH1的结合位点,并导入pmirGLO luciferase载体中,获得SIAH1野生型载体(WT);应用基因突变技术改变miR-299-5p和SIAH1的结合位点,用同样的方法构建SIAH1突变型载体(MUT)。将WT、MUT分别和miR-299-5p mimics或miR-NC转染到猪胰岛细胞内,培养48 h后用双荧光素酶报告基因试剂盒检测各组荧光素酶活性。
1.5 主要观察指标 ①各组猪胰岛细胞中白细胞介素6、白细胞介素1β、肿瘤坏死因子α、活性氧、超氧化物歧化酶、胰岛素水平;②各组猪胰岛细胞凋亡率;③各组猪胰岛细胞中miR-299-5p、SIAH1的表达以及JNK/C-Jun信号通路相关蛋白的表达。
1.6 统计学分析 实验均重复3次,数据以x±s表示。采用GraphPad Prism 7进行数据分析和相关图片绘制,两组间比较采用t检验,多组间比较采用单因素方差分析,P < 0.05为差异有显著性意义。