中国组织工程研究 ›› 2024, Vol. 28 ›› Issue (35): 5612-5617.doi: 10.12307/2024.821
• 组织构建实验造模 experimental modeling in tissue construction • 上一篇 下一篇
尼古丁对鱼藤酮诱导帕金森病小鼠模型的神经保护作用机制
张歆悦1,2,祝柳慧1,何 雨3,管 莹2,朱洲海2,任 惠1,杨兴隆1,2
- 1昆明医科大学第一附属医院老年神经内科,云南省昆明市 650032;2烟草与健康联合研究院,云南省昆明市 650231;3昆明医科大学第一临床学院,云南省昆明市 650500
Neuroprotective mechanism of nicotine in a mouse model of rotenone-induced Parkinson’s disease
Zhang Xinyue1, 2, Zhu Liuhui1, He Yu3, Guan Ying2, Zhu Zhouhai2, Ren Hui1, Yang Xinglong1, 2
- 1Department of Geriatric Neurology, The First Affiliated Hospital of Kunming Medical University, Kunming 650032, Yunnan Province, China; 2Joint Research Institute of Tobacco and Health, Kunming 650231, Yunnan Province, China; 3The First Clinical College of Kunming Medical University, Kunming 650500, Yunnan Province, China
摘要:
文题释义:
尼古丁:是烟草的主要成分之一,具有良好的血脑屏障通过性,半衰期短,可以作为药物制剂缓解帕金森病的运动症状和非运动症状。尼古丁可以通过激动黑质纹状体中的烟碱型乙酰胆碱受体途径和非烟碱型乙酰胆碱受体途径对多巴胺能神经元产生保护作用。帕金森病:是一种常见的神经退行性疾病,特点是中脑多巴胺能神经元变性,病理特征是α-突触核蛋白的异常沉积和路易小体病变,临床表现主要是静止性震颤、肌肉强直、步态异常、运动迟缓等。
背景:研究发现尼古丁可以激活脑部的多巴胺系统,减缓帕金森病的发展,但具体机制尚不明确,目前缺乏对帕金森病动物模型神经保护作用的机制研究。
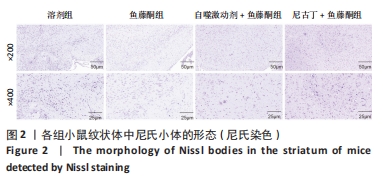
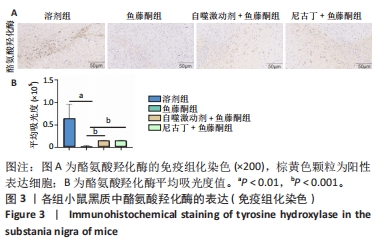
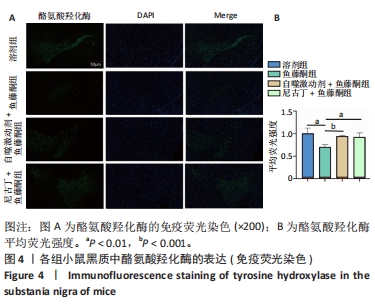
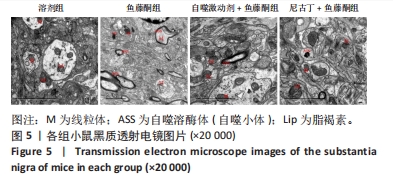
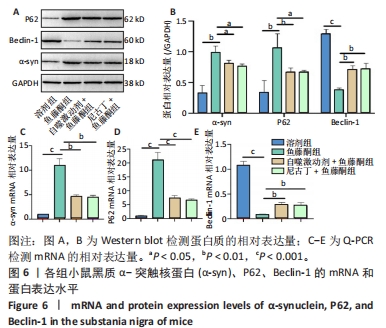
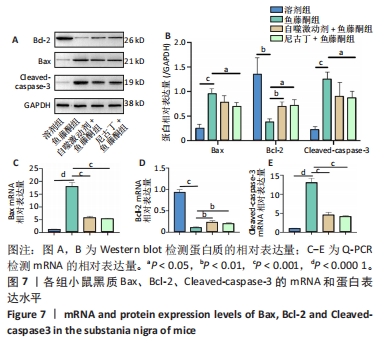
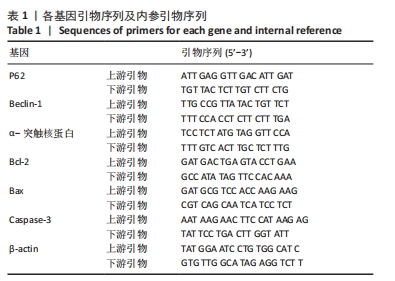
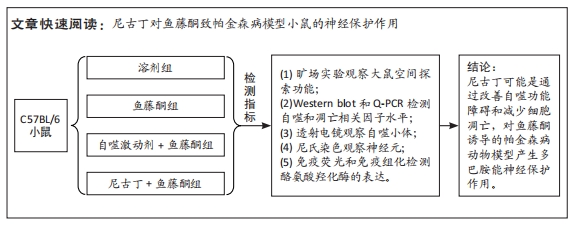
目的:探讨尼古丁对鱼藤酮诱导帕金森病小鼠的神经保护作用机制。方法:将28只C57BL/6小鼠随机分为溶剂组、鱼藤酮组、自噬激动剂+鱼藤酮组和尼古丁+鱼藤酮组,每组7只,利用鱼藤酮诱导C57BL/6小鼠多巴胺能神经损害,在造模前给予自噬激动剂(雷帕霉素)或尼古丁,干预结束后进行旷场实验观察小鼠空间探索功能;采用Western blot和Q-PCR检测黑质中α-突触核蛋白的表达,自噬相关因子Beclin-1、P62的表达以及凋亡相关因子Bax、Bcl-2和Cleaved-caspase-3的表达;透射电镜观察黑质中线粒体、自噬小体和脂褐素沉积情况;尼氏染色观察神经元的存活情况;免疫荧光和免疫组化染色观察黑质中酪氨酸羟化酶的表达。
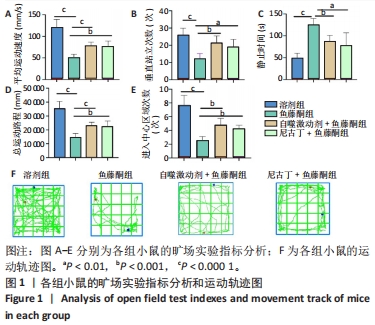
结果与结论:①旷场实验显示,与溶剂组相比,鱼藤酮组小鼠表现出运动距离、平均速度和运动时间均减少;与鱼藤酮组相比,尼古丁+鱼藤酮组和自噬激动剂+鱼藤酮组小鼠运动距离、平均速度和运动时间均增加(P < 0.05)。②免疫荧光和免疫组化结果显示,与溶剂组相比,鱼藤酮组酪氨酸羟化酶平均荧光强度和平均吸光度值减小;与鱼藤酮组相比,尼古丁+鱼藤酮组和自噬激动剂+鱼藤酮组酪氨酸羟化酶平均荧光强度和平均吸光度值增加。③Western blot和Q-PCR结果显示,与溶剂组相比,鱼藤酮组α-突触核蛋白、P62表达升高,Beclin-1表达减少(P < 0.05);与鱼藤酮组相比,尼古丁+鱼藤酮组和自噬激动剂+鱼藤酮组α-突触核蛋白、P62表达减少,Beclin-1表达增多(P < 0.05)。与溶剂组相比,鱼藤酮组Bax、Cleaved-caspase-3表达增多,Bcl-2表达减少(P < 0.05);与鱼藤酮组相比,尼古丁+鱼藤酮组和自噬激动剂+鱼藤酮组Bax、Cleaved-caspase-3表达减少,Bcl-2 表达增多(P < 0.05)。结果提示,尼古丁可能是通过改善自噬功能障碍和减少细胞凋亡,对鱼藤酮诱导的帕金森病小鼠模型产生多巴胺能神经保护作用。
https://orcid.org/0000-0001-5801-5211(杨兴隆)
中国组织工程研究杂志出版内容重点:组织构建;骨细胞;软骨细胞;细胞培养;成纤维细胞;血管内皮细胞;骨质疏松;组织工程
中图分类号: