设计:随机对照动物实验。
时间及地点:实验于2011年12月至2012年12月在安徽医科大学第二附属医院动物实验中心、血液病实验室完成。
材料:(12±1)个月龄健康SD雄性大鼠90只,体质量(250±20) g,由安徽医科大学第二附属医院动物实验中心提供。
实验方法:
大鼠心肌梗死模型的制作:将90只远交群SD大鼠采用结扎冠状动脉前降支的方法建立大鼠心肌梗死模型。
大鼠称质量后,气管插管,连接心电图,呼吸机正压辅助呼吸(潮气量12-15 mL,吸呼比2∶1,频率70次/min)。采用体积分数1%水合氯醛(3 mL/kg)腹腔注射,麻醉成功后,剪毛并消毒局部皮肤。沿左侧胸骨旁线剪开约1.5 cm皮肤切口,依次钝性分离胸部肌肉,暴露3-5肋,并向两边扩开,打开胸腔、心包,暴露左心耳,于左心耳下方约2 mm处用7号带线缝针进行结扎(左冠状动脉前降支),并描记即刻心电图,出现ST段抬高和局部组织颜色变白作为确定心肌梗死模型复制成功的标志。关腹并进行术后心电图描记,术后腹腔内注射青毒素40×104 U/d,预防感染,造模后大鼠单只单笼饲养1-4周。
实验分组:大鼠建立急性心肌梗死模型后随机分为低氧诱导因子1α反义寡核苷酸组、低氧诱导因子1α错义寡核苷酸组和对照组3组,每组30只。3组实验鼠月龄、饮食结构、体质量经统计学处理差异无显著性意义(P > 0.05),具有可比性。
全硫代修饰低氧诱导因子1α反义和错义寡核苷酸的给用方法:全硫代修饰的低氧诱导因子1α反义寡核苷酸序列为CCT CCA TGG CGA ATC GGT GC,全硫代修饰低氧诱导因子1α错义寡核苷酸作为对照序列为ACT CGT ACC GCG GCA GTT CG。
寡核苷酸转染方法:脂质体10 μg加入200 μL无菌生理盐液中室温放置45 min溶解,再与99 μg的寡核苷酸混合,室温放置20 min后给大鼠心肌缺血部位用微量注射器分5点肌内注射(造模后立即给药)。术后再每2 d经尾静脉给 99 μg,连续3次。对照组给予等容生理盐水。
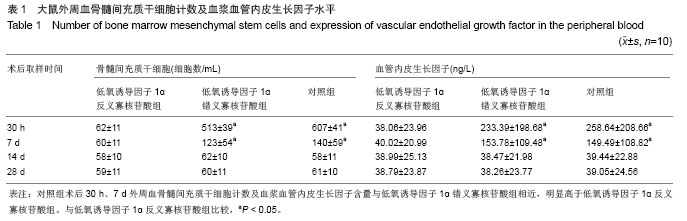
大鼠外周血骨髓间充质干细胞的分离、计数:手术后30 h,7 d,14 d,28 d每组随机取10只大鼠腹腔注射麻醉后,仰卧固定于小动物手术台上,胸部碘酒乙醇消毒后,用10 mL注射器针头紧贴剑突下,以角度25°-30°斜行向上进针刺入皮下,边进针边缓缓回抽针管,穿刺心腔内抽血 8 mL。采血后大鼠单笼观察。血样用肝素抗凝,轻轻混匀,立即送层流室进行细胞分离。取15 mL塑料离心管1只,加入大鼠淋巴细胞分离液LS-1083约4 mL,以血液/大鼠淋巴细胞分离液比为5∶3轻轻地加入血液于大鼠淋巴细胞分离液液面上盖好离心管盖,在水平离心机上以2 000 r/min,离心20 min;离心完毕后,离心管中液体分为3层,上层为血浆,中间白膜层为单个核细胞,下层为红细胞,小心将中间白膜层细胞用玻璃吸管吸入另一离心管中,尽量吸完。加入0.01 mol/L PBS 6 mL用吸管轻轻吹打混匀,再离心,离心条件为1 500 r/min,10 min;吸去上层液体,再加0.01 mol/L PBS与上述方法相同吹打、混匀、离心2次;在加最后一次PBS混匀后,在离心前吸少量用于细胞计数。在细胞计数板上,盖上盖玻片,滴入少量细胞混悬液,在倒置显微镜下计数16个小方格的细胞总数。细胞总数×104=细胞数/mL。将离心好的细胞上清吸去,根据细胞计数计算所需稀释的浓度决定需加M199培养基(含体积分数20%优质胎牛血清,青霉素100 U/mL,链霉素100 U/mL)的量;将单个核细胞按4×109 L-1铺在包被了0.5%明胶的24孔培养板上,每孔加1 mL。盖好培养板盖,放于37 ℃、体积分数5%CO2培养箱培养。培养4 d后,用0.01 mol/L PBS洗掉非贴壁细胞,换M199培养液继续培养至7 d。
大鼠外周血骨髓间充质干细胞鉴定:大鼠外周血骨髓间充质干细胞表型鉴定参考文献[3]的方法进行。
免疫细胞化学染色:取适量上述传代培养后收获的骨髓间充质干细胞分别进行如下操作:PBS洗涤细胞3次,制成细胞悬液,加到载玻片上,用体积分数95%的乙醇室温固定15 min,PBS洗涤细胞贴片3次,分别加入α2肌动蛋白、cTnT、CD31的单克隆抗体及Connexin43的多克隆抗体,4 ℃孵育过夜,进行免疫细胞化学染色、鉴定比较。
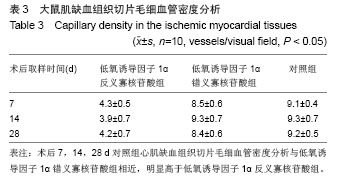
缺血组织切片及毛细血管密度分析:分别于术后7, 14 d每组随机选择10只大鼠处死,术后28 d处死每组剩余10只大鼠,均切取术侧心肌,用40 g/L多聚甲醛固定,置 4 ℃冰箱中保存24 h后,常规石蜡包埋,5 μm作肌肉横截面切片,苏木精-伊红染色,用普通光学显微镜高倍视野(×200)下,每张切片随机取5个不同视野,计数每个高倍视野内毛细血管数,取均值。用HMIAS-2000高清晰度彩色医学图像分析系统记录。
双抗体夹心酶联免疫分析技术检测血浆血管内皮生长因子:分析手术后30 h,7 d,14 d,28 d的动物外周血。标准品血管内皮生长因子等倍稀释,用稀释液设为空白对照。在已包被兔抗鼠血管内皮生长因子抗体的聚丙乙烯96孔酶标板中,分别各孔加入不同浓度的标准品和待检血浆100 μL,设双孔检测。加样后37 ℃孵育90 min,洗板4次,甩干。每孔加生物素化抗体工作液100 μL,空白孔不加。37 ℃孵育60 min,洗板4次,甩干。每孔加酶结合物工作液100 μL,空白孔不加。37 ℃孵育30 min,洗板4次,甩干。每孔加底物显色剂100 μL,37 ℃孵育15 min。每孔加入终止液100 μL,充分混匀后立即在酶标仪上检测A450值,测定波长为450 nm。以血管内皮生长因子标准品浓度为横坐标,吸光度值为纵坐标作图,根据坐标图各样品的吸光度值查出相应的血管内皮生长因子水平。
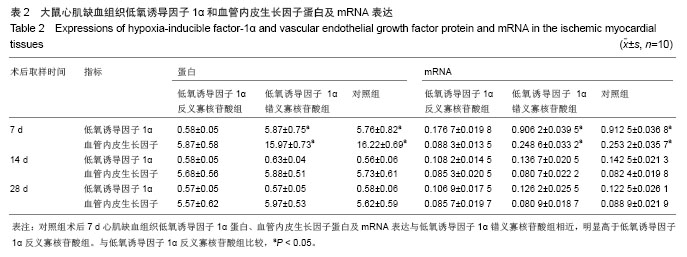
免疫组织化学法检测低氧诱导因子1α和血管内皮生长因子蛋白的表达:术后7,14,28 d的动物心肌组织标本石蜡切片常规脱蜡至水;体积分数3%双氧水室温10 min以灭活内源性酶,再蒸溜水洗3次。将组织切片浸入0.01 mol/L 枸橼酸盐缓冲液中,微波炉加热至沸腾后断电,间隔7 min后反复1次,冷却后用0.02 mol/L PBS洗涤2次。滴加5% BSA封闭液,室温20 min,甩去多余的液体,不洗;滴加 1∶100稀释的兔抗大鼠的一抗,阴性对照用0.01 mol/L PBS代替,湿盒内4 ℃过夜。滴加生物素化山羊抗兔IgG,室温20 min,0.02 mol/L PBS洗2 min,3次;滴加试剂SABC,室温20 min,0.02 mol/L PBS洗5 min,4次。取 1 mL蒸馏水于1.5 mL离心管中,加入试剂盒中A、B、C试剂各1滴,混匀后加至切片上,全部覆盖组织,室温显色,镜下控制显色时间,显色时间为3 min,蒸馏水洗涤。苏木精轻度复染,1%盐酸乙醇分化;乙醇梯度脱水、二甲苯透明。37 ℃烘干、中性树胶封固,显微镜下观察照片,image pro plus图像分析系统测积分吸光度(IA)进行定量分析。
荧光定量PCR方法检测血管内皮生长因子 mRNA 和低氧诱导因子1α mRNA:
引物设计:参考Genbank核苷酸序列资料,血管内皮生长因子正义链引物:5’-GCT CTC TTG GG T GCA CTG GA-3’,反义链引物:5’-CAC CGC CTT GGC TTG TCA CA-3’,635 bp;低氧诱导因子1α正义链引物:5’-AGT CAG CAA CGT GGA AGG- 3’,反义链引物:5’-GGG AGA AAA GCA AGT CGT G-3’,506 bp。
组织总RNA的提取:按TRIzol试剂说明书操作提取手术后7,14,28 d的动物心肌组织标本总RNA,并溶解于20 μL去RNA酶的灭菌双蒸水(DEPC处理ddH2O),经2%琼脂糖凝胶电泳检测RNA的完整性,并测定A260/A280比值应在1.8-2.0之间,确定样品纯度,其余放在冰箱中保存。
cDNA的合成:严格按照反转录试剂盒说明书进行操作。
产物分析:对PCR产物进行电泳和紫外分光光度计测定,推算PCR产量。
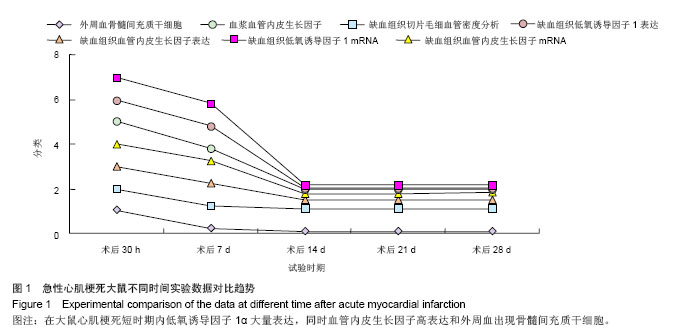
主要观察指标: ①大鼠外周血骨髓间充质干细胞计数及血浆血管内皮生长因子水平。②大鼠心肌缺血组织低氧诱导因子1α和血管内皮生长因子蛋白及mRNA表达。③大鼠肌缺血组织切片毛细血管密度分析。
统计学分析:采用SPSS 13.0统计学软件,将数据资料进行统计学描述分析,采取χ2检验,P < 0.05为差异有显著性意义。