中国组织工程研究 ›› 2019, Vol. 23 ›› Issue (11): 1700-1705.doi: 10.3969/j.issn.2095-4344.1106
• 组织构建实验造模 experimental modeling in tissue construction • 上一篇 下一篇
活血接骨汤拮抗环氧化酶2抑制剂干预桡骨骨折模型兔早期骨折愈合过程中骨钙素及骨形态生成蛋白2的表达
陈海涛,安玉光
- (南宁市邕宁区人民医院外科,广西壮族自治区南宁市 530299)
Effects of Huoxue Jiegu Decoction combined with cyclooxygenase-2 inhibitor on the expression of osteocalcin and bone morphogenetic protein 2 during early extremity fracture healing in rabbit models of radical fractures
Chen Haitao, An Yuguang
- (Department of Surgery, People’s Hospital of Yongning District of Nanning City, Nanning 530299, Guangxi Zhuang Autonomous Region, China)
摘要:
.jpg) 文题释义:
环氧化酶(Cyclooxygenase,COX):又称前列腺素内氧化酶还原酶,是一种双功能酶,具有环氧化酶和过氧化氢酶活性,是催化花生四烯酸转化为前列腺素的关键酶。目前发现环氧化酶有两种环氧化酶1和环氧化酶2同工酶,前者为结构型,主要存在于血管、胃、肾等组织中,参与血管舒缩、血小板聚集、胃黏膜血流、胃黏液分泌及肾功能等的调节,其功能与保护胃肠黏膜、调节血小板聚集、调节外周血管的阻力和调节肾血流量分布有关。后者为诱导型,各种损伤性化学、物理和生物因子激活磷脂酶A2水解细胞膜磷脂,生成花生四烯酸,后者经环氧化酶2催化加氧生成前列腺素。
骨钙素:属于γ-羧谷氨酸包含蛋白类,此蛋白类为维生素K依赖性。骨钙素中谷氨酸基的γ-羧基化后才具有生物学效应,而中羧基化必须有维生素K参与。又称骨γ-羧谷氨酸包含蛋白,该蛋白在骨矿化峰期之后才出现积聚。使用维生素K拮抗剂,可使此蛋白在骨中的含量减少,但并不影响其脯氨酸的含量,也不影响骨的机械强度。
文题释义:
环氧化酶(Cyclooxygenase,COX):又称前列腺素内氧化酶还原酶,是一种双功能酶,具有环氧化酶和过氧化氢酶活性,是催化花生四烯酸转化为前列腺素的关键酶。目前发现环氧化酶有两种环氧化酶1和环氧化酶2同工酶,前者为结构型,主要存在于血管、胃、肾等组织中,参与血管舒缩、血小板聚集、胃黏膜血流、胃黏液分泌及肾功能等的调节,其功能与保护胃肠黏膜、调节血小板聚集、调节外周血管的阻力和调节肾血流量分布有关。后者为诱导型,各种损伤性化学、物理和生物因子激活磷脂酶A2水解细胞膜磷脂,生成花生四烯酸,后者经环氧化酶2催化加氧生成前列腺素。
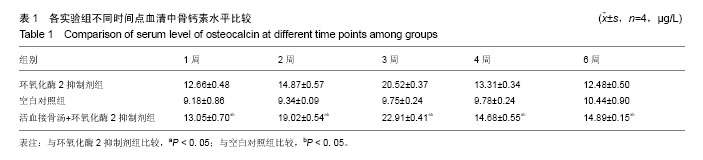
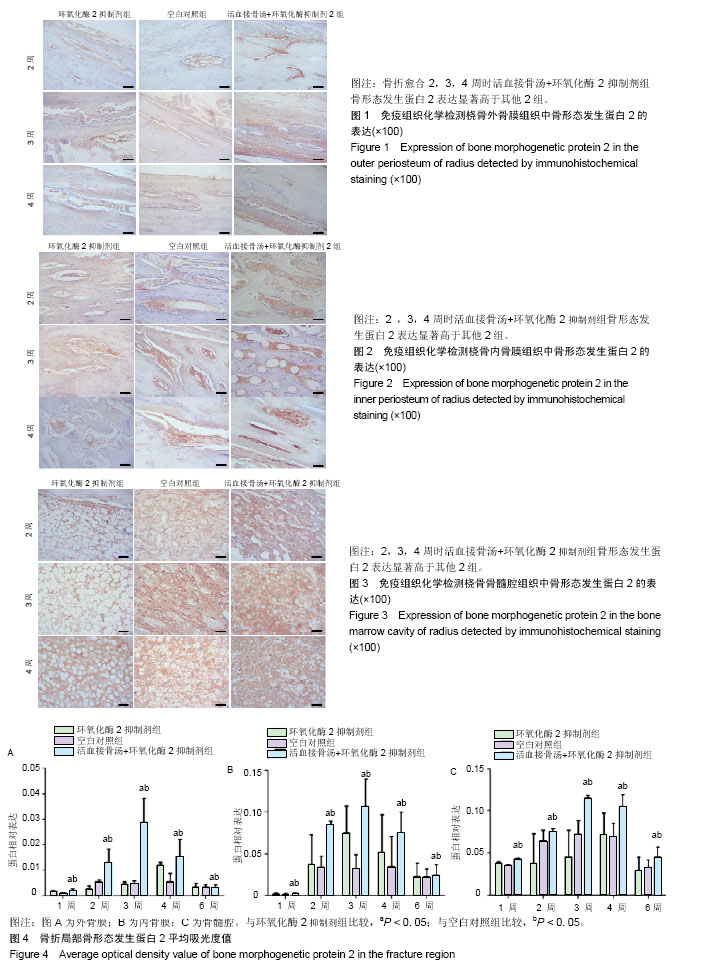
骨钙素:属于γ-羧谷氨酸包含蛋白类,此蛋白类为维生素K依赖性。骨钙素中谷氨酸基的γ-羧基化后才具有生物学效应,而中羧基化必须有维生素K参与。又称骨γ-羧谷氨酸包含蛋白,该蛋白在骨矿化峰期之后才出现积聚。使用维生素K拮抗剂,可使此蛋白在骨中的含量减少,但并不影响其脯氨酸的含量,也不影响骨的机械强度。摘要 背景:活血接骨汤已经被证实在治疗四肢骨折上有较好的临床效果,但中药复方对骨折早期镇痛疗效不如西药。 目的:分析中药活血接骨汤和环氧化酶2抑制剂结合对早期四肢骨折的愈合过程中骨钙素及骨形态生成蛋白水平的影响。 方法:60只新西兰大白兔,3-5月龄,体质量为(2.5±0.5)kg,由广西医科大学实验动物中心提供。建立兔桡骨骨折模型,造模成功后随机分为单纯环氧化酶2抑制剂组(环氧化酶2抑制剂组)、空白对照组、活血接骨汤拮抗环氧化酶2抑制剂组(活血接骨汤+环氧化酶2抑制剂组),于造模1,2,3,4,6周处死取材,采用酶联免疫吸附测定血清中骨钙素水平,并取材采用免疫组织化学法检测骨折愈合不同时间点外骨膜、内骨膜和骨髓腔骨形态发生蛋白2的表达,进行阳性细胞平均吸光度值分析。 结果与结论:①骨折2,3,4,6周时活血接骨汤+环氧化酶2抑制剂组骨钙素显著高于环氧化酶2抑制剂组、空白对照组( P < 0. 05);②2,3,4周时骨外膜、内骨膜及骨髓腔活血接骨汤+环氧化酶2抑制剂组骨形态发生蛋白2平均吸光度值均显著高于其他2组( P < 0.05);③结果说明,活血接骨汤拮抗环氧化酶2抑制剂对早期骨折愈合具有一定的促进作用,能够提高骨钙素及骨形态发生蛋白2的表达,其机制可能是与增加骨钙素的表达和促进成骨细胞活性骨形态发生蛋白2的表达有关。
中国组织工程研究杂志出版内容重点:组织构建;骨细胞;软骨细胞;细胞培养;成纤维细胞;血管内皮细胞;骨质疏松;组织工程 ORCID:0000-0002-2951-7359(陈海涛)
中图分类号:
.jpg) 文题释义:
环氧化酶(Cyclooxygenase,COX):又称前列腺素内氧化酶还原酶,是一种双功能酶,具有环氧化酶和过氧化氢酶活性,是催化花生四烯酸转化为前列腺素的关键酶。目前发现环氧化酶有两种环氧化酶1和环氧化酶2同工酶,前者为结构型,主要存在于血管、胃、肾等组织中,参与血管舒缩、血小板聚集、胃黏膜血流、胃黏液分泌及肾功能等的调节,其功能与保护胃肠黏膜、调节血小板聚集、调节外周血管的阻力和调节肾血流量分布有关。后者为诱导型,各种损伤性化学、物理和生物因子激活磷脂酶A2水解细胞膜磷脂,生成花生四烯酸,后者经环氧化酶2催化加氧生成前列腺素。
骨钙素:属于γ-羧谷氨酸包含蛋白类,此蛋白类为维生素K依赖性。骨钙素中谷氨酸基的γ-羧基化后才具有生物学效应,而中羧基化必须有维生素K参与。又称骨γ-羧谷氨酸包含蛋白,该蛋白在骨矿化峰期之后才出现积聚。使用维生素K拮抗剂,可使此蛋白在骨中的含量减少,但并不影响其脯氨酸的含量,也不影响骨的机械强度。
文题释义:
环氧化酶(Cyclooxygenase,COX):又称前列腺素内氧化酶还原酶,是一种双功能酶,具有环氧化酶和过氧化氢酶活性,是催化花生四烯酸转化为前列腺素的关键酶。目前发现环氧化酶有两种环氧化酶1和环氧化酶2同工酶,前者为结构型,主要存在于血管、胃、肾等组织中,参与血管舒缩、血小板聚集、胃黏膜血流、胃黏液分泌及肾功能等的调节,其功能与保护胃肠黏膜、调节血小板聚集、调节外周血管的阻力和调节肾血流量分布有关。后者为诱导型,各种损伤性化学、物理和生物因子激活磷脂酶A2水解细胞膜磷脂,生成花生四烯酸,后者经环氧化酶2催化加氧生成前列腺素。
骨钙素:属于γ-羧谷氨酸包含蛋白类,此蛋白类为维生素K依赖性。骨钙素中谷氨酸基的γ-羧基化后才具有生物学效应,而中羧基化必须有维生素K参与。又称骨γ-羧谷氨酸包含蛋白,该蛋白在骨矿化峰期之后才出现积聚。使用维生素K拮抗剂,可使此蛋白在骨中的含量减少,但并不影响其脯氨酸的含量,也不影响骨的机械强度。