中国组织工程研究 ›› 2019, Vol. 23 ›› Issue (7): 1097-1102.doi: 10.3969/j.issn.2095-4344.1022
• 组织构建细胞学实验 cytology experiments in tissue construction • 上一篇 下一篇
脂联素干预高糖介导人牙周膜细胞凋亡的相关机制
林仰东,殷 恺
- (天津市第一中心医院口腔科,天津市 300192)
Mechanism underlying adiponectin intervention on the apoptosis of human periodontal ligament cells mediated by high glucose
Lin Yangdong, Yin Kai
- (Department of Stomatology, Tianjin First Central Hospital, Tianjin 300192, China)
摘要:
文章快速阅读:
.jpg) 文题释义:
脂联素:是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,是一种胰岛素增敏激素,能改善小鼠的胰岛素抗性和动脉硬化症;对人体的研究发现,脂联素水平能预示2型糖尿病和冠心病的发展,并在临床试验表现出抗糖尿病、抗动脉粥样硬化和炎症的潜力。
牙周膜细胞:是牙周膜中最常见的细胞,其不断形成新的主纤维、牙骨质,并改建牙槽骨,对牙周组织的修复十分重要,是牙周治疗后形成牙龈与牙根面新附着的主要细胞来源。
文题释义:
脂联素:是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,是一种胰岛素增敏激素,能改善小鼠的胰岛素抗性和动脉硬化症;对人体的研究发现,脂联素水平能预示2型糖尿病和冠心病的发展,并在临床试验表现出抗糖尿病、抗动脉粥样硬化和炎症的潜力。
牙周膜细胞:是牙周膜中最常见的细胞,其不断形成新的主纤维、牙骨质,并改建牙槽骨,对牙周组织的修复十分重要,是牙周治疗后形成牙龈与牙根面新附着的主要细胞来源。
.jpg) 文题释义:
脂联素:是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,是一种胰岛素增敏激素,能改善小鼠的胰岛素抗性和动脉硬化症;对人体的研究发现,脂联素水平能预示2型糖尿病和冠心病的发展,并在临床试验表现出抗糖尿病、抗动脉粥样硬化和炎症的潜力。
牙周膜细胞:是牙周膜中最常见的细胞,其不断形成新的主纤维、牙骨质,并改建牙槽骨,对牙周组织的修复十分重要,是牙周治疗后形成牙龈与牙根面新附着的主要细胞来源。
文题释义:
脂联素:是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,是一种胰岛素增敏激素,能改善小鼠的胰岛素抗性和动脉硬化症;对人体的研究发现,脂联素水平能预示2型糖尿病和冠心病的发展,并在临床试验表现出抗糖尿病、抗动脉粥样硬化和炎症的潜力。
牙周膜细胞:是牙周膜中最常见的细胞,其不断形成新的主纤维、牙骨质,并改建牙槽骨,对牙周组织的修复十分重要,是牙周治疗后形成牙龈与牙根面新附着的主要细胞来源。摘要
背景:脂联素是最近发现的一种由脂肪细胞分泌的特异蛋白质,因其在调节糖脂代谢和抗氧化应激等方面的功效,而被认为是治疗糖尿病及其并发症的潜在物质。
目的:探讨脂联素干预对高糖介导人牙周膜细胞凋亡及其经典Wnt/β-catenin信号转导通路的影响。
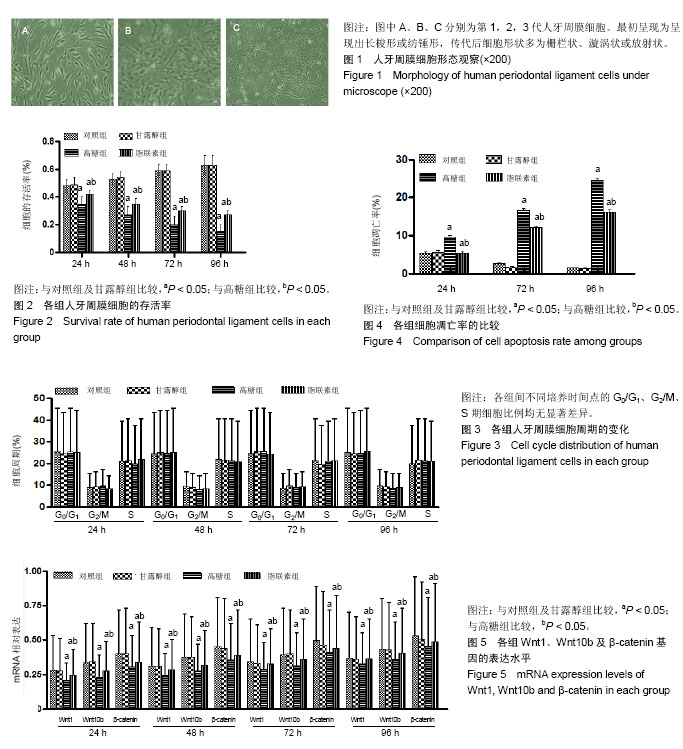
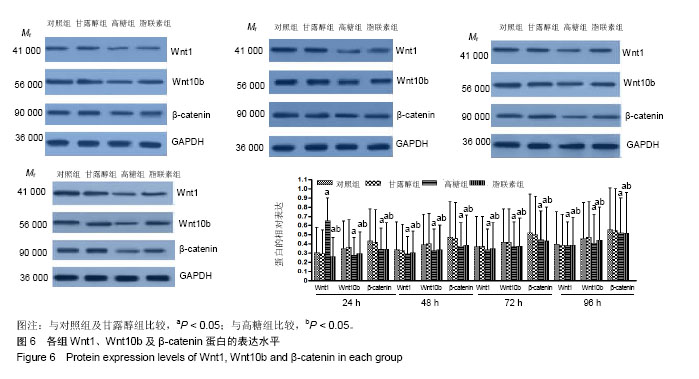
方法:体外复苏培养人牙周膜细胞。将所有细胞随机平均分为4组:对照组(正常RPMI1640完全培养基,葡萄糖浓度为11 mmol/L),高糖组(葡萄糖浓度40 mmol/L的RPMI1640培养基),甘露醇组(RPMI1640培养基+甘露醇19.5 mmol/L)和脂联素组(葡萄糖浓度40 mmol/L的RPMI1640培养基+20 mg/L脂联素)。在培养24-96 h后的不同时间点,采用MTT法检测各组细胞的细胞存活情况,采用流式细胞术检测各组细胞周期及凋亡情况的变化。通过RT-PCR和Western blot检测Wnt1、Wnt10b及β-catenin的表达水平。
结果与结论:①高糖在体外对人牙周膜细胞有显著的抑制增殖和促进凋亡作用,但对细胞周期的影响不明显;②人牙周膜细胞经体外高糖培养基培养24-96 h后,其抑制增殖作用呈时间依赖性;而脂联素则显著提高了高糖干预下细胞的增殖并抑制了细胞凋亡(P < 0.05);③RT-PCR和Western blot结果显示,与对照组及甘露醇组相比,高糖组Wnt1、Wnt10b及β-catenin mRNA和蛋白表达水平显著下降(P < 0.05),脂联素干预后Wnt1、Wnt10b及β-catenin mRNA和蛋白表达水平明显升高(P < 0.05);④结果提示,高糖条件可以促进人牙周膜细胞凋亡,抑制细胞增殖,对细胞周期无显著影响。而脂联素可以抑制上述作用,可能通过上调Wnt1和Wnt10b表达继而激活Wnt/β-catenin信号转导通路发挥作用。
中国组织工程研究杂志出版内容重点:组织构建;骨细胞;软骨细胞;细胞培养;成纤维细胞;血管内皮细胞;骨质疏松;组织工程
ORCID: 0000-0002-1429-5175(林仰东)
中图分类号:
.jpg) 文题释义:
脂联素:是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,是一种胰岛素增敏激素,能改善小鼠的胰岛素抗性和动脉硬化症;对人体的研究发现,脂联素水平能预示2型糖尿病和冠心病的发展,并在临床试验表现出抗糖尿病、抗动脉粥样硬化和炎症的潜力。
牙周膜细胞:是牙周膜中最常见的细胞,其不断形成新的主纤维、牙骨质,并改建牙槽骨,对牙周组织的修复十分重要,是牙周治疗后形成牙龈与牙根面新附着的主要细胞来源。
文题释义:
脂联素:是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,是一种胰岛素增敏激素,能改善小鼠的胰岛素抗性和动脉硬化症;对人体的研究发现,脂联素水平能预示2型糖尿病和冠心病的发展,并在临床试验表现出抗糖尿病、抗动脉粥样硬化和炎症的潜力。
牙周膜细胞:是牙周膜中最常见的细胞,其不断形成新的主纤维、牙骨质,并改建牙槽骨,对牙周组织的修复十分重要,是牙周治疗后形成牙龈与牙根面新附着的主要细胞来源。