中国组织工程研究 ›› 2014, Vol. 18 ›› Issue (28): 4463-4468.doi: 10.3969/j.issn.2095-4344.2014.28.006
• 骨髓干细胞 bone marrow stem cells • 上一篇 下一篇
密度梯度离心及贴壁分离筛选相结合分离培养大鼠骨髓间充质干细胞
王英慧,郑瑞,陈莉
- 武警后勤学院临床医学系实验技术教研室,天津市 300162
Isolation and culture of rat bone marrow mesenchymal stem cells using density gradient centrifugation and adherence separation screening
Wang Ying-hui, Zheng Rui, Chen Li
- Research Room of Experimental Technology, Department of Clinical Medicine, Logistics University of People’s Armed Police Force, Tianjin 300162, China
摘要:
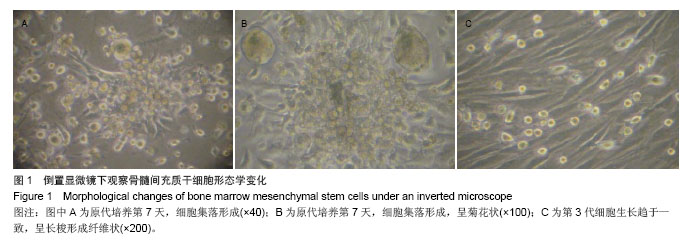
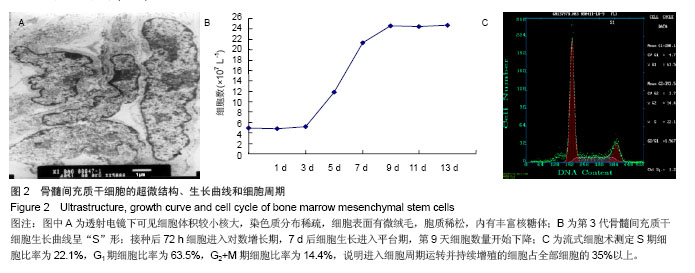
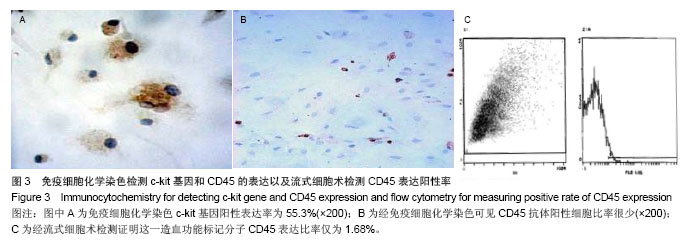
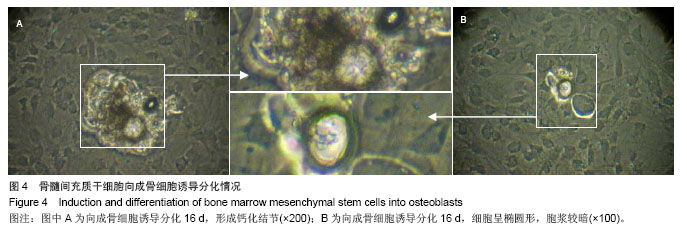
背景:在正常情况下骨髓来源间充质干细胞含量很少,且易与其他细胞相混杂,因此,建立一种简便可行的体外培养扩增方法,获得大量稳定的骨髓间充质干细胞具有重要的理论意义和应用价值。 目的:建立一种简便可行的体外培养扩增方法,获得大量稳定的骨髓间充质干细胞。 方法:采用密度梯度离心法及贴壁分离筛选法相结合体外分离培养SD大鼠骨髓间充质干细胞。倒置光学显微镜下观察细胞形态变化,透射电镜观察细胞亚微结构,锥虫蓝拒染法计算活细胞数,绘制细胞生长曲线,流式细胞仪分析细胞周期,免疫细胞化学检测c-kit和CD45的表达,流式细胞仪分析CD45的表达情况。 结果与结论: ①接种后24 h倒置光学显微镜下可见有细胞贴壁并伸出伪足,4 d时可见有细胞集落形成,14 d时细胞可达到90%融合。经传代后细胞趋于一致,为纤维样细胞,呈漩涡或火焰状生长。②透射电镜下可见第3代骨髓间充质干细胞体积较小核大,核仁明显。染色质分布稀疏,电子密度低。细胞表面有微绒毛,胞质稀松,内有丰富核糖体,而内质网、线粒体、高尔基复合体等细胞器少见,提示细胞处于原始未分化状态。③第3代骨髓间充质干细胞接种后第1天细胞数量有所减少,第2天细胞开始增长,第3天细胞进入指数增生期,第7天进入平台期,第9天细胞数量开始下降,绘制的生长曲线呈“S”形。④第3代骨髓间充质干细胞经DNA染色后采用流式细胞仪测定其DNA含量证明S期细胞比率为21.1%。⑤免疫细胞化学染色和流式细胞术证明c-kit阳性细胞比率为53.3%,CD45表达阳性率为1.68%。⑥骨髓间充质干细胞向成骨细胞诱导分化16 d后,细胞的胞体呈椭圆形,有短突起彼此相连,胞浆较暗,提示可能富含粗面内质网和高尔基复合体,并具有分泌类骨质的功能。结果证明该方法获得的大鼠骨髓间充质干细胞生长稳定,增殖活跃。
中图分类号:
.jpg)