中国组织工程研究 ›› 2014, Vol. 18 ›› Issue (18): 2836-2840.doi: 10.3969/j.issn.2095-4344.2014.18.009
• 器官移植动物模型 organ transplantation and animal model • 上一篇 下一篇
一氧化碳中毒迟发性脑病模型小鼠脑内血红素加氧酶1 mRNA和蛋白的表达
赵林岩1,于家川2
- 1大连医科大学附属第二医院重症医学科,辽宁省大连市 116023;2大连医科大学,辽宁省大连市 116044
Expression of heme oxygenase-1 mRNA and protein after delayed encephalopathy in carbon monoxide poisoning mice
Zhao Lin-yan1, Yu Jia-chuan2
- 1Department of Critical Care Medicine, the Second Hospital of Dalian Medical University, Dalian 116023, Liaoning Province, China; 2Dalian Medical University, Dalian 116044, Liaoning Province, China
摘要:
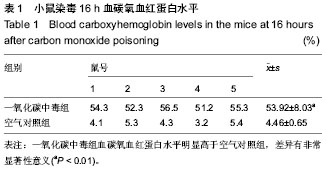
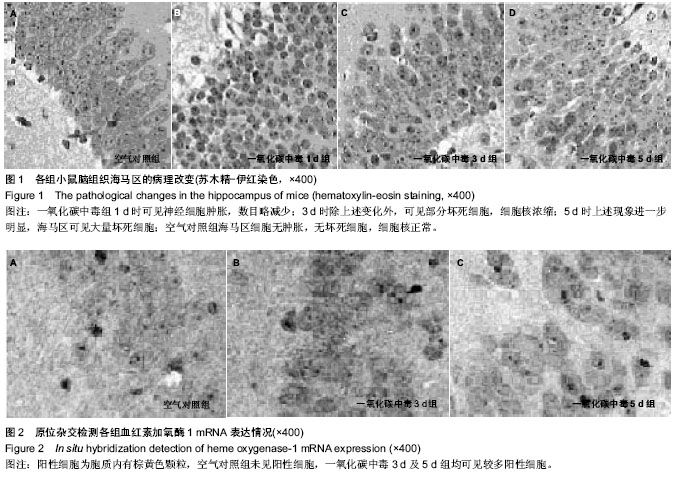
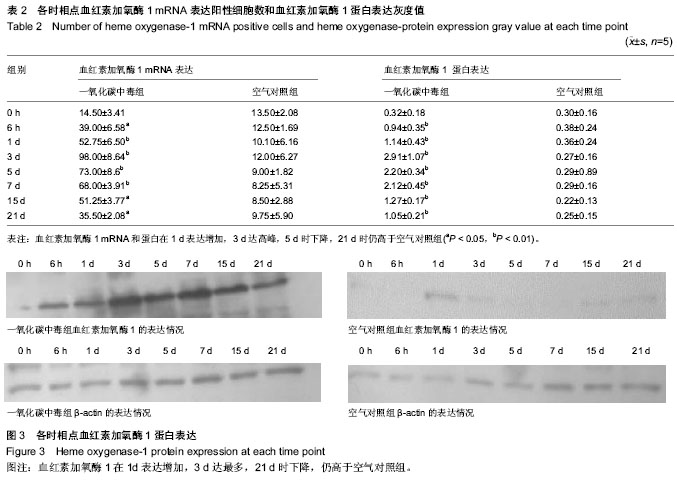
背景:研究表明一氧化碳中毒迟发性脑病症状的出现与一氧化碳中毒后神经组织细胞凋亡持续发生关系较大。有关血红素加氧酶的细胞保护作用尤其在脑损伤中的细胞保护作用还存在争议。 目的:观察一氧化碳中毒后不同时间点小鼠脑内血红素加氧酶1 mRNA和蛋白的表达变化。 方法:雄性昆明小鼠随机分为2组,一氧化碳中毒组腹腔注射一氧化碳制备一氧化碳中毒迟发性脑病模型,空气对照组腹腔注射空气。应用原位杂交及Western blot法观察两组在不同时间点海马区血红素加氧酶1 mRNA及蛋白表达变化。 结果与结论:空气对照组血红素加氧酶1 mRNA表达阳性细胞较少,染色较浅;一氧化碳中毒组海马阳性细胞数较多,染色较深。血红素加氧酶1 mRNA在1 d表达增加(P < 0.01),3 d达高峰(P < 0.01),5 d时下降(P < 0.01),21 d时仍高于空气对照组(P < 0.01)。血红素加氧酶1蛋白表达与血红素加氧酶1 mRNA表达变化相一致。结果表明血红素加氧酶1 mRNA及其蛋白的表达增加可能在一氧化碳中毒所致迟发性脑病的发病机制中起重要作用。
中图分类号: