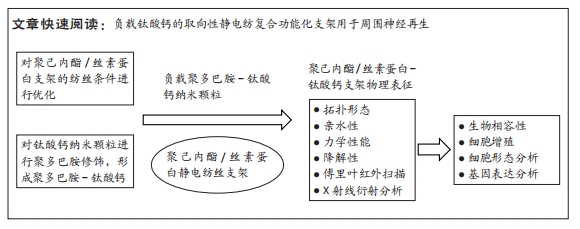
1.1 设计 材料制备与表征实验,体外细胞实验,组间两两差异比较选择t检验,多组间差异比较采用单因素方差分析。
1.2 时间及地点 实验于2023年11月至2024年5月在南通大学神经再生重点实验室完成。
1.3 材料
1.3.1 细胞 大鼠成纤维细胞系(L929)购自上海ATCC细胞库;大鼠施万细胞系(RSC96)购自中国科学院细胞库。
1.3.2 主要试剂 丝素蛋白购自中芯创惟生物科技有限公司;钛酸钙购自阿法埃莎化学有限公司;聚己内酯(Mn=80 000)、盐酸多巴胺、PBS、胰蛋白酶、DMEM培养基、胎牛血清和青霉素-链霉素购自Sigma-Aldrich(美国);无水乙醇购自永华化学科技有限公司;六氟异丙醇购自上海源叶生物技术有限公司;Tris购自生工生物工程(上海)股份有限公司;MTT试剂盒、CCK-8试剂盒、免疫染色封闭液、一抗稀释剂、DAPI、鬼笔环肽、Triton X-100和二抗稀释剂购自购自碧云天生物技术有限公司;40 g/L多聚甲醛购自国药集团化学试剂有限公司;反转录试剂盒购自TaKaRa(中国)。
1.3.3 主要仪器 静电纺丝一体机(青岛聚纳达科技有限公司,中国);分析天平(Shimadzu,Japan);正置显微镜(Leica,Germany);Zeta(ζ)电位仪(JS94,上海中辰数字技术设备有限公司,中国);描电子显微镜、光学显微镜(Zeiss,Germany);接触角测试仪(JY-PHA,承德金汉仪器制造有限公司,中国);电子万能试验机(上海拓丰仪器科技有限公司,中国);X射线衍射仪(Brooke Center-AXS,Germany);傅里叶红外光谱仪(Perkin Elmer,美国);ELX-800 酶标仪购自BioTek(美国)。
1.4 实验方法
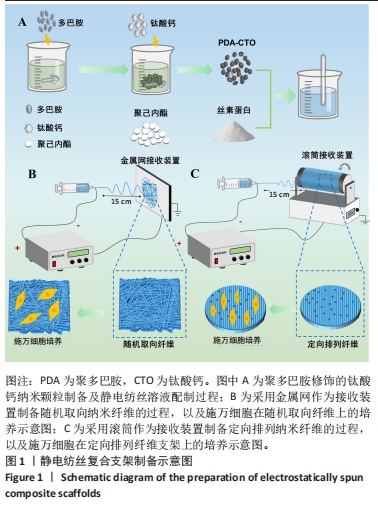
1.4.1 钛酸钙纳米颗粒的修饰及纺丝液制备 称取60.6 mg Tris溶于50 mL三蒸水,调节pH值为8.5。将100 mg多巴胺溶于Tris溶液中,搅拌均匀后得到2 mg/mL的多巴胺溶液。用分析天平称取100 mg 钛酸钙分散于多巴胺溶液中,室温下磁力搅拌(300 r/min)48 h,使聚多巴胺和钛酸钙反应充分。将混合溶液3 000 r/min离心5 min后弃去上清液。向离心管中加入适量的体积分数50%乙醇,反复吹打以除去多余的聚多巴胺,1 000 r/min离心5 min,去除上清液,重复3遍以上步骤,再用三蒸水洗涤1遍,37 ℃烘干得到钛酸钙纳米颗粒,备用。
称取0.7 g 丝素蛋白和0.3 g 聚己内酯于10 mL 六氟异丙醇中,得到丝素蛋白与聚己内酯总质量浓度为100 g/L的静电纺丝溶液。之后分别称取1,5,10 mg 聚多巴胺修饰后的钛酸钙纳米颗粒加入静电纺丝溶液中,设置超声温度为18 ℃、频率40 Hz,超声分散处理30 min,备用。
1.4.2 纺丝参数优化实验 采用参考文献[32]中的纺丝参数在静电纺丝一体机中进行纺丝。将丝素蛋白与聚己内酯静电纺丝溶液转移至5 mL注射器中,设定纺丝电压为16 kV,注射器针头与金属网接收板或滚筒接收装置距离为15 cm,注射器流速、滚筒接收器转速参数需要根据纤维微观形态进一步优化。
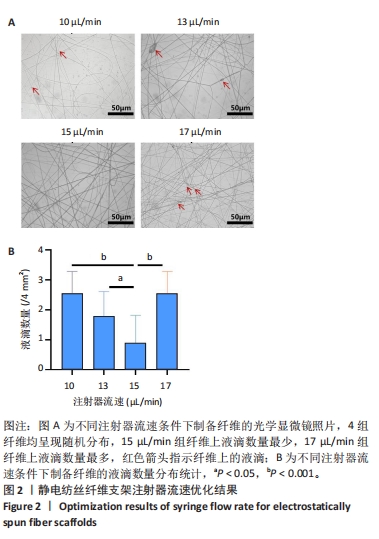
为了获得连续性较好的静电纺丝纳米纤维,需要对参考文献的注射器流速进行优化。此次实验设定固定电压16 kV、注射器针头与金属网接收板或滚筒接收装置距离为15 cm,将流速分别设定为10,13,15,17 μL/min,采用金属网作为接收装置进行纺丝30 s。用正置显微镜拍摄40倍视野下纤维的图像,每组随机选取4个区域进行观察,使用Image J软件对纤维上液滴数量进行定量分析,确定最优注射器流速,进行后续实验。
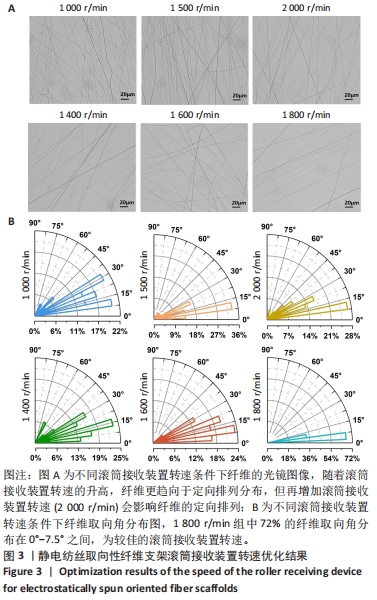
为了获得取向效果较好的纳米纤维,需对滚筒接收装置的转速进一步优化。此次实验设定固定电压16 kV、注射器针头与金属网接收板或滚筒接收装置距离为15 cm,流速为15 μL/min,将滚筒接收装置的转速分别设置为1 000,1 500,2 000 r/min进行静电纺丝30 s。用正置显微镜拍摄50倍视野下纤维的图像,使用Image J软件对纤维取向角进行统计,筛选最优转速,进行后续实验。
由于金属网接收装置与滚筒接收装置面积的差异,为了获得纺丝量一致的样品,需要确定各组静电纺丝支架的纺丝时间。分别采用金属板(制备随机取向纤维)和滚筒(制备定向排列纤维)作为接收装置制备样品,纺丝时间分别设为0.5,1,2,3 h,采集纤维微观图像及支架宏观图像进一步筛选纺丝制备时间。
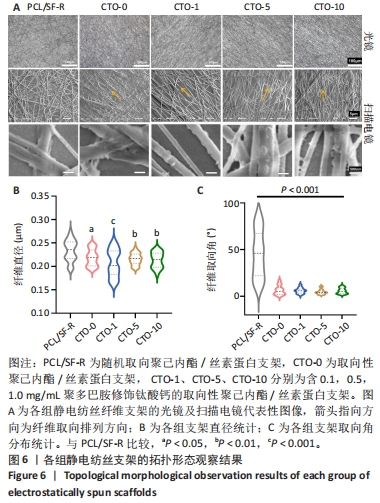
1.4.3 静电纺丝制备取向性聚己内酯/丝素蛋白-钛酸钙支架 采用直径为9 cm的滚筒作为接收装置,设置滚筒转速为1 800 r/min、接收距离为15 cm、纺丝时间1 h、针头型号20、电压16 kV、注射器流速为15 μL/min,制备取向性聚己内酯/丝素蛋白支架(记为CTO-0)及含0.1,0.5,1.0 mg/mL聚多巴胺修饰钛酸钙的取向性聚己内酯/丝素蛋白支架(依次记为 CTO-1、CTO-5、CTO-10);同时,采用金属板作为接收装置,制备随机取向聚己内酯/丝素蛋白支架(记为PCL/SF-R)。各组静电纺丝溶液物质组成,见表1。
将制备的静电纺丝纳米纤维在无水乙醇中浸泡10 min,干燥后储存。支架制备过程如图1所示。
1.4.4 钛酸钙纳米颗粒及支架拓扑形态表征
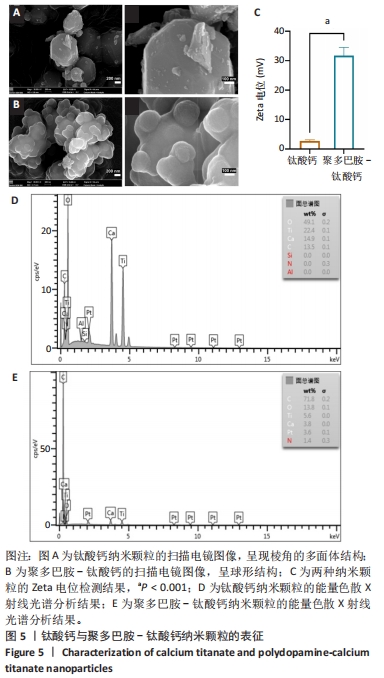
钛酸钙纳米颗粒的表征:①采用Zeta(ζ)电位仪测量钛酸钙纳米颗粒的ζ电位。分别称取1 mg修饰前后的钛酸钙纳米颗粒,用去离子水配制成5 mL混悬液;在电泳杯中加入300 μL蒸馏水,插入仪表符号,对仪器进行校准;在电泳杯中加入300 μL的钛酸钙悬浮液,将金电极插入电泳杯中并连接到仪器上开始测试。上述过程重复6次,使用软件计算粒子的电泳速度,根据Henry函数计算粒子的ζ势。②采用扫描电子显微镜观察钛酸钙纳米颗粒的微观形貌,使用能量色散X射线光谱仪分析钛酸钙纳米颗粒的元素组成。
支架拓扑形态表征:为了观察复合支架表面的宏观和微观形貌结构,将5组架样品(PCL/SF-R、CTO-0、CTO-1、CTO-5、CTO-10)分别进行光学显微镜、扫描电子显微镜观察。①光镜观察:每组选取5个样品,并且每个样品随机取4个视野,在10倍和20倍物镜下进行观察。②扫描电镜观察:将5组样品表面喷射金层(厚度约50 nm),随后将复合支架样品固定在测量仪器的铝台上,在0.015 kPa的真空条件下进行扫描电镜观察。每个样品随机选3个视野,并且每个视野选择3 000,5 000和10 000倍共3种倍数来观察,使用Image J软件统计各组纤维直径和取向度,取平均值。
1.4.5 支架物理性能表表征
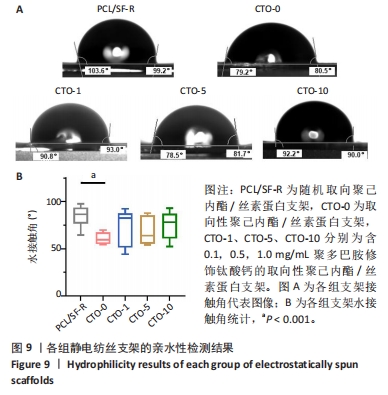
亲水性:将5组干燥的支架置于载玻片上,再固定在接触角测试仪的载物台上,在支架样品表面滴加100 μL左右三蒸水,等待3 s稳定后拍摄图像。通过测量软件对接触角进行统计记录。每组至少选择5个样品,并且每个样品随机选取4个区域进行统计分析,取平均值。
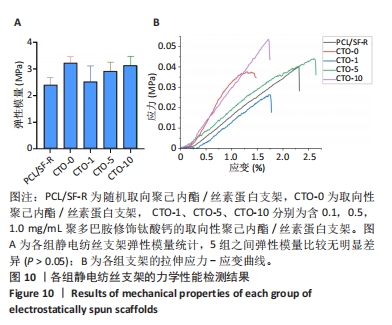
力学性能:室温下,使用电子万能试验机在材料润湿条件下测量5组支架的力学性能。将5组支架材料裁剪成宽度为2 cm、长度为3 cm的长方形,将待测样品的上下两端用夹具夹紧,夹具中间的距离为0.5 cm,测试速度为10 mm/min,记录应力-应变曲线,计算弹性模量。每组支架至少测量3个平行样品,取平均值。
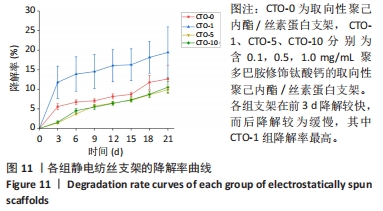
降解性能:将CTO-0、CTO-1、CTO-5、CTO-10分别裁剪成5 cm×5 cm的正方形,在室温下浸泡于PBS中21 d,每3 d记录干质量,绘制降解曲线。每组设置3个平行样品,并且每个平行样品需重复测定3次,取平均值。计算降解率,降解率(%)=(mi-md)/mi×100%,其中mi和md分别代表支架的初始干质量和降解干质量。
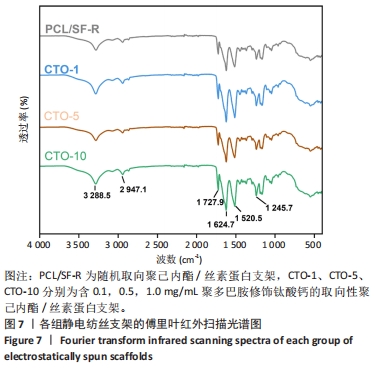
傅里叶红外扫描:将CTO-0、CTO-1、CTO-5、CTO-10裁剪成约1 cm×1 cm大小,使用傅里叶红外光谱仪对样品进行傅里叶红外扫描测试。机器预热后设置试验参数,波长扫描范围为400-4 000 cm-1,分辨率< 0.9 cm-1。将压好的待测样品置于全反射晶体的反射面,在透射模式下测量其红外吸收光谱。使用Origin 2022软件将测量数据绘制成图谱并进行分析,参照化学结构官能团的标准图谱,分析红外谱图中特征峰与位移所对应的各组样品成分。
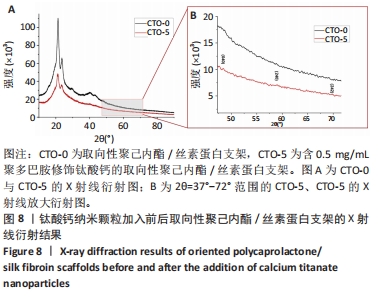
X射线衍射分析:将CTO-0、CTO-5置于X射线衍射仪的测量平台上,将X射线扫描角度设置在10°-90°之间,扫描速度为10 (°)/min。
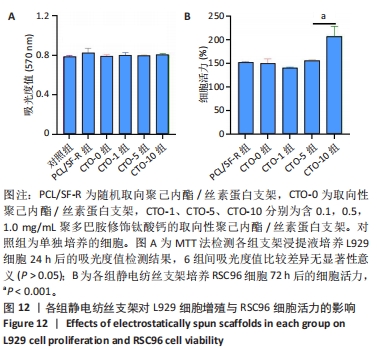
1.4.6 支架的细胞毒性检测 将5组支架分别放置在24孔板中,加入适量体积分数75%乙醇,经紫外灭菌2 h后用PBS洗涤3次,每次5 min;每孔加入2 mL DMEM培养基浸泡材料,浸提温度为37 ℃,于48 h后收集支架浸提液。将浸提液、胎牛血清(体积分数10%)、青霉素链霉素(1%)配制成完全培养基备用。
将L929细胞按照3×103/孔的密度接种于96孔板中,置于37 ℃条件下孵育4 h(细胞完全贴壁)后,弃去旧培养液,对照组加入100 μL普通完全培养基,空白组仅加入100 μL普通完全培养基(不加细胞液),实验组分别加入100 μL支架浸提液完全培养基,每组设置6个重复孔。置于37 ℃条件下培养24 h后,弃去旧培养基,在避光条件下每孔加入100 μL MTT试剂(5 mg/mL,pH=7.4)与DMEM的混合液(MTT∶DMEM体积比=1∶9),置于37 ℃条件下孵育4 h;弃培养基后加入100 μL异丙醇溶液,在37 ℃条件下孵育4 h,直至晶体完全溶解,通过ELX-800 酶标仪测量溶液在570 nm波长处的吸光度值。
1.4.7 支架对RSC96细胞活力的影响
RSC96细胞的培养:从-80 ℃低温冰箱中取出RSC96细胞,置于37 ℃水浴中快速解冻,在超净工作台中加入1 mL DMEM完全培养基(含体积分数10% 胎牛血清、1%青霉素-链霉素);吸取出细胞悬液,1 000 r/min离心
5 min,弃去上清液;向细胞沉淀中加入5 mL DMEM完全培养基后移入培养皿中,置于37 ℃、体积分数5%CO2培养箱中孵育,传代至细胞生长状态良好后使用。
支架处理:将5组支架及圆盖玻片(对照)置于24孔细胞培养板中,每组设4个复孔。经紫外照射30 min灭菌,用PBS洗涤3次,每次10 min,加入100 μL DMEM溶液浸泡支架,置于37 ℃培养箱中备用。
实验分组与干预:将生长状态良好的RSC96细胞消化,1 000 r/min离心5 min,弃去上清液,加入5 mL DMEM完全培养基制成细胞悬液并计数,接种到24孔板中的各组支架与玻片上,细胞密度为8×103/孔,置于37 ℃、体积分数5%CO2培养箱中培养。另外,空白组仅加正常完全培养基不接种细胞。实验重复3次。培养3 d后,吸弃培养基,每孔加入 500 μL CCK-8与DMEM的混合溶液(CCK-8∶DMEM体积比=1∶9),将孔板放入培养箱中孵育4 h显色;吸取100 μL溶液转移至96孔板,使用酶标仪测定溶液在450 nm处的吸光度值。通过吸光度值计算细胞活力:细胞活力=(实验组吸光度值-空白组吸光度的平均值)/(对照组吸光度的平均值-空白组吸光度的平均值)×100%。
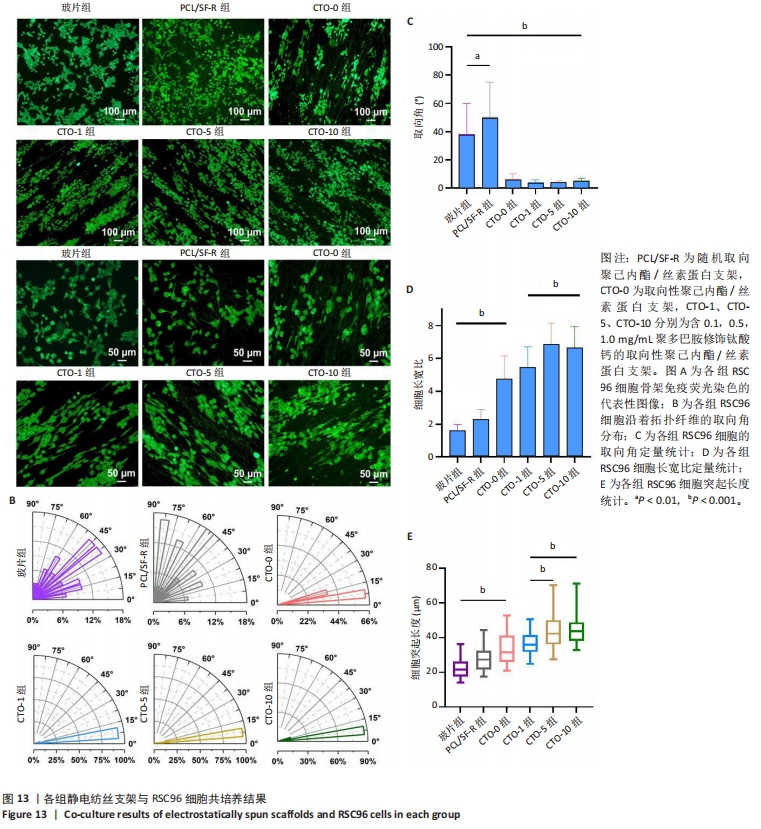
1.4.8 支架对RSC96细胞形态指数的影响 细胞培养与支架处理同上。将生长状态良好的RSC96细胞接种到24孔板内的5组支架与玻片上,细胞密度为5×103/孔,每组设4个复孔,置于37 ℃、体积分数5%CO2培养箱中培养。培养3 d后,将24孔板从培养箱中取出,用40 g/L多聚甲醛固定60 min,用PBS清洗3遍,每次10 min;每孔加入200 μL含有Triton X-100的免疫荧光封闭液室温封闭2 h,用PBS清洗3遍,每次5 min;每孔加入100 μL鬼笔环肽对细胞骨架进行标记,37 ℃避光孵育30 min;每孔加入200 μL荧光封固液,置于显微镜下观察拍摄。每组每个样品随机选取4个区域进行观察,将各组荧光图像导入Image J软件,对细胞的数量、长宽比、突起长度、取向角等进行统计分析。
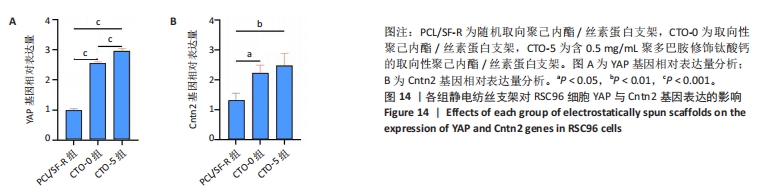
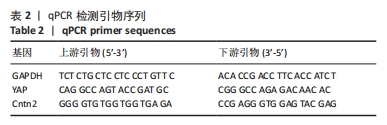
1.4.9 支架对RSC96细胞相关基因表达的影响 将生长状态良好的RSC96细胞接种到24孔板内的3组支架(PCL/SF-R、CTO-0和CTO-5)上,细胞密度为5×103/孔,每组设4个复孔,置于37 ℃、体积分数5%CO2培养箱中培养。培养3 d后收集各组细胞并置于冰盒上,每组加入1 mL Trition,反复轻轻吹打混匀后冰敷5 min,以确保细胞充分裂解;加入200 μL氯仿溶液振荡混匀30 s,4 ℃下静置5 min,12 000 r/min离心15 min,弃去上清液;加入等量异丙醇,上下颠倒以轻轻混匀,4 ℃下静置15 min;12 000 r/min离心10 min,弃去上清液,加入1 mL体积分数75%乙醇振荡混匀10 s;10 000 r/min离心5 min,弃去上清液,室温干燥,加入20 μL DEPC水溶解RNA,置-80 ℃保存备用。使用反转录试剂盒将所提取的RNA反转录为cDNA,以cDNA作为模板进行基因扩增,加入0.3 μL上游引物、0.3 μL下游引物、1 μL cDNA和3.4 μL DEPC水以建立5 μL PCR反应体系,进行实时定量PCR反应,每组设置3个重复,实验重复3次。扩增反应的参数设置如下:95 ℃下10 min,然95 ℃下15 s,60 ℃下1 min,共40个循环。以GAPDH为内参,YAP、Cntn2作为目标基因,采用2-ΔΔCt法计算靶基因的相对表达量,并进行统计分析。PCR引物由上海捷瑞生物工程有限公司设计,见表2。YAP蛋白受细胞骨架动态变化的调节,与细胞骨架张力和细胞黏附状态相关,YAP蛋白基因表达越高,说明细胞骨架受支架影响越显著。Cntn2为神经细胞黏附分子,主要参与神经细胞之间及神经细胞与周围细胞之间的黏附和相互作用,Cntn2基因表达量越高,说明细胞与周围细胞或基质的黏附作用更强。
1.5 主要观察指标 各组支架的拓扑形貌、亲水性、降解性及生物相容性等表征,以及对施万细胞活力、形态及相关基因表达的影响。
1.6 统计学分析 采用Origin、Image J、Graph pad等软件进行统计分析。结果数据用x±s表示,两组之间比较采用 t 检验,多组均数之间比较采用单因素方差分析,之后比较采用Tukey检验。P < 0.05为差异有显著性意义。该文统计学方法已经南通大学生物统计学专家审核。