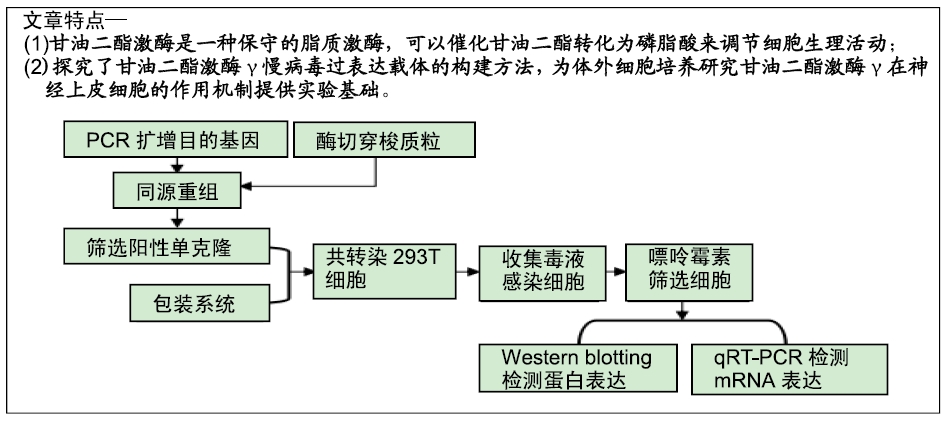
1.1 设计 同源重组法构建大鼠DGKγ慢病毒过表达载体。
1.2 时间及地点 实验于2019-05-01在山西医科大学完成。
1.3 材料 实验中所用质粒和293T细胞均由作者所在实验室保存;反转录试剂盒、荧光定量PCR试剂盒、DNA Marker和限制性内切酶购买自Takara公司;PCR试剂盒、无内毒素质粒中提试剂盒和琼脂糖凝胶DNA回收试剂盒购买自康为世纪生物公司;RNA提取试剂、Lipofectamine 2000转染试剂盒购买自Invitrogen公司;一步定向克隆试剂盒购买自近岸蛋白科技公司。ploybrene和嘌呤霉素购买自索莱宝科技公司;人β-actin内参引物(NO. B661102)购自上海生工生物工程有限公司。羊抗DGKγ购买自Santa Cruz公司;兔抗 β-actin多克隆抗体购买自博士德生物工程有限公司。
正常成年健康SD大鼠3只,雄性,体质量300-350 g,由山西医科大学实验动物中心提供,动物合格证号:SXYK2009-0001。
1.4 方法
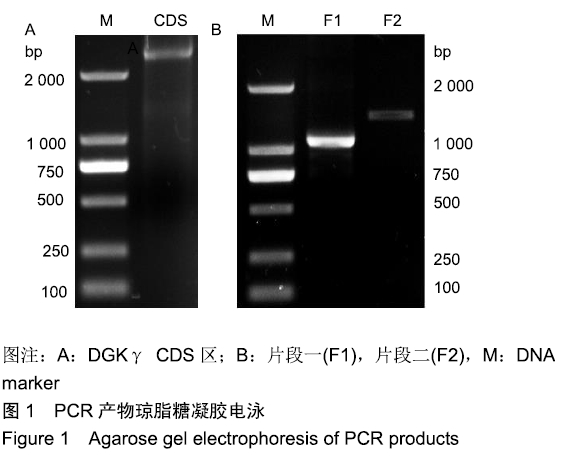
1.4.1 引物设计 在NCBI上检索到大鼠DGKγ基因转录产物序列NM_013126.1,其编码序列(coding sequence,CDS)全长2 367 bp。利用BioXM软件,遵循引物设计基本原则,设计两对上下游引物分别扩增CDS区5’端1 029 bp的碱基(片段一,F1)和3’端1 362 bp的碱基(片段二,F2),其中片段一的3’端和片段二的5’端之间拥有24 bp重叠。在片段一上游引物的5’端和片段二下游引物的5’端分别加入15-20 bp的载体同源序列,保证片段插入载体的方向。PCR反应用到的引物序列如下:F1 for:5'-CCT CCA TAG AAG
ATT CTA GAG CCA CCA TGA GTG ACG GGC AAT GGG TCT GTC TCT CAT CAG AAG AAT-3'和F1 reverse 5'-GAC GGA GGA GTT CCC TTC CAC-3';F2 for:5'-TGG GTG GAA GGG
AAC TCC TCC GTC-3'和F2 reverse:5'-GCA GAT CCT TCG
CGG CCG CTT AGT CCT TTG AAC GGC TTT TCC TCC TCA GAG AAA AGA AGC-3'。扩增CDS区的上下游引物分别为F1 for和F2 reverse。
1.4.2 目的片段扩增 用TRIzol法提取成年SD大鼠脑组织中总RNA,反转录合成cDNA,PCR扩增片段一和片段二,反应条件如下:预变性94 ℃,2 min;变性94 ℃、30 s,退火60 ℃、35 s,延伸72 ℃、2 min,35个循环;终延伸72 ℃,5 min。PCR产物用1%琼脂糖凝胶电泳,切胶回收目的条带并测序,测浓度后用于穿梭质粒的构建。
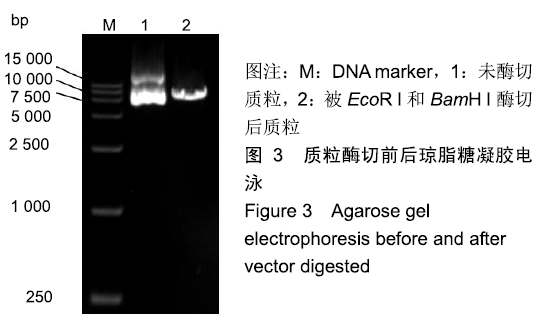
1.4.3 穿梭质粒构建 在50 μL酶切反应体系中,加入5 μL 10xQuickcut
green buffer,38 μL无菌水,5 μL质粒载体(< 1 μg),1 μL EcoR I酶和1 μL BamH I酶,充分混匀,37 ℃反应1 h,回收纯化酶切产物并用1% 琼脂糖凝胶电泳检测,测浓度后用于质粒构建。在20 μL同源重组反应体系中,加入线性化载体、片段一和片段二胶回收产物,线性化载体总量为150
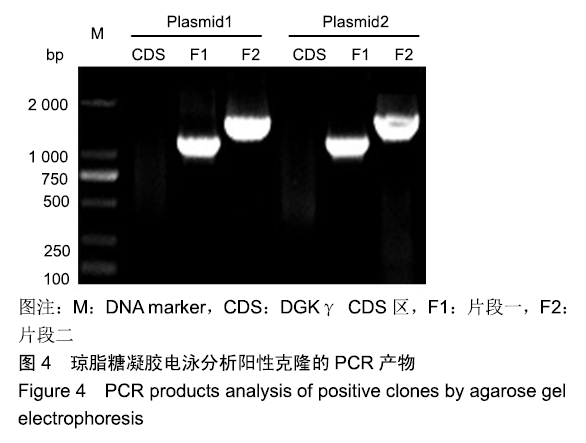
ng,两个片段与载体的摩尔质量比为2︰2︰1,50 ℃反应25 min。取重组产物转化DH5α感受态细胞,涂板,37 ℃恒温培养箱过夜,氨苄青霉素筛选后,挑10个单克隆培养菌液。随机选取两管菌液用质粒中提试剂盒提取质粒作为模板进行PCR反应,扩增CDS区、片段一和片段二,1%琼脂糖凝胶电泳,切胶回收目的条带并测序,将测序成功的质粒命名为CMV-rat
DGKγ-GFP。CMV-rat
DGKγ-GFP质粒上含有目的基因rat DGKγ的CMV启动子和CDS区序列,以及标记基因GFP的EF1α启动子和CDS区序列。
1.4.4 293T细胞培养与慢病毒包装 将293T细胞株接种于3.5 cm培养皿中,培养基为含体积分数10%胎牛血清、 100 U/mL青霉素和100 mg/L链霉素的高糖DMEM完全培养基,37
℃体积分数5%CO2细胞培养箱中培养。待细胞密度达80%-90%,细胞状态良好时进行慢病毒包装。用无血清的DMEM培养基制备CMV-rat DGKγ-GFP质粒和2个包装质粒三者混合的稀释液300 μL,质粒的质量比为5︰2︰3,总量为4.0
μg,室温孵育5 min;取7.5 μL Lipofectamine 2000,加到300 μL无血清的DMEM培养基中混匀;将上述2种稀释液混匀,室温孵育20 min,形成DNA-lipid复合物。用1.2
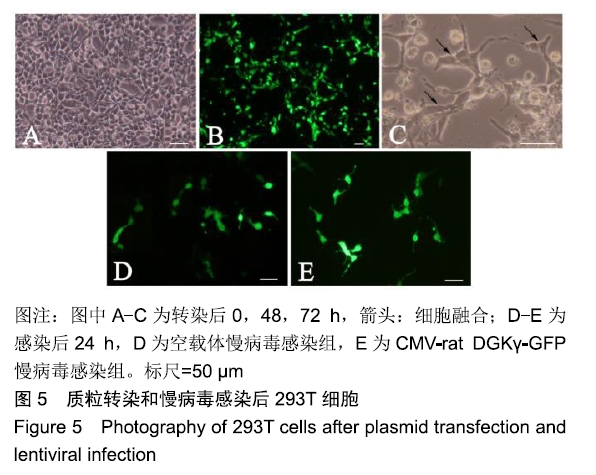
mL含血清DMEM培养基替换旧培养基,将600 μL DNA-lipid复合物逐滴加入培养基中,轻轻晃动培养皿温和混匀。转染6 h后,荧光倒置相差显微镜下观察到绿色荧光,将上清液更换为完全培养基;转染48 h后,可见绿色荧光增强,GFP阳性细胞数增多;转染72 h后,收集培养皿中含病毒颗粒的上清液,用0.45
μm针头式滤器过滤掉细胞碎片后备用。
1.4.5 CMV-rat
DGKγ-GFP慢病毒感染293T细胞 将293T细胞株接种于含完全培养基的3.5 cm培养皿中,细胞密度达到60%左右,细胞状态良好时,将CMV-rat DGKγ-GFP慢病毒毒液1 mL与等量的培养基混匀后置换旧培养基,并加感染促进剂ploybrene即用型溶液,按1︰1 000稀释。感染24 h后,荧光倒置相差显微镜下观察到部分细胞呈GFP阳性表达;感染48 h后,可见GFP阳性细胞数增多;感染72 h后,用浓度为10 mg/L的嘌呤霉素筛选GFP阳性细胞,收集细胞进行荧光定量PCR检测和Western blotting检测。以CMV-GFP空载体作为对照。
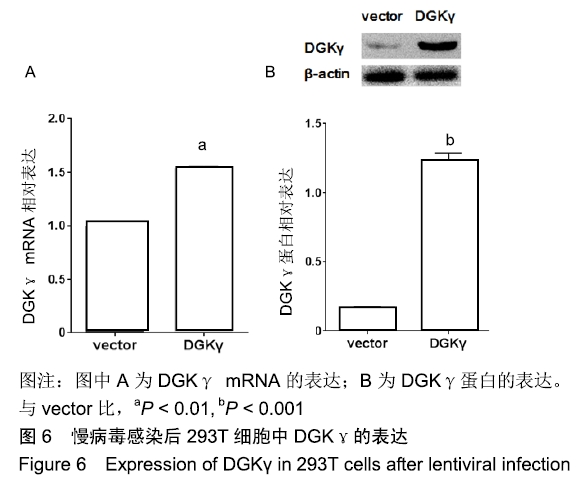
1.4.6 荧光定量PCR检测DGKγmRNA的表达 用TRIzol法提取各组细胞的总RNA,反转录合成cDNA,用RT-qPCR检测各组样本中DGKγ的表达量,重复3次,采用2-∆∆Ct法计算DGKγ相对于内参基因β-actin的表达量。大鼠DGKγ基因荧光定量PCR的上下游引物为:F 5'-GTG GGA TCC CAC
AGA GCT CAG-3'和R 5'-GAC
GGA GGA GTT CCC TTC CAC-3';PCR扩增条件:95 ℃,10 min;95 ℃,15 s →60 ℃,30 s →72 ℃,20 s共40个循环;95 ℃,15 s;60 ℃,1 min;95℃,15 s。
1.4.7 Western
blotting检测DGKγ蛋白的表达 用RIPA裂解法提取各组细胞的蛋白质,100 ℃煮沸10 min使蛋白变性,经12% SDS-PAGE电泳,转膜后用5%蛋白干粉(TBST配制)封闭1.5 h,分别加入一抗羊抗 DGKγ(1︰100)、兔抗β-actin多克隆抗体(1︰1 000),4 ℃孵育过夜。分别加入HRP标记的兔抗羊IgG (1︰5 000)、羊抗兔IgG(1︰5 000),室温孵育1 h,膜上滴加低背景化学发光剂,于全自动凝胶成像系统曝光并拍照,实验重复3次。用 Image J软件对显影条带进行测量,目的蛋白与内参条带的灰度比值为目的蛋白的相对表达水平。
1.5 主要观察指标 CMV-rat DGKγ-GFP慢病毒载体PCR产物测序鉴定结果,293T细胞被慢病毒感染后DGKγ mRNA和蛋白的表达。
1.6 统计学分析 用SPSS 13.0软件进行统计分析,数据以x(_)±s表示,两组间的比较用t 检验分析,P < 0.05为差异有统计学意义。