3.1 本次大鼠胫骨实验性骨不连模型设计的背景 由于工业现代化和交通业的发展,高能量损伤频发,高能量损伤导致复合伤及严重开放性骨折,使治疗更加困难且并发症发生率增加,美国休士顿的Mark R. Brinker进行了一项关于胫骨骨不连患者的生活质量调查研究,并与既往其他骨折及未骨折人群生活质量的研究进行对比。研究表明
骨不连导致患者的肢体活动受限,对日常生活的消极作用可能比肾脏透析更为严重,胫骨骨不连患者的生活质量要低于糖尿病患者和经历心肌梗死的患者。胫骨干骨不连是一种严重的慢性疾病状态,对患者的生理和心理都有极大的负面影响。
骨不连是一种常见的并发症,其治疗仍是骨科医师所面临的最具挑战性的问题之一。由于骨不连给患者带来巨大的痛苦和影响且其治疗一直是困扰骨科医师的的难题,有条件的医师开始着手动物实验研究探索骨不连治疗的有效手段。
Kaspar等[14]饲养SD大鼠,通过股骨截骨、破坏骨膜、去除骨髓等方法建立萎缩性骨不连模型,采用外固定架固定后研究骨再生能力。为他人研究外固定治疗骨不连以及骨再生能力研究提供了条件。
高能量原始损伤过重可能是容易导致骨不易愈合的一个因素。但很多时候遇到的一些骨不连、骨缺损病例, 起因于一个单纯的股骨或胫骨闭合性骨折,用标准的AO内固定技术,主持手术的医生认为手术顺利,术后的X射线片也显示骨折断端解剖复位与固定可靠,然而却发生了钢板断裂骨不连,不得不再给患者实施复杂的固定与植骨手术,甚至有的最终还发生了感染性骨缺损的悲剧。这提示了现代科技文明下的“骨折病”已经不仅仅是医学技术问题,它与社会背景、市场推动的医学模式亦密切相关。可靠、微创、简单、经济、避免或减少供区损伤是衡量医疗方法优劣的基本标准。
科学发展的历史表明技术往往超前于基础研究成为理论突破的先导。对骨不连、骨缺损的发生与医疗理念问题已经走到了十字路口,如果继续进行“细化研究与微观理论阐述”,沿用传统骨科思维与医疗模式,那么可能难以有所作为。如果回归自然,认识和实践骨科自然重建理念,正确应用简单、成熟 、疗效可靠的实用技术,实现有把握地治愈各类骨不连、骨缺损并非难事,因为疗效才是检验医疗方法、医生综合能力的惟一标准[15]。
3.2 本胫骨实验性骨不连模型设计的科学性及可靠性 尽管针对骨不连进行了大量研究,却仍然无法明确骨不连的定义。经临床或X射线证实骨折已停止愈合且估计不会再连接时,才能诊断为骨不连。
骨折的修复过程不是一个简单的愈合过程,而是一个组织再生重建的过程,骨折愈合过程基本可分为4个时期:血肿期、肉芽期、膜内或软骨内成骨期和重塑期。正常的骨折修复过程是骨组织完全性再生,而不是纤维瘢痕修复。
在骨折愈合过程中发挥重要作用的主要是生物学因素,愈合过程中出现和消失、或被修饰改变的级联反应物
质属于生物化学因素;另外生物力学因素也起一定的作用,由于力学条件不理想时骨折就延迟愈合或出现不愈合。骨折断端因某种原因形成较大的空隙或丧失了一些骨质,因为组织学的改变使已形成的纤维软骨出现萎缩,使其在新骨生成过程,成骨受阻,由纤维组织填充缺损间隙,骨折端不能实现骨性愈合就会引起骨不连[16]。
在骨折愈合过程中影响骨组织再生起消极作用的因素即为骨不连的病因,其中常包含多个方面的因素,各因素间关系且极为复杂,总体来说可分为3类[17-18]:生物学因素、技术性因素和联合因素。生物学因素包括患者的身体素质、骨折局部情况及生活习惯等因素;技术性因素主要是由于在骨折治疗过程中操作不规范引起的;联合因素是指骨不连的发生有时仅是上述影响因素中的其中一项,有时可能是上述影响因素中的两个或两个以上因素同时存在,各种综合因素最终导致了骨不连的发生[19]。
骨不连的试验模型的建立是很困难的,而且大多数选择用啮齿类动物来建立模型,它们的建立多基于清除骨折局部骨传导与诱导因子,创建模型时需要切除啮齿类动物
的骨干或干骺端,包括骨断端周围的骨膜也要去除。实验
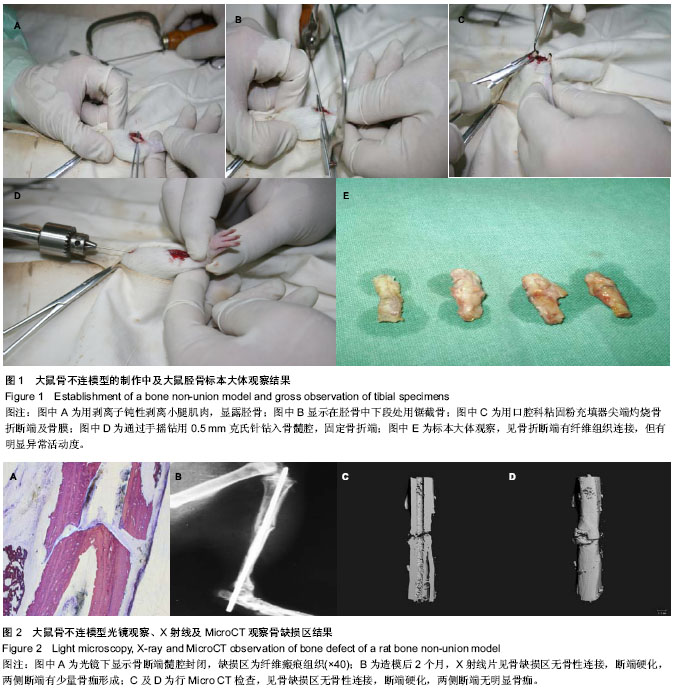
选取30只SD大鼠作为实验对象,在建模的2个月后将大鼠处死,并取胫骨进行大体标本肉眼观察,病理组织学检查和放射学(包括X射线及Micro-CT)检查,来验证本此实验的造模方法的可行性及可靠性。
Johnson等[20]指出在临床实际工作中,常常因操作不当等原因导致骨折两断端过度骨膜剥离或扩髓。因此实验性骨不连模型的制作需要在一些不利于骨生长和骨修复的环境下来进行。实验在截骨后用口腔科粘固粉充填器的尖端灼烧骨折断端(包括骨膜),消除了骨外膜成骨及骨髓腔成骨因素,能削弱骨愈合能力,形成骨不连模型,这种模型较接近临床骨折延迟愈合及骨不连的环境。基于以上机制,设计本实验,有一定的科学性。
实验中SD大鼠造模后2个月处死,取胫骨进行大体标本观察,可见骨缺损区一直无骨性连接形成,早期为血肿形成,后期逐渐机化形成纤维组织瘢痕,但扔无明显骨性连接,局部骨断端有反常活动,骨端硬化,两侧断端有少量骨痂,与骨不连的临床表现比较一致;取材行病理组织学检查,光镜下可见骨断端硬化,无骨性连接,背纤维组织覆盖,缺损区被纤维瘢痕软组织填充,符合骨不连病理组织学特征;行X射线片及Micro CT等放射影像学检查,见骨缺损区无骨性连接,断端硬化,两侧断端有少量或无骨痂形成,符合骨不连影像学表现。上述表现,无疑可以确定为骨不连。因此,实验采用的造模方法符合骨不连的要求,反映了骨不连的一般特征,进而证明本实验骨不连动物模型可靠性。
3.3 动物骨不连模型的意义 骨不连形成的原因有全身和局部因素两方面,而骨折局部因素如局部血液供应,骨折端接触的紧密程度及接触面积等是影响骨折愈合的主要因素[21]。还有作者研究认为,全身因素如年龄,吸烟等对骨折愈合无决定性影响,但不包括严重营养不良及恶病质等全身因素。
骨不连与年龄因素相关性不明显,青年人与老年人相比,骨折愈合能力的差异无显著性意义,但是儿童与成人相比,骨折的愈合能力增强[22-23]。骨折局部条件是影响骨折愈合的主要因素,主要包括骨折断端的缺损距离较远,骨组织的内外膜丧失严重,骨髓腔闭塞3个因素,从而导致骨不连。
骨不连的治疗,到目前为止仍是一个世界性的难题,了解骨不连的病因,探索其最佳的治疗手段依然是临床骨科医师追求的最终目标,无数医师们对此作了大量的临床及基础研究。骨不连的治疗方法更是多种多样,包括非手术疗法:如口服中药,夹板石膏固定,及超声波等物理疗法;手术治疗:如内外固定,骨移植,骨组织工程等;微创局部注射疗法:如注射骨髓,骨诱导因子,骨髓间充质干细胞等,应根据骨不连的具体类型选择最佳的治疗方案。近年来,物理以及生物学方法对骨不连治疗取得了不错成效,但这些疗法并不能从根本上解决肢体畸形和缩短问题,所以手术治疗仍是骨不连最主要的治疗方法,自体髂骨移植是目前认为在植骨种类上治疗骨缺损和骨不连的金标准[24],常被用作衡量其他骨移植效果的标准。对于骨不连及骨缺损的治疗,医生的职责是创造条件,帮助启动已经损伤、失眠、缺乏活力的病变组织,使其重新激发再生的活力,完成肢体残缺的修复与重建。离开了生命自然修复能力的本源,任何高新技术也是无能为力的。
在固定技术方面,近年来应用Ilizarov全环外固定架较普遍,因为其有独特的优势
[25]。龙超等
[26]报道的“骨搬运”治疗骨缺损是Ilizarov技术之一,已成为国际和国内的首选方法
[27-37]。其中,Ilizarov 技术是治疗四肢伴有严重感染及骨缺损等比较复杂骨不连的有效方法,已成为国际公认的金标准
[38-40],配合骨髓移植、骨移植往往能取得更加满意的临床效果。虽然Ilizarov技术可以解决骨不连的治疗过程中存在的并发症,但在处理一些特殊条件的骨不连时也不能完全替代其他技术,Ilizarov技术为临床治疗骨不连提供一个有效的可选择方法。临床治疗四肢骨不连时需要遵循个体化原则,根据患者具体情况权衡利弊,选取最佳合理的治疗方法
[41]。对骨不连的治疗,要具体问题具体分析,重视软组织的保护,必要时联合运用多种手术及非手术治疗方法,这样才能取得满意的效果,不能指望运用同一种方法来解决一切的问题。目前九成以上的骨不连可以手术治疗,并且其中80%的病例预后很好
[42]。
目前,骨髓间充质干细胞及人脐带源间充质干细胞的研究,更为骨不连提供了一种崭新的方法,有实验证实,人脐带源间充质干细胞,具有较低的免疫原性[43-45],可以种植到大鼠的骨组织,分化成骨细胞,完成骨不连的治愈。干细胞研究领域的巨大进展,预示着在其治疗骨不连及骨折愈合最佳策略方面具有巨大的潜力,还有一些问题需要进一步的研究,如能进一步的研究及开发,具有较好的应用前景[46]。
骨不连治疗的首要目标是达到骨折愈合,但这并非是惟一目标,最重要的是使患肢恢复正常解剖结构及良好的运动功能,提高患者的生活质量。对大多数患者来说,如果相邻关节僵硬使肢体缺乏功能,即使骨折愈合了也不是最终的满意结果。因此在骨不连的临床治疗中,最为重要的应是将现代骨折治疗学与现代康复医学密切结合,才能取得更好的疗效如果只注重于治疗,而对康复体系缺少理解,将使患者得不到正确的康复指导训练,这正是当前骨科领域一个尚未引起足够重视的问题[47]。
总之,建立一个符合条件的动物骨不连模型,有其客观性和实际意义,因为无论哪种方法均需首先通过大量的动物实验阶段,从而进入临床试验阶段,Schmitz等[48]将动物体内终生不能自行修复的最小骨缺损定义为临界性骨缺损,在动物临界性骨缺损模型中其骨缺损区应为纤维性愈合而不能达到骨性愈合。因此,建立一个符合这样条件的动物骨不连模型,在一致的标准下来探讨骨不连的机制和治疗方案,才有其客观意义和实际意义。本课题研究为此提供一个比较可靠的动物骨不连模型。