设计:单一样本细胞学观察。
时间及地点:实验于2012年3至5月在大连医科大学附属二院完成。
材料:人骨髓标本来源于24岁健康男性自愿者。
间充质干细胞与血管内皮细胞共培养促进类前微血管结构发生实验所用试剂及仪器:
实验方法:
人骨髓间充质干细胞的分离培养及鉴定:抽取骨髓液标本5 mL,肝素抗凝,经含体积分数10%胎牛血清的H-DMEM培养基等体积稀释后直接接种至T25细胞培养瓶后,置含体积分数5%CO2的细胞培养箱静止培养三四天。然后,更换新鲜的含体积分数10%胎牛血清和5 μg/L碱性成纤维细胞生长因子的H-DMEM培养基培养基。1周后镜下观察可见小的细胞集落形成,经过体外扩增后,流式细胞仪鉴定其表型(CD105,CD73,CD34的表达情况),并冻存P4-5代细胞备用。
人血管内皮细胞的培养:内皮细胞培养于专用培养基EGM,细胞达到80%-90%融合时经胰蛋白酶(0.1%)消化后进行1
∶3传代。体外可最多扩增15代。实验均使用P4或5代细胞。
DiI、DiD细胞标记及细胞在三维支架体系的接种:采用活细胞标记试剂DiI、DiD分别对人骨髓间充质干细胞和内皮细胞进行标记。其具体标记过程按照试剂说明书进行操作。简言之,首先吸弃待标记细胞的培养基,更换添加有标记试剂DiI、DiD(5 nmol/L)的培养基。放置细胞培养箱内(体积分数5%,37 ℃)孵育30 min后,用不含胎牛血清的培养基轻轻冲洗3次,最后分别加入对应的新鲜培养基,避光培养1.0-2.0 h后再离心收集以应用于支架体系的接种。
细胞在三维支架体系的接种:分别收集经标记的人骨髓间充质干细胞和内皮细胞并制备高浓度细胞悬液,按3∶1比例进行细胞接种(细胞总数1×106/支架)。蚕丝蛋白支架在使用前需经过培养基的浸泡预处理,待完全吸弃支架内培养基后,将制备的细胞悬液以多点接种的方式接种至支架内部。然后迅速将接种有细胞的支架移入细胞培养箱。待孵育2.0-3.0 h后,再缓慢加入少量的新鲜培养基(H-DMEM∶EGM=1∶1)以避免细胞从支架体系脱落。培养24 h 后最终加入适量的细胞培养基 (3 mL/12孔)进行维持培养。
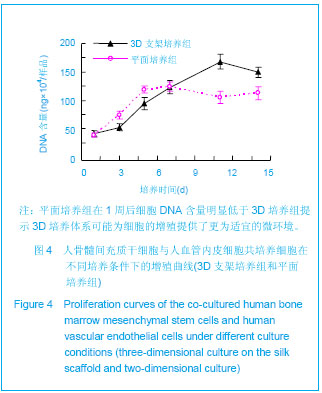
PicoGreen DNA含量的测定:定期收集接种有共培养细胞的蚕丝支架,经PBS洗涤两三次后,将样品保存于-80 ℃。待样品收集结束后解冻所有样品,加入试剂盒所提供的细胞裂解液溶解细胞,其余按Quant-iTTM PicoGreen dsDNA试剂盒说明进行操作。以标准DNA样品制定DNA浓度标准曲线,最终反应产物置酶标仪测定各孔荧光强度(Ex=480 nm,Em=520 nm,BioTek,USA)。每个样品设2个平行孔,每个时间点设2个平行样品,并根据标准曲线计算各样品DNA含量。平面培养条件下(12孔细胞培养板)共培养组内的细胞DNA含量作为对照。
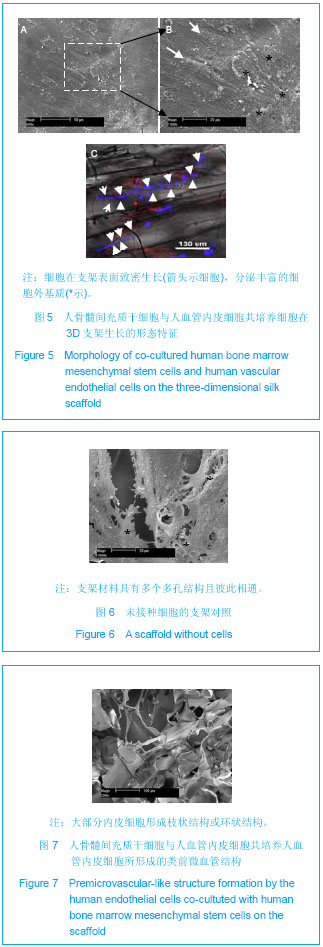
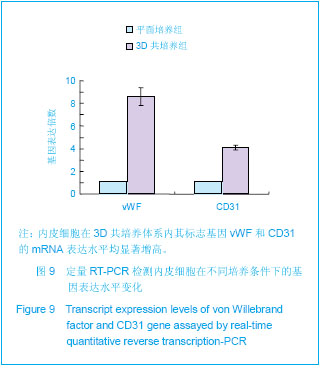
扫描电镜分析:样品收集后经PBS清洗两三次后,立即加入25 g/L戊二醛溶液进行室温下固定2-4 h,PBS清洗两三次后用10 g/L四氧化锇溶液后固定2 h (4 ℃)。经PBS充分清洗后,将固定后样品进行梯度乙醇脱水(体积分数30%,70%,90%,100%,100%)。接下来将经完全脱水处理的样品放置于真空冷冻干燥箱内干燥过夜,然后将样品置于扫描电镜仪器(Olympus,TM3000)观察分析。
激光共聚焦显微镜(CLSM)形态观察:收集共培养样品,经PBS清洗后,直接置于激光共聚焦显微镜(Leica SP2)下观察内皮细胞的生长形态特征(DiI: Ex/Em= 549/565 nm;DiD:Ex/Em=644/665 nm),并保存叠加图像。
实时定量RT-PCR检测:收集共培养样品,经多次胰酶消化收集支架内所有细胞,经流式细胞分选技术分离富集标记的内皮细胞。直接应用TRIZOL试剂及RNA提取试剂盒提取内皮细胞样品RNA。经分光光度计测定A260/A280评价所提取RNA的质量。然后应用SYBR?Green RT-PCR 试剂盒(反应体系为20 L)合成目的基因的PCR产物。该产物置于ABI(STEP-1)实时定量PCR仪进行检测分析。
引物序列如下:
其基因定量表达水平通过2-△△ct公式计算,并最终以共培养组/对照组(平面培养组)的相对表达水平表示。
主要观察指标:①人骨髓间充质干细胞和内皮细胞的培养观察结果。②3D共培养体系内细胞的增殖情况。③共培养细胞在3D支架生长的形态特征。④共培养体系内内皮细胞的基因表达分析。
统计学分析:实验中所有实验数据均以x±s表示,统计分析均采用Student t 检验分析。P < 0.05为差异有显著性意义。


.jpg)
.jpg)