设计:随机对照动物实验。
时间及地点:实验于2008年3月至2009年1月在四川大学华西临床医学院/华西医院科研基地完成。
材料:24只新西兰白兔,雌雄各半,3月龄,体质量2.0-2.5 kg。由四川省成都市武侯区华西实验动物中心提供,合格证号:SCXK(川)2004-14。
所有的动物独立饲养,光照和黑暗时间为12 h更替,统一自由饮食和饮水。在建立膝骨关节炎兔模型,遵循中华人民共和国实验动物道德委员会关于动物保护和相关法规的指导方针下进行。
超声软骨细胞凋亡、caspase-8和caspase-3影响实验所用主要试剂及仪器:
.jpg)
实验方法:
膝骨关节炎模型建立:体积分数5%水合氯醛 (3 mL/kg)腹腔注射到兔子。麻醉完全后,固定于新西兰大白兔专用手术台。备皮,0.5%碘伏消毒,无菌纱布铺巾,取右膝切口,暴露前交叉韧带,剪断前交叉韧带,前抽屉试验阳性;用无菌生理盐水冲洗手术野,复位髌骨,依次缝合关节囊、皮下组织、皮肤,0.5%碘伏消毒皮肤切口。术后允许笼内自由活动。并按每天15 mg/kg的剂量肌注庆大霉素(40 g/L), 预防感染,连用5 d。术后6周兔膝骨关节炎模型成功建立。
动物分组:
24只新西兰白兔随机被分为3组,每组8只。
正常组:没有膝关节炎家兔健康正常兔,没有接受任何治疗。
模型组:正常健康兔行前交叉韧带离断术诱导膝骨关节炎,没有接受任何治疗。
超声组:正常健康兔行前交叉韧带离断诱导膝骨关节炎,经过6周的造模恢复,接受超声波治疗10 min/次,1次/d,0.3 W/cm2,1 MHz,膝关节暴露。共治疗10次,连续治疗5 d后中间停止治疗2 d再连续治疗5 d。
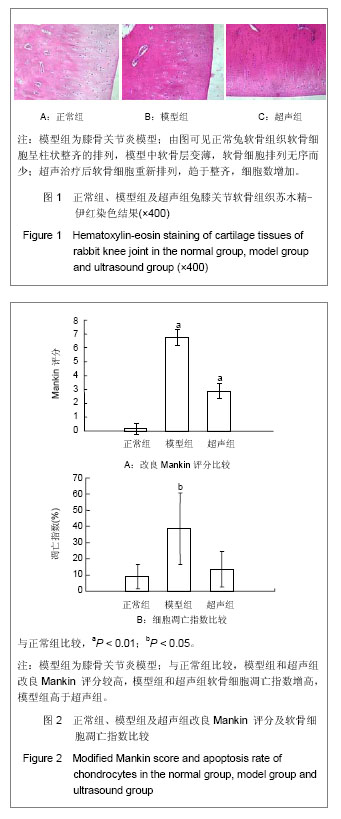
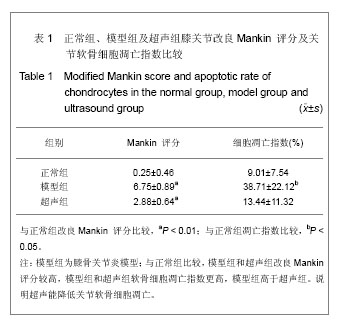
组织学观察:各组兔子均于造模后8周后处死,软骨组织是在体积分数4%甲醛固定,石蜡包埋。 5 μm分别作苏木精-伊红染色,安装在光镜下观察软骨细胞形态。采用改良Mankin评分系统进行骨关节炎软骨组织病理评分[14]。
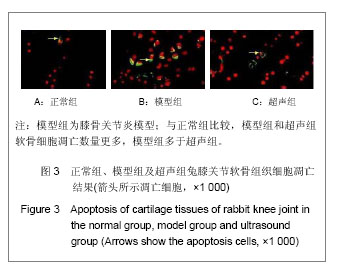
TUNEL法检测软骨细胞凋亡:软骨细胞的凋亡程度按照制造商的指示采用TUNEL法检测。切片标本干燥后入二甲苯中固定10 min,PBS清洗3次,5 min/次,浸入体积分数3%过氧化氢的PBS中5 min,取出后用PBS洗2次,5 min/次,用滤纸吸去载玻片上细胞周围的多余的液体, 浸入0.01 mol/L枸橼酸盐缓冲液(pH 6.0),微波炉加热至沸腾,后断电,间隔10 min,反复2次,冷却后PBS洗涤3次,5 min/次;滴加一抗50 μL /片,置湿盒中于37 ℃反应1 h;后用PBS洗3次,35 min/次,用滤纸吸去载玻片上细胞周围的多余的液体,滴加50 μL生物素化山羊抗小鼠IgG(二抗)37 ℃反应30 min;再用PBS清洗2次,5 min/次;光学显微镜观察下滴加联苯二胺(DAB),反应显色完全后用蒸馏水洗4次,2 min/次, 再于室温用甲基绿复染15 min,染后用流水漂洗,干燥后用二甲苯脱水透明,树胶封固。在荧光显微镜下在 (520±20) nm和620 nm,暗室内荧光显微镜在波长 520 nm波长620 nm条件下观察,迭加后,红色背景下的显示黄色\淡黄色\黄绿色\绿色的细胞即为凋亡的软骨细胞。利用图像处理软件Image-Pro 6.0得到细胞凋亡指数(AI)。
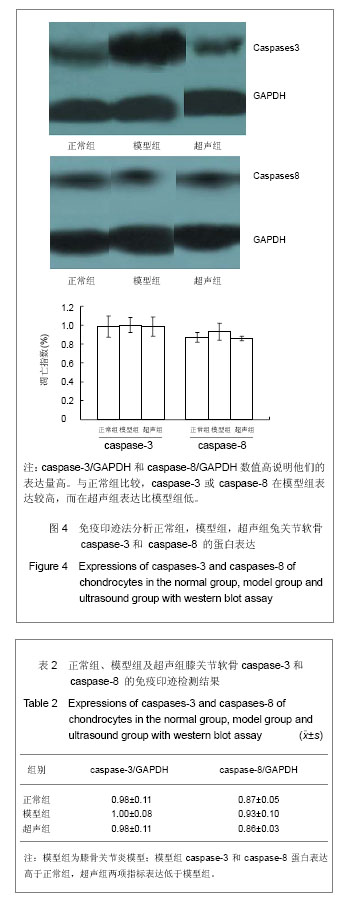
免疫印迹检测兔关节软骨caspase-3 and caspase-8 的蛋白表达:剪碎软骨组织并与裂解液以1∶5的体积比混合,冰上匀浆;将匀浆后的悬浊液4 ℃离心, 15 000 r/min 1 h,取上清;对所得上清液进行蛋白浓度测定;灌制12%的分离胶和4%的浓缩胶;将蛋白样品放入100 ℃的离子浴中5 min;按每泳道等量蛋白配置相应的上样体系;向各泳道中加入蛋白样品及分子量Marker;电泳条件:浓缩胶80 V 15 min,分离胶 120 V 55 min;剥胶,放入转印缓冲液中振荡15 min;取较凝胶稍大的转印膜,放入甲醇中振荡15 min后,与凝胶一同振荡;将滤纸用转印缓冲液润湿后,按阴极-滤纸-凝胶-膜-滤纸-阳极顺序组装,进行湿转,60 V 120 min;取出转印膜,TTBS洗5 min×2次,TBS洗 5 min×1次,用含有0.10 kTween-20的5%脱脂奶粉4 ℃封闭过夜;取出转印膜,TTBS洗5 min×2次,TBS洗 5 minx1次,1∶200倍稀释一抗并将稀释液与转印膜共同孵育,室温2 h;取出转印膜,TTBS洗5 min×2次,TBS洗5 min×1次,1∶5 000倍稀释二抗并将稀释液与转印膜共同孵育,室温2 h;取出转印膜,TTBS洗 5 min×2次,TBS洗5 minx1次,在暗室中进行ECL显色,依据转印膜的大小,分别取A液、B液相同滴数,混匀,加至转印膜上,发光2 min,用保鲜膜覆盖后,置入X暗盒内进行曝光3-5 min。一次性完成显影、定影。
RT-PCR检测:用TRIzol试剂提取各软骨组织中RNA。经2.5 g/L胰蛋白酶消化2 min,收集于离心管中,2 000 r/min离心5 min,pH 7.3的PBS洗涤、7 000 r/min离心10 min。每个离心管中加入TRIzol 液1 mL,室温下静置5 min。①分离:每个离心管中加入氯仿0.4 mL,混匀,室温下3 min。4 ℃ 10 000 r/min离心15 min。留取上层无色液相。②mRNA沉淀:将上层无色液相转入另一清洁离心管中,加入1 mL异丙醇,室温下10 min,在4 ℃ 10 000 r/min离心10 min,弃上清。③mRNA洗涤:每个离心管中加入体积分数75%乙醇4 mL,4 ℃ 7 500 r/min离心5 min。④mRNA溶解:空气中干燥 10 min,将mRNA溶解于DEPC水中,-20 ℃保存。mRNA浓度测定。⑤mRNA反转录(RT):使用QIAGEN反转录试剂盒(OmniscriptTM Reverse Transcriptase for cDNA synthesis)在冰浴的微量离心管中加入10×Buffer RT 2.0 μL、dNTP 2.0 μL、Oligo-dT引物2.0 μL、RNA酶抑制剂1.0 μL、反转录酶1.0 μL、DEPC水12 μL,共20 μL。置于ASTEC BI-525 恒温孵育器中37 ℃ 60 min,93 ℃5 min,立即4 ℃保存。⑥PCR 扩增:在微量离心管中加入DEPC水16 μL、10×缓冲液3 μL、dNTP 2 μL、25 mmol/L MgCl2 2.5 μL、引物各1 μL,cDNA 2 μL、Taq酶2.5 μL共30 μL。使用PERKIN ELMER 2400 PCR 扩增仪,94 ℃预变性10 min;94 ℃变性30 s、55 ℃退火1 min、72 ℃延伸2 min,共30个循环;72 ℃7 min,4 ℃保存。PCR 产物电泳:将PCR 产物在1.2%琼脂糖凝胶上电泳,样品加样量为10 μL,在1×TBE中100V电泳30 min,用天能凝胶图像处理仪紫外光下检测PCR扩增产物的长度,读取各条带灰度值并拍照。
引物序列及PCR产物长度:
.jpg)
主要观察指标:①兔关节软骨组织苏木精-伊红染色结果。②兔关节软骨组织软骨细胞凋亡结果。③兔关节软骨组织caspase-3和caspase-8的免疫印迹检测结果。④RT-PCR检测caspase-3及caspase-8结果。
统计学分析:使用统计软件SPSS 17.0分析,测量数据表示为x±s。正常组,模型组和超声组的评估用单因素方差分析,P < 0.05为差异有显著性意义。

.jpg)
.jpg)