20世纪60 年代起,国外学者对肌腱修复过程进行了研究,提出了外源性愈合学说:认为肌腱本身没有愈合能力,愈合过程是由成纤维细胞介导,在腱和腱周组织之间粘连形成的结果,粘连为肌腱提供了血管、营养和细胞所需要的胶原成分,只有在发生粘连的情况下肌腱才能愈合,所以肌腱的愈合和粘连是同时发生的,愈合和粘连是两个浑然一体的过程,肌腱损伤后愈合必然伴随粘连。直到20世纪80年代,以Lunberg为代表提出了内源性愈合机制
[8]。Lister
[9]在1990年从细胞分子水平证实:肌腱愈合是从腱周细胞增殖开始,沿损伤部位形成肌腱痂,然后肌腱内成纤维细胞和腱细胞长入肌腱痂,经过重排构成坚固的肌腱。这一愈合过程单纯靠滑液的营养即可完成,粘连完全可以避免,而近年来,Lundorg
[10]研究证实肌腱愈合过程中,既存在外源性愈合,又存在内源性愈合,但外源性愈合很难避免与周围组织发生粘连,从而影响肌腱功能恢复,所以,为了防止肌腱粘连的形成,应促进内源性愈合,抑制外源抑制性愈合。如何抑制外源性愈合,促进内源性愈合是成为解决肌腱粘连的关键。Lundborg
[10]原位组织培养及Manske等
[11]体外肌腱培养都证实肌腱细胞具有增生修复能力,肌腱愈合是通过腱内外细胞激活、分泌形成的;愈合不依赖粘连,故粘连可以避免。
实验就是根据上述观点,将体外构建的组织工程化肌腱移植于动物体内,以达到促进肌腱内源性愈合,尽量避免外源性愈合的发生。
3.1 种子细胞的研究 理想的组织工程学种子细胞应具备下列特点:①取材容易,对机体损伤小。②在体外培养中易定向分化为目标细胞和具有较强的传代繁殖力。③植入机体后能适应受区的环境并保持细胞活性。
3.1.1 骨髓间充质干细胞 骨髓间充质干细胞广泛存在于胎儿和成人的各种组织和脏器中。骨髓间充质干细胞易于分离培养,扩增能力强,具有多向分化潜能的细胞,在不同的诱导条件下,具有向3个胚层组织细胞分化的能力,被认为是最适宜应用于临床的构建组织工程的种子细胞之一。研究表明,骨髓间充质干细胞能表达多种表面抗原,Haynesworth等[12]对人骨髓间充质干细胞的表面抗原即CD分子检测结果显示为CD29,CD44,CD105,CD166阳性;Pittenger等[13]用流式细胞仪对培养的人骨髓间充质干细胞进行鉴定,发现骨髓间充质干细胞表面抗原CD14,CD31,CD34,CD45等造血系标志检测为阴性。本实验用流式细胞学检测结果显示无论是实验组(DMEM+骨形态发生蛋白12),还是对照组(DMEM),其CD44和CD29阳性标记均出现单峰,CD31和CD34表达阴性,与上述检测结果一致,证明所培养的骨髓间充质干细胞是均一的细胞群,不含造血细胞、内皮细胞等其他细胞。
实验将骨髓间充质干细胞定向诱导分化为肌腱细胞可解决肌腱组织工程的种子细胞来源不足的困境,因其可自体获取诱导后回植,既解决了免疫排斥反应的问题,又避免了胚胎干细胞研究所受到的伦理学冲击。
3.1.2 脐血间充质干细胞 近年来,脐血间充质干细胞作为一种间质细胞群,已被众多实验室成功分离。2000年Erices等首次报道了从脐带血中分离培养出间充质样细胞,并证实其免疫表型和功能特点与骨髓来源的间充质干细胞极为类似。研究还发现其细胞特性和多向分化潜能除了与骨髓间质干细胞相似外,其体外扩增能力、细胞原始性均高于骨髓。因其具有全能性和无限增殖能力,因此倍受国内外学者青睐。研究者已成功地将脐血干细胞细胞诱导分化为造血细胞、血管内皮细胞、神经细胞、肌肉细胞、脂肪细胞、软骨细胞、骨细胞等[14]。脐血受胎盘屏障的保护,其成分被病毒、细菌污染的概率低[15]。鉴于脐血间充质干细胞体外增殖力旺盛,诱导分化后仍然具有较强的免疫调节作用,它的这种较强的免疫抑制活性有着很好的临床应用前景,但其免疫调控作用的机制,目前尚不清楚,其是否与膜表面分子的相互作用或免疫抑制性细胞因子的分泌有关还需进一步证实[16]。脐血来源充足,免疫原性较弱,HLA不匹配或部分匹配的非相关脐血移植治疗恶性血液病已取得了成功,这就为脐血源性间充质干细胞的临床应用展现了更为广阔的前景。有理由相信,随着人类干细胞和组织工程研究的不断深入,伴随着世界各国脐血库的建立完善和成熟,脐血间充质干细胞将是一种潜在的、更好的成骨细胞来源。
3.1.3 皮肤成纤维细胞 皮肤作为人体最大的器官,成纤维细胞的来源与肌腱细胞相比分布广泛、取材容易。且其与肌腱细胞同属中胚层来源的细胞,并具有相似的生物学特性,均为梭形,均可以合成和分泌胶原蛋白、弹性蛋白、糖胺多糖和糖蛋白等,具备成为肌腱种子细胞的可能性。董志宁等[17]实验已证实,皮肤成纤维细胞能很好地贴附于支架材料生长。通过比较皮肤成纤维细胞和肌腱细胞构建的组织工程肌腱,观察到大体形态、组织学、胶原排列方向和生物力学特性均相似,有研究还通过不同浓度的人皮肤成纤维细胞接种于聚羟基乙酸材料上,测定出了较佳的细胞种植浓度范围,从而节约成本,减少取材。
3.2 诱导因子的研究 诱导因子是在细胞间传递信息,并对细胞生长具有调节功能的一些多肽类物质,它可以促进或者抑制细胞的增殖、分化、迁移和基因的表达。目前被尝试用于组织工程的诱导因子主要包括以下几种:
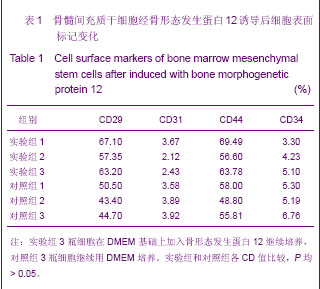
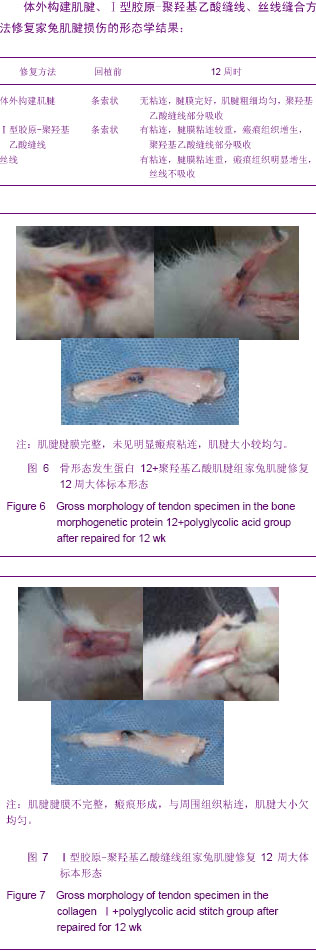
3.2.1 骨形态发生蛋白 骨形态发生蛋白被认为在胚胎形成过程中发挥着重要的作用,在运动系统,则促进骨、软骨及运动系统相关结缔组织的发生。最初因其具有诱导骨形成的作用而得名,它是机体的多肽生长因子之一,骨形态发生蛋白是一组分泌性、疏水性、酸性蛋白,其在体外也能诱导成骨细胞的分化。骨形态发生蛋白是一个庞大的家族,至少包括40个成员,各种骨形态发生蛋白的生物效应具有不同差异,Sellers等[18]在运用胶原海绵复合重组人骨形态发生蛋白2修复兔膝关节滑车全厚软骨缺损时发现,修复的软骨厚度可达正常软骨的70%,而且细胞的形态、结构以及与周围组织的连接均良好,近年来人们发现骨形态发生蛋白具有在体内、体外诱导间充质干细胞增殖分化成肌腱细胞的能力。1999年Lou等[19]报道骨形态发生蛋白12有诱导骨髓间充质干细胞成腱的作用,并可促进细胞的增殖与分化,使体外构建组织工程化肌腱成为可能。本实验中在干细胞传代至第2代时加入骨形态发生蛋白12后,细胞增殖明显加快,并向肌腱细胞分化,进一步证实了骨形态发生蛋白12可作为诱导干细胞向肌腱细胞分化生长的诱导因子。
3.2.2 转化生长因子β 转化生长因子β是一族具有多种功能的蛋白多肽,广泛存在于正常和新生组织中,在骨组织和血小板中含量最为丰富。不同种属间具有高度的同源性。1983年Robert 等在对大鼠成纤维细胞的研究中发现一种能引起细胞产生表型转化的多肽,定名为转化生长因子β。现已证实,转化生长因子β具有促进细胞增殖、调节细胞分化、促进细胞外基质合成作用,可以诱导间充质细胞向软骨细胞和肌腱细胞等分化[20]。
3.3 支架材料的研究 理想的组织工程支架材料通常应具有以下特点:①良好的生物相容性,不引起或少引起炎症和免疫排斥反应。②与肌腱恢复周期相适应的生物降解时间。通常肌腱愈合分为3个时期:术后1周左右是营养缺乏期,2-4周是修复期,4周以后是重建期,故所选材料的降解和性能损失时间控制在4周或稍长时间比较合适。其本身或可降解产物无毒性。③良好的组织结构相容性,具有一定的力学强度。④良好的表面积与体积比。⑤良好环境可让血管、神经长入。由于肌腱是一种特殊的组织,作为肌腱组织工程支架材料除具备以上共性外,还应有承受一定拉力等特性。目前,在肌腱组织工程中应用的支架材料大致分为两类:①人工合成高分子材料[21]。②天然细胞外间充质材料[22]。③复合材料。
3.3.1 人工合成高分子材料 人工合成高分子材料具有来源充足、易加工、生物降解速度、力学性能、超微结构、通透性可调等优点。目前在肌腱组织工程中应用较多的合成高分子是脂肪族聚酯类生物降解高分子,主要有聚羟基乙酸、聚乳酸、聚乳酸聚羟基乙酸[23-24],一般在30-60 d可被体内吸收,降解产物羟基乙酸是机体代谢的中间产物,对人体基本无危害。这些材料都已获了美国FDA的批准。作为支架材料,它们具有来源充足、易加工、降解速度可调等优点,然而此类材料存在亲水性低、细胞黏附能力差、组织相容性不理想等不足,细胞难以与材料发生稳定的相互作用,因而其应用受到很大限制[25]。
3.3.2 天然细胞外间充质材料 来源于自然界的天然高分子材料,如天然成分胶原纤维、采用藻酸盐类制成的胶体以及取自甲壳动物内的几丁质等,其具有天然可降解性,并能促进细胞生长,保留了组织正常的三维网架结构,一般都无毒、亲水、生物相容性及细胞亲和性好。曲彦隆等[26]通过实验证实,肌腱细胞种植于衍生肌腱支架材料后增殖速度、细胞功能等生物学行为均不受影响。周悦婷等[27]用同种异体肌腱细胞与生物衍生肌腱材料体外联合培养后回植入形态学、生理学和生化代谢等方面近似于人的猕猴体内,结果显示肌腱细胞成活并再生出肌腱样组织,在大体、组织学上与正常肌腱组织相似。但缺点是部分材料力学性能差、降解速度快、碎解后物质残留、具有抗原性致机体排异、难以加工塑形等不足等。
3.3.3 复合材料 实验中用胶原-聚羟基乙酸复合材料作为组织工程化肌腱的支架材料,是利用两种材料的优点进行互补,以扬长避短。鼠尾胶原是Ⅰ型胶原,作为组织工程化肌腱的支架材料它的显著优点在液态时接种细胞然后重构成凝胶态,使之与细胞结合成一整体而不会发生细胞流失。作者的实验结果(图10,11)表明,肌腱细胞可与Ⅰ型胶原重构凝胶态,并能继续增殖、分化。聚羟基乙酸是组织工程中常用的高分子生物可降解材料,在体内以水解方式降解,产生的中间代谢物羟基乙酸可参与体内代谢,终产物是二氧化碳和水,其半衰期约为2周。在实验中它在一定时间内可以抵抗拉力,使预构的组织工程化肌腱性能受一定的应力刺激,实验在体外构建肌腱时,在持续应力刺激下可使细胞沿应力方向重排,使肌腱修复更趋合理。将Ⅰ型胶原与聚羟基乙酸缝线相结合作为细胞载体支架,黏附能力明显增加,且细胞生长,功能活性无明显改变,表明胶原-聚羟基乙酸是良好的携带骨髓间充质干细胞的生物降解材料。
3.4 肌腱损伤修复的材料 目前常用于修复肌腱损伤的肌腱材料有自体肌腱、同种异体肌腱、人工肌腱及组织工程化肌腱,它们各有优缺点,要根据实际情况使用相应肌腱,以便最大程度发挥自身优点,克服自身缺点。
3.4.1 自体肌腱 它具有无排异反应、血供重建容易、不易变形、粘连轻、愈合快、塑形好和抗拉力强等优点,常用于重要肌腱重建或大段肌腱缺损等进行移植。自体肌腱移植疗效虽好,但可供肌腱来源有限,如切取过多会引起供区功能障碍,且延长了手术时间,所以限制了其临床应用。
3.4.2 同种异体肌腱 同种异体肌腱是临床应用最多的肌腱移植材料。目前,异体肌腱制备的方法可归为两大类:深低温处理肌腱和化学处理肌腱,前者以物理方法为主,国内外常用的异体肌腱为深低温冷冻和冻干肌腱。虽然同种异体肌腱通过严格的无菌操作,供体筛选(包括微生物学、血清学检测及病理组织检查)建立了提供商品化肌腱的组织库,但这并不能完全排除疾病传播(尤其是HIV感染)的可能,需进行二次灭菌。γ照射是常用灭菌方法,但采用多大剂量是一个有争议的问题。另外,同种异体肌腱还有爬行替代时间长、远期力学强度欠满意、不能很好地避免外源性愈合过程的发生等问题。
3.4.3 人工肌腱 人工肌腱研究历史悠久,材料多种多样,如尼龙、碳纤维、涤纶、聚酯纤维、头发等,但绝大部分因存在体内长期不能腱化、吸收、粘连、抗拉伸不足等缺点,只能作为暂时代用品,限制了其在临床上的应用。Richmond等[28]对855种合成材料韧带进行了长达15年的随访, 发现均未取得满意结果。
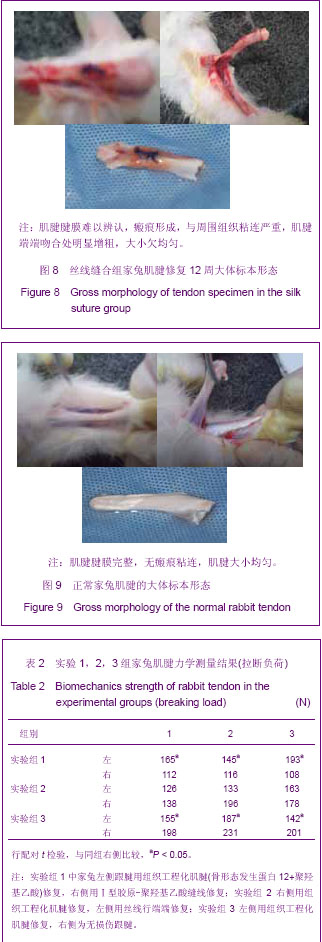
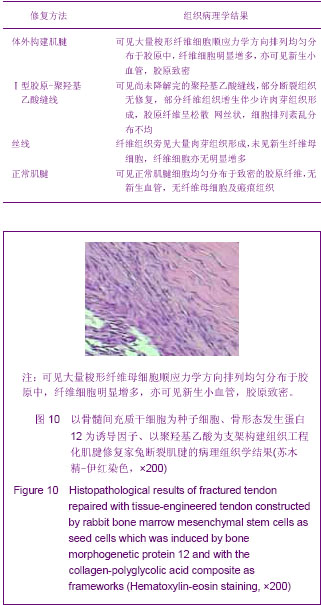
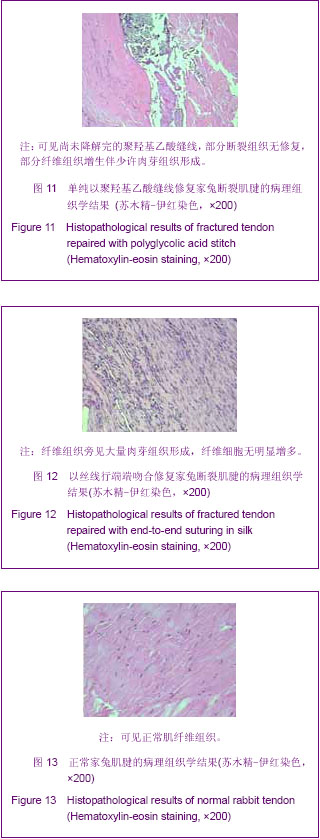
3.4.4 组织工程化肌腱 肌腱组织工程就是利用具有定向分化功能的种子细胞,将它与可降解的生物学材料结合,在体外及体内一系列细胞因子的作用下,逐渐形成正常的肌腱组织。组织工程化肌腱具有活力和功能,植入后肌腱细胞可在体内继续增殖、分化,不引起免疫排异反应,基本为内源性愈合,不引起粘连,可与受体肌腱很好愈合,永久性替换缺损肌腱;可根据缺损肌腱任意塑型,在重建功能的同时达到形态修复的目的。本实验结果显示,体外构建肌腱回植体内12周形态学观察肌腱无粘连,腱膜完好,肌腱粗细均匀,而Ⅰ型胶原-聚羟基乙酸缝线缝合者与丝线缝合者均有粘连,腱膜粘连较重,瘢痕组织增生明显,进一步证实了组织工程化肌腱修复肌腱过程主要为内源性愈合,其必将成为今后肌腱损伤修复的主要选材。
综上所述,理想的肌腱移植材料应具有以下特点:组织相容性好、移植排斥反应轻、生物力学性能强、能提供良好的“桥梁”作用、材料能被宿主吸收且被吸收过程与宿主细胞爬行替代过程同步。然而腱细胞的增殖较周围结缔组织缓慢,往往会被结缔组织部分替代,产生粘连,严重影响肌腱滑动及力学强度。组织工程技术的发展可以很好地解决这一难题。组织工程肌腱与传统肌腱修复法比较,其优势在于组织工程能在体外构建出有一定生物特性的肌腱样组织,不但解决了腱细胞的增殖较周围结缔组织缓慢,引起粘连的问题,还很好的解决大段缺损所需替代材料问题,从而使肌腱的损伤得到最大程度的修复。以骨髓间充质干细胞作为种子细胞、以骨形态发生蛋白12诱导成腱、以Ⅰ型胶原-聚羟基乙酸复合材料为支架,在体外构建组织工程化肌腱,回植体内以修复肌腱缺损,相对于传统技术具有其无法比拟的优点:这种方式不需要损失自身的其他肌腱和功能,只需要提取和分化用于扩增的种子细胞即可;形成的人工肌腱的外形是按照缺损的范围确定的,新的肌腱组织不丧失其自身的活力和功能,而且整条肌腱的功能可以在最大的程度上得到恢复——作者的实验结果证明,组织工程化肌腱在形态、力学强度及组织学等方面,均优于Ⅰ型胶原-聚羟基乙酸组,肌腱愈合后的粘连程度明显轻于丝线缝合组。另外,有学者认为,应力在促进肌腱细胞及其胶原纤维沿应力方向排列方面起了很大作用
[29]。应力可以刺激胶原的分泌、引导胶原和细胞的排列、促进肌腱修复,本实验在体外用U形弓的目的就是人为地制造一种静态下的持续牵张力,结合回植体内后家兔自身活动时产生的动态牵张力,最大程度刺激移植组织的细胞排列及修复。然而,Harris等
[30]指出,使用间充质干细胞修复试验白兔的肌腱时,部分会有异位骨形成,并表达出碱性磷酸酶活性,其机制并不是很清楚,证明该技术还有许多待于研究的内容。实验由于标本量小、检测时间短,未出现上述情况,有待以后进一步验证。随着肌腱组织工程理论和技术的不断发展及人们不懈努力的探索,肌腱组织工程技术一定会有更大的飞跃,其前景将会更加广阔。
.jpg)
.jpg)