中国组织工程研究 ›› 2013, Vol. 17 ›› Issue (18): 3283-3286.doi: 10.3969/j.issn.2095-4344.2013.18.008
• 心肺移植 heart-lung transplantation • 上一篇 下一篇
脑死亡供体肺病理改变及临床移植应用的可行性
农 江1,孙煦勇1,秦 科1,赖彦华1,聂 峰1,董建辉1,文海涛1,李壮江1,丁 祺2,杨建均2,何昌桓2
- 1解放军第三〇三医院移植医学研究院,广西壮族自治区南宁市 530021
2解放军第三〇三医院病理科,广西壮族自治区南宁市 530021
Pathological changes and clinical application standards of brain-death donor lung
Nong Jiang1, Sun Xu-yong1, Qin Ke1, Lai Yan-hua1, Nie Feng1, Dong Jian-hui1, Wen Hai-tao1, Li Zhuang-jiang1, Ding Qi2, Yang Jian-jun2, He Chang-huan2
- 1 Research Institute of Transplantation Medicine, 303th Hospital of PLA, Nanning 530021, Guangxi Zhuang Autonomous Region, China
2 Department of Pathology, 303th Hospital of PLA, Nanning 530021, Guangxi Zhuang Autonomous Region, China
摘要:
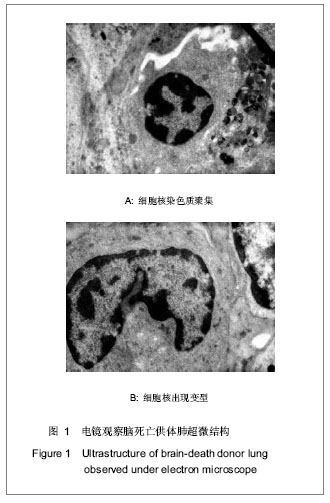
背景:有学者认为在脑死亡过程中很多因素可导致肺组织的改变。 目的:观察脑死亡供体肺病理改变,探讨其临床移植应用的可行性。 方法:对23例脑死亡供体肺进行了病理活检,苏木精-伊红染色、银染及PAS染色观察肺脏组织变化,电镜观察肺脏超微结构变化。 结果与结论:苏木精-伊红、银染及PAS染色光镜下见支气管及肺泡结构尚完整,局部病灶见肺泡内皮细胞水肿、坏死、脱落,肺泡间隔未见明显增宽,但充血易见,血管周围有少量出血,有散在淋巴细胞;电镜下脑死亡的肺泡细胞轻微水肿,部分细胞胞核染色质沿皱缩的核膜下凝聚,有的细胞核出现变型,细胞线粒体肿胀,但未见明显坏死。说明脑死亡供肺可以实施临床移植。
中图分类号: