急性脊髓损伤所引起的神经损伤常常可导致患者生理和心理的改变
[5] ,这种神经损伤一般由2部分叠加而成,即原发性损伤和继发性损伤[6]。原发损伤是由于创伤所直接造成的机械性组织损伤;继发损伤是通过由细胞和分子途径介导的生化反应对组织造成损害
[7] 。原发损伤和继发损伤均可造成神经元细胞和支持细胞的死亡。细胞的死亡一般通过2种形式的途径:坏死和凋亡。细胞的坏死一般发生于机械性的细胞损伤;而细胞的凋亡一般被认为是细胞在某种特定刺激和诱导从而产生的生理性或程序性死亡
[8] 。然而,在继发性损伤中细胞的凋亡扮演着重要角色。创伤虽然对脊髓造成的即刻的物理性损伤,然而随之而来的继发性损伤通常会持续数天或是数月。
创伤性损伤对脊髓的伤害会引起神经元细胞和神经胶质细胞的坏死和凋亡。Li等
[9]发现在脊髓受压后的4-9 d,凋亡细胞逐渐跨越分布于脊髓的多个节段。Yong等
[10]发现当大鼠的脊髓发生严重的挫伤时,可出现迟发性的脊髓神经细胞凋亡(其中包括神经元细胞,星形细胞,少突胶质细胞,小神经胶质细胞)。因此,由于继发性损伤所导致的细胞凋亡在脊髓损伤后导致的行为障碍中起到了重要作用。以上研究结果表明神经细胞凋亡是脊髓损伤继发损伤期的重要病理改变,而且凋亡细胞可以出现在远离损伤中心的其他部位。
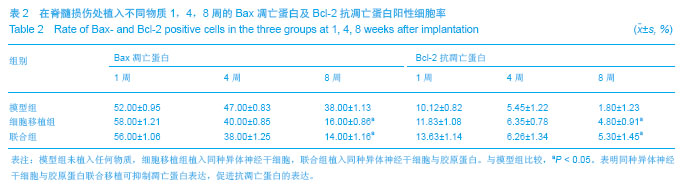
细胞凋亡发生的原因和途径是复杂多样的,许多基因参与细胞凋亡的基因调控,包括致死基因和存活基因。其中bcl-2家族成员在细胞凋亡的基因调控过程中起着至关重要的作用,bcl-2家族可以分为两类:一类是抗细胞凋亡基因,代表基因是bcl-2基因;另一类是促细胞凋亡基因,代表基因是bax基因,他们通过激活一系列下游基因发挥调节凋亡作用。实验中神经干细胞移植治疗4,8周后,细胞移植组Bax蛋白表达明显高于联合组,而Bcl-2则相反,说明神经干细胞联合胶原移植能够促进抗凋亡蛋白表达增加而使促凋亡蛋白相应减少,提示胶原可能更有利于神经细胞的存活,其作用机制可能与Bax和Bcl-2蛋白水平有一定相关性。Bax和Bcl-2是一对作用相反的凋亡调控蛋白,在病理条件下Bax上调加速细胞凋亡,而Bcl-2上调则促进细胞的存活。Bax与Bcl-2的比值常常决定了细胞在受到凋亡刺激时的生存或死亡。Bcl-2可以和Bax等结合形成异构二聚体抑制细胞凋亡,Bax表达水平增加可拮抗Bcl-2的作用并促进细胞凋亡
[11] 。Bcl-2抑制凋亡、保护细胞是通过与Bax形成异源二聚体、阻止Bax的释放来实现的
[12] 。而在实验中神经干细胞联合胶原移植的脊髓损伤大鼠的脑组织Bax也明显下调,这为神经干细胞联合胶原蛋白支架移植治疗脊髓损伤,通过调节细胞凋亡蛋白的表达,进而保护神经细胞提供了重要实验资料。
大脑运动皮质的前部投射到脊髓颈部控制前肢,大脑运动皮质的后部投射到脊髓腰部控制后肢。在实验中当损伤了大鼠的T9平面脊髓后,大鼠表现出后肢运动障碍。因此,作者选择运动皮质后部来检测该区域神经细胞凋亡情况。 实验发现,在脊髓损伤的大鼠中其大脑运动皮质后部出现了凋亡细胞。这也再次证明,在脊髓损伤的模型中凋亡细胞可出现在远离受伤中心的区域。Katoh等
[13]也有过类似报道,脊髓损伤后3 d在受伤部位的相邻2个节段发现了细胞凋亡。Crowe等
[14]报道,在上胸椎损伤的猴子体内发现,C
5水平的脊髓后索和 C
6水平的脊髓小脑束均有凋亡细胞出现。Hains等
[15]报道,脊髓横断损伤后1周,在运动皮质锥体细胞层发现了凋亡细胞,但一旦时间超过2周,就看不到凋亡细胞了。在实验中脊髓损伤后,凋亡细胞在运动皮质中的出现也有类似双相性。Kato等
[16]报道,出现在脊髓背侧角的凋亡细胞只有在伤后一二天才能被观察到。Crowe
[12]认为,脊髓损伤后的6 h至3周都可在脊髓内发现凋亡细胞。Mattson等
[17]认为,脊髓受伤后神经细胞的凋亡在8 h后到达峰值,随后逐渐降低。同时,他们还发现,神经胶质细胞的凋亡也存在双相性的改变,他们在伤后4 h出现,24 h达到峰值,然后在伤后第7天出现第二个凋亡峰值。根据Hains等
[15]的研究认为,虽然运动神经元细胞的凋亡和神经胶质细胞的凋亡之间是否存在什么联系目前尚不清楚,但皮质脊髓束细胞的凋亡可能会对脊髓内少突神经胶质细胞的死亡起到一定作用。
实验结果显示,脊髓损伤后大脑运动皮质神经元出现凋亡,可能在一定程度上限制了肢体功能的恢复。虽然,目对于大脑皮质神经元凋亡究竟在脊髓损伤后扮演着什么角色,以及脊髓损伤后大脑皮质神经元的病理变化的机制尚不清楚。但由于对脊髓损伤后大脑皮质神经元凋亡的认识,不难想到设法阻止大脑皮质神经元发生凋亡可能是促进脊髓损伤患者功能恢复的一种有效方法。
实验就是希望通过在脊髓损伤处植入神经干细胞来研究神经干细胞移植是否能够改善大鼠大脑皮质神经元凋亡的情况。目前对于神经干细胞的特性及它对脊髓损伤的治疗作用已经有了大量研究。神经干细胞是一种存在于中枢神经系统内的,能够分化为神经元、星形胶质细胞、少突胶质细胞的原始母细胞。2000年Gage
[18]概括神经干细胞的特性为:①可生成神经组织或来源于神经系统。②具有自我更新能力。③具有迁移能力,能到达损伤部位并产生新的神经细胞。④通过不对称分裂产生除自身以外的其他细胞。
神经干细胞对于大脑皮质细胞凋亡的影响可能是通过产生神经营养因子来实现的。神经营养因子是神经系统中重要的调节蛋白,可调节神经元的存活、轴突生长、突触可塑性和神经递质的产生。体外实验表明,神经干细胞能分泌脑源性神经营养因子、神经生长因子、血管内皮生长因子、肝细胞生长因子和白细胞介素等营养因子
[19] 。Kamei等
[20]将神经干细胞移植到脊髓损伤大鼠体内,通过免疫组化等手段发现神经干细胞可分泌BDNF、NT-3、NGF等神经营养因子并促进皮质脊髓束轴突的生长。张国庆等
[21]认为,BDNF基因修饰神经干细胞可在损伤脊髓中有效表达,促进脊髓损伤后Bcl-2的高表达,同时抑制Bax的表达,从而降低细胞的凋亡率,抑制神经细胞的凋亡。Isele等
[22]认为神经干细胞分泌的神经保护因子,如脑源性神经营养因子,神经生长因子和血管内皮生长因子等,可通过激活PI3K/Akt 和MAPK/Erk1,2t信号系统抑制细胞凋亡,从而保护神经元细胞。实验发现神经干细胞移植能显著减少大脑皮质神经元细胞的凋亡,进一步证实了以上观点。
综上所述,脊髓损伤后大脑皮质细胞的改变已开始被人们所认识,这些变化可能会影响到轴突的再生和功能恢复,这些变化及其机制有待进一步研究。将脊髓损伤后大脑皮质的变化与现有对脊髓局部变化的研究结果进行整合,是对脊髓损伤相关研究的补充和完善,另外对于全面反映脊髓损伤后的神经系统的基本状态,以及探讨脊髓损伤新的诊疗策略有着相当重要的意义。
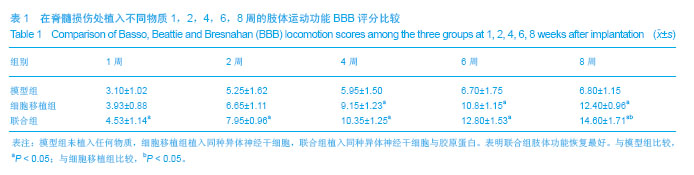
结论:神经干细胞联合胶原蛋白支架移植可抑制脊髓损伤后大脑神经细胞的凋亡,促进脊髓神经功能的恢复。

.jpg)