2.1 转化生长因子β/Smad信号通路 雌激素和转化生长因子β是骨骼系统的非常重要的两种调控因子,目前已有许多报道阐明二者之间的信号通路
[6-7]。雌激素可通过多种途径影响转化生长因子β信号通路的活性,继而通过转化生长因子β信号通路中的多个组成成分影响Runx2的表达和活性。首先,很多研究在成骨细胞和非成骨细胞
[8-9],比如人前列腺基质细胞, 大鼠骨细胞等,证明雌激素可诱导转化生长因子β基因表达而激活转化生长因子β信号通路。
转化生长因子β信号系统主要通过Smads和转化生长因子β诱导早期基因(TIEG)影响Runx2的表达和活性。Smads家族蛋白在将转化生长因子β信号从细胞表面受体传导至细胞核的过程中起到关键性作用,且不同的Smad介导不同的转化生长因子β家族成员的信号转导,如Smad2/3可以与Runx2形成异质二聚体,从而介导雌激素和Runx2之间的作用
[9]。转化生长因子β诱导早期基因(TIEG)属于KLF家族,通过其锌指结构与DNA结合从而影响基因的表达。如图1:转化生长因子β与其受体结合后,激活转化生长因子β信号通路,引起Smad2和Smad3结合形成二聚体,此二聚体与Smad4结合形成的复合物进入核内作用于TIEG基因,上调TIEG的表达。在人和鼠成骨细胞中TIEG不但可直接诱导Runx2的表达,而且可与Runx2结合而刺激依赖Runx2的基因的表达
[9]。在这个通路中,Runx2与Smad结合形成的异二聚体还可以反过来下调Runx2的表达。Runx2与雌激素受体结合形成的异二聚体可以增强转化生长因子β/Smad信号通路的活性。
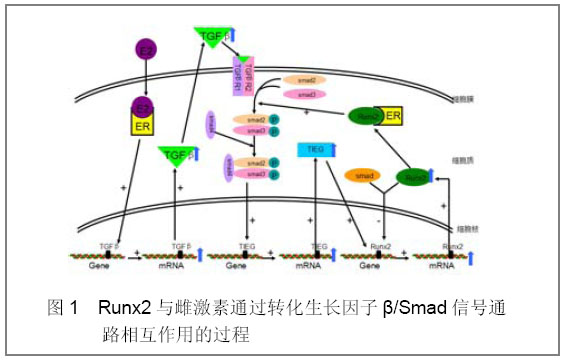
图1 Runx2与雌激素通过转化生长因子β/Smad信号通路相互作用的过程
2.2 Wnt/β-连锁蛋白信号通路 Wnt信号通路是骨骼系统发育、成熟、重构的一个重要信号系统,可以引起胞内β-连锁蛋白的积累。Chandar等
[10]发现雌激素作用于ROS17/2.8细胞可显著上调由Wnt通路介导的β-连锁蛋白和碱性磷酸酶,而雌激素受体调节剂ICI 182780和三苯氧胺及雌激素受体α敲除可终止上述现象
[11]。这说明Wnt/β-连锁蛋白信号通路参与雌激素对成骨细胞的调控。
Gaur 等[12]认为Wnt/β-连锁蛋白信号通路通过激活Runt基因表达从而调控成骨细胞分化和骨骼发育,其理论基于以下实验:①敲除分泌型卷曲相关蛋白1(SFRP1)的大鼠表达激活的Wnt信号通路,其T细胞因子1、Runt2及骨钙素的表达显著增加。②Runx2启动子(-97-93)存在功能性T 细胞因子调控元件。③Runt基因募集β-连锁蛋白和T细胞因子1。④T细胞因子1和经典Wnt蛋白的共表达可以使Runt启动子活性显著提高,并且其mRNA水平显著增加。通过对FABP4-Wnt10b鼠的研究发现Wnt10b可促进间质细胞向成骨细胞转化,抑制其向脂肪细胞转化,其机制之一是Wnt10b可诱导Runx2的表达而抑制PPAR-γ2的表达
[13]。也有研究发现Wnts尽管可以增加依赖Runx2基因的表达,但是不能增加核内Runx2的蛋白水平,也不能促进Runx2与DNA的结合
[14]。这说明Wnts可能影响Runx2与其他转录因子的相互作用。如图2:Wnt信号通过细胞表面7次跨膜受体Frizzled家族成员激活胞质Dishevelled(Dsh)蛋白,从而抑制由GSK3、Axin、APC和β-连锁蛋白组成的蛋白复合物的活性,使β-连锁蛋白免于磷酸化而不被降解,导致β-连锁蛋白在胞内积聚并易位到核内与转录因子T细胞因子家族成员结合,促进Runx2表达。
Runx2也可通过上调TβRI的表达而作用于转化生长因子β信号通路,继而增强Wnt信号系统的活性。另外,Runx2还可直接调节Wnt的基因表达。在成骨细胞分化早期,前列腺素E2诱导的Runx2的活化可增强依赖Wnt的基因表达,当抑制内源性Runx2表达时Wnt基因的表达也受到显著抑制,如图2[
14]。因此,Wnt极有可能是Runx2作用于雌激素介导的生物效应的重要靶点之一。
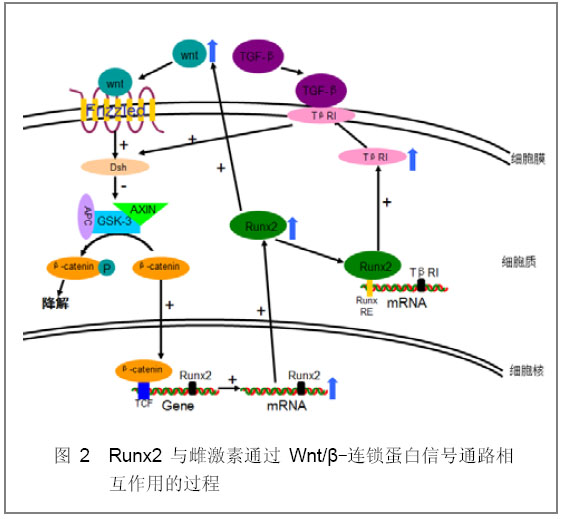
图2 Runx2与雌激素通过Wnt/β-连锁蛋白信号通路相互作用的过程
2.3 Fas/FasL信号通路 雌激素通过抑制Fas/FasL信号通路而促进Runx2表达。Kovacic
[15]通过实验证明,人和鼠的成骨细胞表达Fas,并且随着成骨细胞的进一步分化Fas表达量增加。该研究同时证明了Fas/FasL能抑制成骨细胞的分化,但是对其凋亡影响甚微,因为FasL能降低成骨细胞的比例但是不能影响总细胞的数目,进一步实验发现FasL可以通过caspase8的激活而减少Runx2基因的表达,而在不表达Fas或者FasL的鼠骨髓细胞中Runx2基因以及依赖Runx的碱性磷酸酶、骨钙素、骨桥蛋白等的表达量显著上升
[15]。如图3:配体FasL与死亡受体Fas结合后,诱导Fas胞质区内的死亡结构域DD结合Fas结合蛋白FADD,FADD再以其氨基端的死亡效应结构域结合caspase-8前体,形成Fas-FADD- caspase-8前体组成的死亡诱导复合物DISC,DISC激活caspase-8,活化的caspase-8减少Runx2基因的表达。
雌激素可减少Fas的表达并一定程度上降低Fas对成骨细胞分化的抑制作用
[16]。Kovacic等
[16]还发现与假手术组相比,行卵巢切除术的C57BL/6J鼠成骨细胞的Fas基因表达量明显上升;而敲除Fas基因后,雌激素缺乏不能引起骨质疏松症。Krum等
[17]研究FasL基因发现其下游86kb处为细胞类型特异性的激素诱导增强子,可作为雌激素受体α的作用靶点,介导Fas信号系统与雌激素的相互作用。因此,Fas信号通路可能参与雌激素介导的对成骨细胞分化的作用。
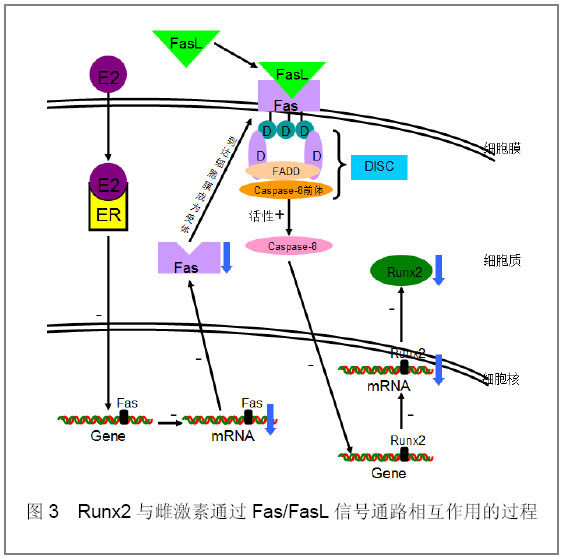
图3 Runx2与雌激素通过Fas/FasL信号通路相互作用的过程
2.4 核因子κB信号通路 雌激素也能通过抑制核因子κB信号通路而促进Runx2表达。在哺乳动物中迄今发现5种核因子kB家族成员:RelA(p65)、RelB、c-Rel、核因子kB1(p50)、核因子kB2(p52)。它们以同源或异源二聚体形式存在,最常见的二聚体是p50-p65异二聚体,也就是常说的核因子kB。在骨骼系统中核因子κB信号通路和雌激素发挥着相反的调节作用。雌激素可以通过抑制核因子κB配体激活因子(RANKL)而防止乙醇诱导的骨质丢失
[18]。因卵巢切除导致的骨质减少在Bglap2-IKK-DN鼠(表达无功能IKKγ等位基因产物)中得到明显改善,说明核因子κB的激活破坏了成骨细胞骨形成
[19]。核因子κB可促进多种细胞因子的合成,这些细胞因子在成骨细胞分化和骨形成中发挥重要的功能。
绝经期雌激素水平的降低伴随着血清白细胞介素1,白细胞介素6,白细胞介素7和肿瘤坏死因子的升高
[19]。如图4:当细胞受到炎症因子如肿瘤坏死因子α等刺激时,肿瘤坏死因子α与其受体结合,激活胞浆中IKKs(IkB激酶),使无活性的核因子kB三聚体复合物种的IkB的N端调节区的Ser32/36磷酸化,随后发生泛素化,在蛋白酶体作用下降解,IkB的解离暴露出p50亚基的DNA结合位点,使p50-p65异二聚体从细胞浆易位至细胞核内,与kB序列结合,促进白细胞介素1,白细胞介素6,白细胞介素7和肿瘤坏死因子的基因合成。有研究发现肿瘤坏死因子可通过下调Runx2的表达而抑制细胞分化
[20]。白细胞介素6可抑制骨吸收
[21]。白细胞介素7不但可抑制骨吸收还可以通过抑制Runx2基因启动子的活性而下调Runx2表达从而抑制骨形成
[22]。
Krum[19]假设了雌激素影响核因子κB信号通路的4个机制,包括雌激素受体α与核因子κB结合影响核因子κB的功能;雌激素受体α调节IKK和IκB的活性;雌激素受体α使辅激活蛋白远离核因子κB;雌激素受体α可阻止IκB降解从而抑制核因子κB激活。除此之外,雌激素受体α可直接与肿瘤坏死因子启动子结合而影响肿瘤坏死因子的表达。
2.5 其他 雌激素和Runx2的相互作用还通过许多其他信号通路而实现,如:Runx2增强固醇/类固醇激素代谢相关的酶的基因表达活性而促进雌激素合成;
Runx2通过与雌激素受体α基因的F启动子结合剂量依赖性影响雌激素受体α基因的表达;前列腺素 E2通过调控视网膜母细胞瘤结合蛋白1来上调Runx2的表达和活性等等,这些分子机制有待于进一步研究。
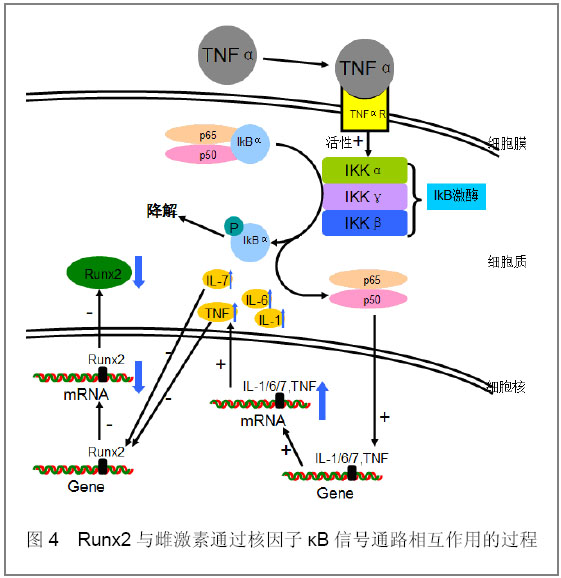
图4 Runx2与雌激素通过核因子κB信号通路相互作用的过程



