1.1 设计 体内动物实验,体外卵母细胞实验。
1.2 时间及地点 实验于2020年12月至2023年12月在广西中医药大学广西中医基础研究重点实验室完成。
1.3 材料
1.3.1 实验动物 随机选取21 d龄SPF级健康雌性昆明小鼠,体质量(18±2) g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2019-0004。小鼠饲养于广西中医药大学动物实验室,许可证号:SYXK (桂)2019-0001,室温(24±2) ℃,相对湿度40%-60%,保持12 h光照、12 h黑暗的人工光照周期,小鼠自由进食进水。实验方案经广西中医药大学伦理委员会审核,批准编号为DW20230830-186,实验过程遵循了国际兽医学编辑协会《关于动物伦理与福利的作者指南共识》和本地及国家法规,实验动物在麻醉下进行所有的手术,并尽一切努力最大限度地减少其疼痛、痛苦和死亡。
1.3.2 药物 达英-35(拜耳医药保健有限公司,货号:249A2);硫酸脱氢表雄酮(Solarbiol,货号:53-43-0)。班氏促卵助孕汤免煎颗粒(菟丝子20 g,党参20 g,黄芪20 g,熟地20 g,紫石英15 g,当归10 g,枸杞子10 g,覆盆子10 g,鹿角霜10 g,龟甲胶10 g,杜仲10 g,巴戟天10 g,炙甘草6 g)由广西中医药大学第一附属医院仙葫分院提供,每剂约75 g(一剂2袋,每袋37-38 g)。由此,70 kg成人的颗粒剂用药剂量为1.1 g/kg(折合饮片等效剂量为2.4 g/kg),优化后饮片等效剂量为20 g/kg(原为21.8 g/kg),换算出优化后小鼠的颗粒剂等效剂量为9.2 g/kg。将灌胃剂量设置为20 mL/kg,那么低、中、高剂量对应的颗粒剂浓度为0.23,0.46,0.92 g/mL,分别将4.6,9.2,18.4 g免煎颗粒溶于20 mL纯水,存放于4 ℃冰箱,每次使用前通过超声、涡旋、水浴加热37 ℃的方式使颗粒剂充分溶解,通过灌胃的方式对PCOS模型小鼠进行治疗。
1.3.3 试剂 睾酮、雌二醇、促卵泡生成素、促黄体生成素ELISA试剂盒(基因美,货号分别为:JYM0373Mo、JYM0379Mo、JYM0417Mo、JYM0341Mo);Annexin-V/PI凋亡检测试剂盒(Solarbio,货号:CA1020);DCFH-DA活性氧荧光探针试剂盒(Solarbio,货号:D6470);抗生长分化因子9抗体(Solarbio,货号:K003473,稀释度:1∶1 000);抗骨形态发生蛋白15抗体(Solarbio,货号:K005172P,稀释度:1∶1 000);抗GAPDH抗体(Solarbio,货号:K110496P,稀释度:1∶5 000);抗α-tubulin抗体(Bios,货号:bs-0159R,稀释度:1∶200);山羊抗兔IgG(H&L)(Alexa Fluor®488)(Abcam,货号:ab150077,稀释度:1∶200);DAPI(Beyotime,货号:C1002);M2培养液(Sigma,货号:Slcf4312);M16培养液(Sigma,货号:Slcf4236);孕马血清促性腺激素(宁波第二激素厂,货号:YP-105);人绒毛膜促性腺激素(宁波第二激素厂,货号:P1016-13);Trizol regent(Invitrogen,货号:15596018);primeScript™ RT Master Mix (perfect Real Time)(Takara,货号:RR036A);TB Green™ premix Ex Taq™ Ⅱ (Tli RNaseH plus) (Takara,货号:RR820A)。
1.3.4 仪器 多功能酶标仪(MD,型号:FilterMax F3);二氧化碳培养箱(新加坡ESCO,型号:CLM-170B-8-NF);台式恒温培养振荡器摇床(上海智诚,型号:ZWYR-2102C);组织切片机(上海莱卡,型号:2235);凝胶成像系统(上海天能,型号:Tanon 5200);倒置荧光相差显微镜(含图像处理系统)(尼康,型号:Ts2-FL);超微量核酸检测仪(遂真,型号:FC-1100);Veriti™ 96-Well Thermal Cycler(Applied Biosystems®,型号:4375786);实时荧光定量PCR系统(Agilent,型号:AiraMx)。
1.4 实验方法
1.4.1 动物建模、分组及给药 参考MOTTA[12]的建模方式,将21 d龄的昆明小鼠随机分成对照小鼠(n=32)和模型小鼠(n=186),模型小鼠经颈部皮下注射硫酸脱氢表雄酮(60 mg/kg,溶于含10%的体积分数95%乙醇的芝麻油),1次/d,连续注射21 d,以建立PCOS小鼠模型,对照小鼠只注射等体积的溶剂。建模成功指标为卵巢多囊样改变、高雄激素水平和(或)动情周期紊乱,最终体现为生殖障碍,窝产仔数下降[13]。明确建模成功之后,将模型小鼠随机分成5组:模型组45只、达英-35组32只、CLZYD低剂量组39只、CLZYD中剂量组35只、CLZYD高剂量组35只。参照《药理实验方法学》中“人和动物按体表面积折算的等效剂量比值”[14],小鼠的等效剂量相当于人的9.1倍,设置CLZYD中剂量组的给药量对应人的服药量,CLZYD低、中、高剂量组的给药剂量比值为1∶2∶4。一剂班氏促卵助孕汤共含171 g饮片,70 kg的成人日服用171 g中药饮片,即人的用药剂量为2.4 g/kg,对应小鼠的等效剂量为21.8 g/kg。结合课题组前期实验结果,优化了小鼠的给药剂量,设置CLZYD中剂量组的给药量为20 g/kg,即CLZYD低、中、高剂量组分别灌胃给予班氏促卵助孕汤 10,20,40 g/kg,对照组与模型组灌胃等量纯水,达英-35组灌胃0.3 mg/kg达英-35,灌胃体积为20 mL/kg,1次/d,连续灌胃21 d,取小鼠卵巢、血清、卵母细胞进行后续实验。
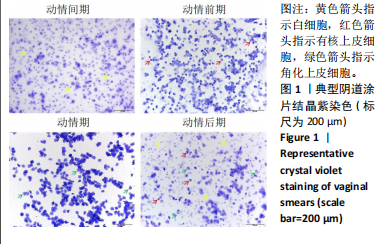
1.4.2 阴道涂片检测动情周期 使用棉签法收集所有小鼠阴道脱落细胞,均匀涂于载玻片,风干后于无水乙醇固定10 min,0.1%结晶紫溶液染色1 min,于纯水中水洗1 min,再用干净纯水冲洗5 s,自然风干,显微镜观察,根据细胞形态及比例判断小鼠动情周期。
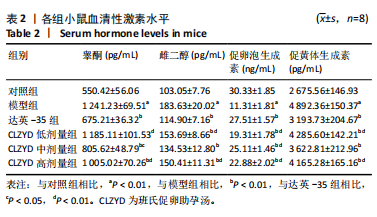
1.4.3 ELISA检测血清性激素水平 每组8只小鼠禁食12 h,使用25%乌拉坦进行麻醉,麻醉后行摘眼球取血,血液样本于37 ℃恒温生化培养箱静置两三个小时,2 800 r/min离心10 min,收集血清,-80 ℃保存。严格按照睾酮、雌二醇、促卵泡生成素、促黄体生成素 ELISA检测试剂盒说明书检测血清性激素水平。
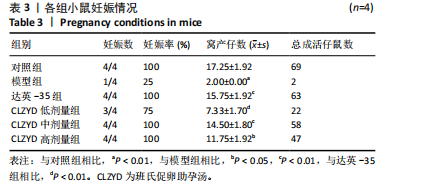
1.4.4 交配及记录妊娠情况 每组4只小鼠腹腔注射10 IU孕马血清促性腺激素,48 h后腹腔注射10 IU人绒毛膜促性腺激素,14-18 h后与育龄昆明雄鼠按照1∶1的比例合笼交配,次日9时检测是否存在阴栓,如出现阴栓则记录为受精0.5 d。小鼠自然分娩,记录妊娠率及窝产仔数。
1.4.5 小鼠生发泡期卵母细胞的提取与培养 余下小鼠(对照组20只,模型组33只、达英-35组20只、CLZYD低剂量组27只、CLZYD中剂量组23只、CLZYD高剂量组23只)腹腔注射10 IU孕马血清促性腺激素48 h后处死,无菌操作取出两侧卵巢。体式显微镜下,用1 mL一次性注射器从生发泡期卵泡中释放卵母细胞,用口吸管拾取卵母细胞,移入覆盖石蜡油的M16培养基中,在37.5 ℃、体积分数5% CO2条件下培养12 h,即刻进行后续检测。
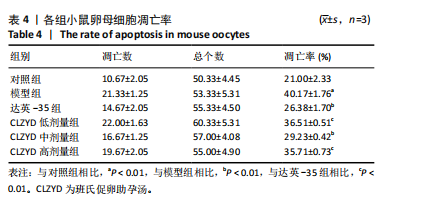
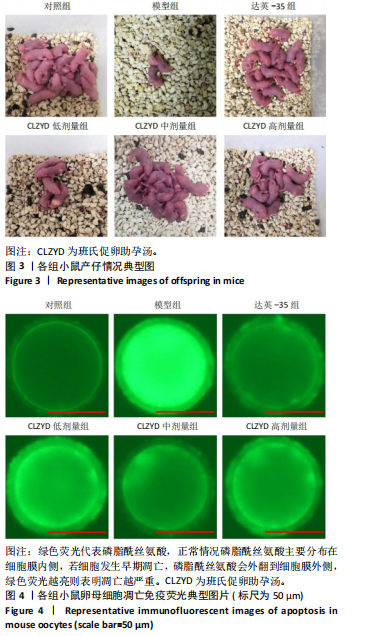
1.4.6 Annexin V免疫荧光染色检测卵母细胞凋亡率 小鼠卵母细胞在Annexin V-FITC工作液中室温避光染色10 min,用含有0.1%聚乙烯醇的PBS洗3次。在荧光显微镜下根据卵母细胞荧光强度及分布观察早期凋亡情况,计算细胞凋亡率。
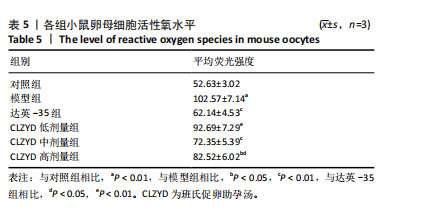
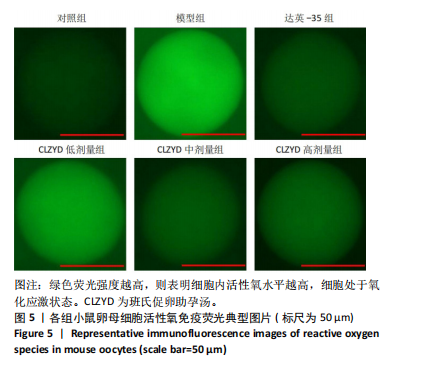
1.4.7 DCFH-DA荧光探针检测卵母细胞内活性氧水平 卵母细胞在DCFH-DA工作液(终浓度为10 μmol/L)中,于37.5 ℃、体积分数5% CO2条件下孵育30 min,用M16培养基洗3次,使用荧光显微镜观察,使用Image J软件分析平均荧光强度。
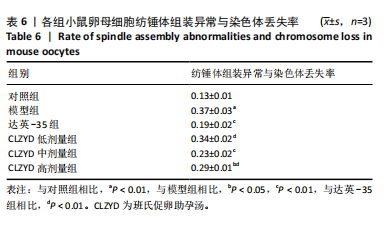
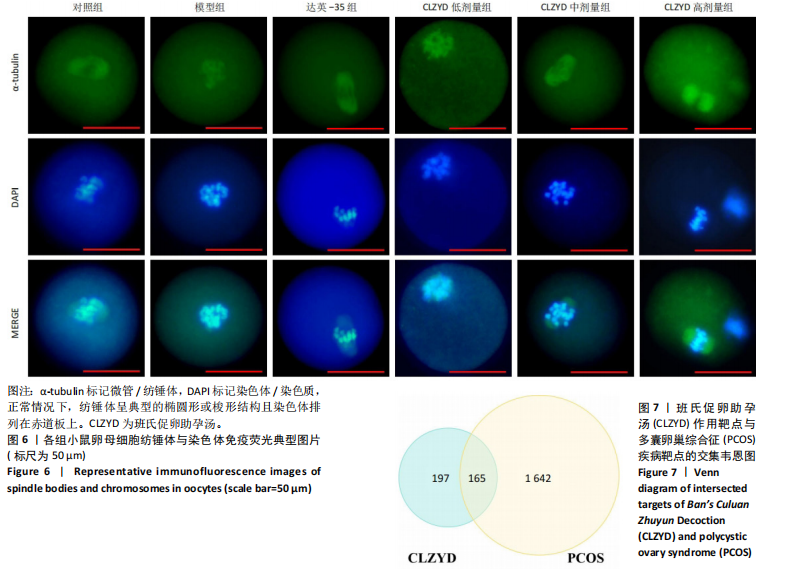
1.4.8 免疫荧光法观察卵母细胞纺锤体及染色体情况 卵母细胞室温固定30 min,0.5% Triton X-100通透30 min,1%牛血清白蛋白封闭1 h,抗α-tubulin抗体4 ℃孵育过夜,二抗室温孵育1 h,最后装载于含有DAPI的抗淬灭载玻片。使用α-tubulin标记微管/纺锤体,DAPI标记染色体/染色质,荧光显微镜观察,判断纺锤体是否异常、染色体是否缺失,计算纺锤体组装异常与染色体丢失率。
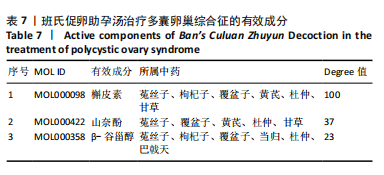
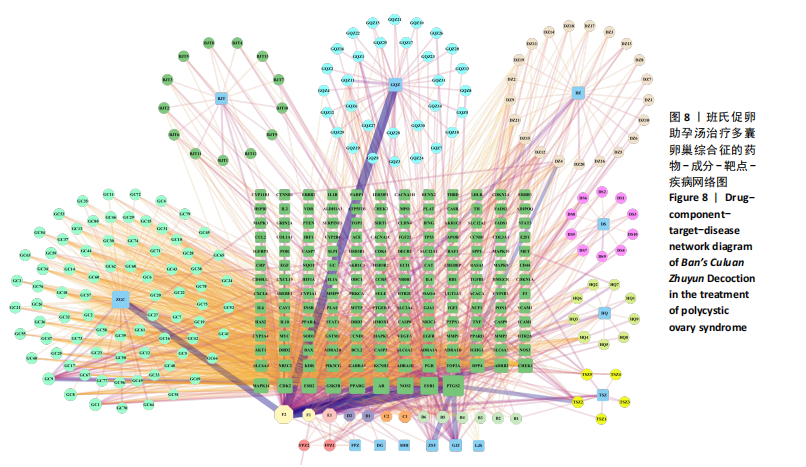
1.4.9 药物-成分-靶点-疾病网络的构建 在中药系统药理学数据库与分析平台TCMSP(https://old.tcmsp-e.com/tcmsp.php/)检索班氏促卵助孕汤中药的有效成分及作用靶点,限定口服生物利用度(oral bioavailability,OB)≥30%及类药性(drug-likeness,DL)≥0.18。在Gene Cards数据库(https://www.genecards.org/)、疾病基因网络数据库DisGeNET(https://www.disgenet.org/)、通用蛋白质知识库UniProt(https://www.uniprot.org/)、Drugbank数据库(https://go.drugbank.com/)检索关键词“polycystic ovary
syndrome”,将PCOS的疾病靶点结果分别导出、汇总。构建药物作用靶点与疾病靶点交互网络,获取班氏促卵助孕汤有效成分治疗PCOS的潜在作用靶点,并绘制韦恩图。将上述筛选得到的药物成分、药物作用靶点、疾病靶点等信息导入Cytoscape 3.10.1软件,构建药物-成分-靶点-疾病网络,采用Analyze network插件进行分析,基于Degree值和Edge Betweenness值生成可视化结果。
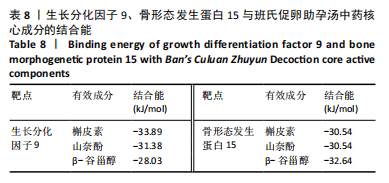
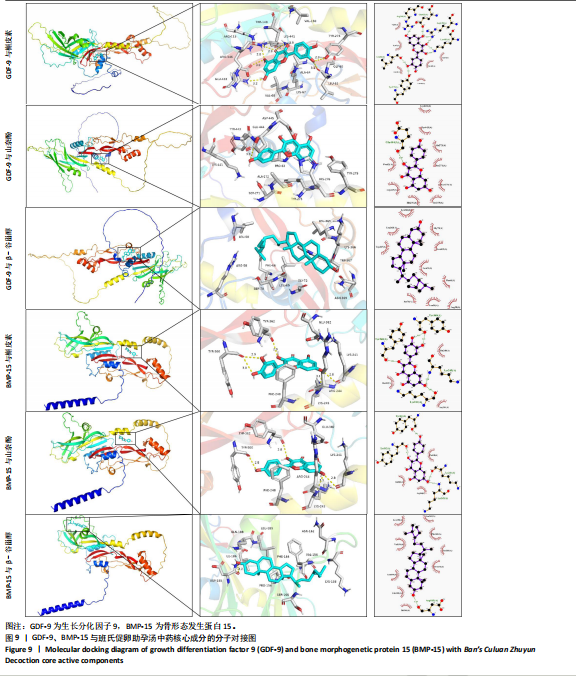
1.4.10 分子对接 在有机小分子生物活性数据库PubChem (https://pubchem.ncbi.nlm.nih.gov/)下载Degree值排名前3的中药核心成分的结构式,通过Open Babel转换为PDB格式。使用alphafold软件预测骨形态发生蛋白15、生长分化因子9的三维结构。用AutoDock Tool 1.5.7软件对其加氢及加电子等操作。确定对接盒子坐标,使用AutoDock vina 1.1.2软件对生长分化因子9、骨形态发生蛋白15与中药核心成分做分子对接验证,使用Pymol 2.1.0生成可视化3D分析图,使用LigPlot+软件对化合物与关键残基之间的相互作用进行可视化展示。
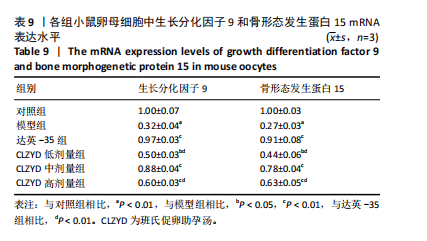
1.4.11 实时荧光定量PCR检测卵母细胞中生长分化因子9、骨形态发生蛋白15的mRNA相对表达量 收集各组卵母细胞,置于Trizol裂解液中,充分裂解混匀后,加入50%体积的氯仿,离心后取上层水相,加入等体积异丙醇后,离心获得RNA沉淀,经体积分数70%乙醇洗涤后,晾干,使用无RNA酶水进行溶解,使用超微量核酸检测仪检测RNA浓度及纯度,按照反转录试剂盒说明书进行反转录操作,所得cDNA置于-20 ℃保存待用。反转录产物cDNA作为扩增反应的模板并加入目的基因引物与内参引物进行扩增。扩增条件:预变性95 ℃,30 s;变性95 ℃,5 s;退火温度60 ℃,30 s;延伸72 ℃,15 s;循环40次。各基因的引物序列见表1。采用2-ΔΔCt法进行数据分析,公式为:ΔCt=(Ct gene-Ct Gapdh),ΔΔCt=(ΔCt treat-ΔCt control)。
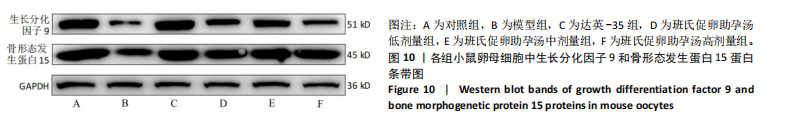
1.4.12 Western blot 检测卵母细胞中生长分化因子9、骨形态发生蛋白15蛋白相对表达量 卵母细胞裂解后抽提总蛋白,采用BCA法定量蛋白浓度,4×Loading Buffer充分混合,100 ℃金属浴变性10 min。取蛋白于凝胶中电泳110 V分离1.5 h,400 mA湿转1 h至PVDF膜,5%脱脂奶粉室温封闭60 min,加入抗生长分化因子9抗体、抗骨形态发生蛋白15抗体、抗GAPDH抗体4 ℃孵育过夜,加入二抗室温孵育60 min,浸入配制好的显影液中,自动曝光显影。采用Image J分析条带灰度值,根据目的蛋白与内参GAPDH的灰度值计算蛋白相对表达量。

1.5 主要观察指标 以小鼠的动情周期、血清性激素水平、妊娠情况、卵母细胞凋亡率和活性氧水平、卵母细胞纺锤体组装异常与染色体丢失率以及生长分化因子9和骨形态发生蛋白15表达水平作为衡量卵泡发育和卵母细胞质量的主要指标。
1.6 统计学分析 符合正态分布的定量数据以x±s表示,多组间比较采用单因素方差分析,多重比较采用Bonferroni法;P < 0.05为差异有显著性意义,P < 0.01为差异有非常显著性意义,使用SPSS 19.0和Graphpad prism 9.0软件对实验结果进行统计学分析及作图。