Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (36): 5897-5904.doi: 10.12307/2022.996
Mechanism and application prospects of motor imagery in spinal cord injury
Ma Jiang1, Zhang Di2, Zhao Tianyu2, Liu Xiaoxiao1, Wang Ju1, Lu Li1, Wang Ying1, Jin Song1, 2
- 1Chengdu University of Traditional Chinese Medicine, Chengdu 610036, Sichuan Province, China; 2Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610036, Sichuan Province, China
-
Received:2021-08-24Accepted:2021-11-11Online:2022-12-28Published:2022-04-28 -
Contact:Jin Song, MD, Master’s supervisor, Chengdu University of Traditional Chinese Medicine, Chengdu 610036, Sichuan Province, China; Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610036, Sichuan Province, China -
About author:Ma Jiang, Master candidate, Chengdu University of Traditional Chinese Medicine, Chengdu 610036, Sichuan Province, China -
Supported by:Project of Science and Technology Department of Sichuan Province, No. 2020YFS0381 (to JS); Sichuan Provincial Administration of Traditional Chinese Medicine, No. 2020LC0081 (to ZD)
CLC Number:
Cite this article
Ma Jiang, Zhang Di, Zhao Tianyu, Liu Xiaoxiao, Wang Ju, Lu Li, Wang Ying, Jin Song. Mechanism and application prospects of motor imagery in spinal cord injury[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(36): 5897-5904.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
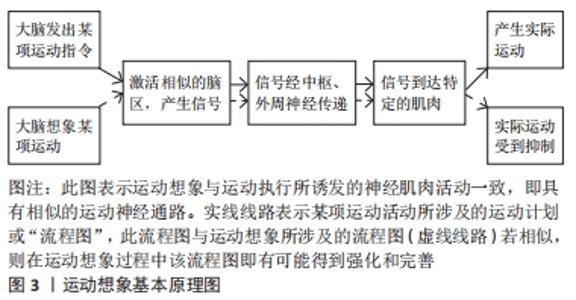
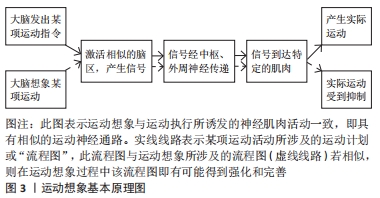
2.1 运动想象的概念及基本原理 运动想象在1950年由HOSSACK提出,是指主动激活人体中枢神经系统而使外周感受器产生刺激反应[8]。20世纪90年代DECETY明确提出运动想象是一种特殊的运动功能状态,是患者反复模拟和排练某种运动的一种心理状态,它存在于运动记忆中,可激活运动记忆中枢,而没有任何明显的运动输出,并遵循中枢运动控制原则[9]。目前运动想象分为动觉性运动想象和视觉性运动想象[10]。动觉性运动想象又被称为第一人称想象或内在想象,是指受试者在大脑中进行某一特定动作的想象,直至感觉到自己已经完成了这个动作。视觉性运动想象又被称为第三人称想象或外在想象,以视觉感官为主,与想象的环境密切相关,是指受试者似乎看到了他人或者自己正在进行特定的动作。研究发现,动觉性运动想象更适用于闭链运动技能的练习,而视觉性运动想象更适合用于开链运动技能的练习[11]。运动想象疗法最先用于运动员受伤后的治疗,此后逐渐用于脑卒中、帕金森综合征和脊髓损伤的康复[12]。 运动想象疗法的理论模式主要有心理神经肌肉理论、符号学习理论、三重编码模式及生物信息理论,目前比较公认的是心理神经肌肉理论[13]。心理神经肌肉理论是基于个体中枢神经系统已储存进行运动活动的运动计划或“流程图”,若运动执行时所涉及的运动“流程图”与运动想象期间是相似的,在运动想象过程中就有可能将运动执行所涉及的“流程图”强化和完善,即运动想象与运动执行所诱发的神经肌肉活动是相似的[14],见图3。 "

有研究通过比较运动想象和运动执行期间正电子发射断层扫描和功能性磁共振成像 [15-17],发现患者在运动想象期间有几个皮质和皮质下区域被激活,这与健康受试者在运动执行时激活的脑区相似,这些区域包括皮质水平的辅助运动区、前辅助运动区、前额叶腹侧、前运动区和后项叶区,以及皮质下壳核的前部、双侧尾状核和小脑前半球后外侧[14],说明运动想象与运动执行激活相似的脑区,脊髓损伤患者运动想象仍然能被适度保留,因为大脑结构没有被破坏[7],这为脊髓损伤的康复奠定了科学可靠的基础。 2.2 运动想象治疗脊髓损伤的可能机制 由于脊髓损伤患者大脑结构没有被破坏,运动想象能力适度保留,大量研究报道了脊髓损伤患者与健康人进行运动想象时可激活相似的脑区,运动想象训练可促进中枢神经可塑性发展和功能重组,促进脊髓损伤患者的康复。 2.2.1 脊髓损伤患者可激活与健康人相似的脑区 目前有大量研究显示脊髓损伤患者进行运动想象与健康人进行运动想象时,功能磁共振成像或脑磁图显示两组受试者激活的脑区相似。SABBAH等[18]首先对完全性胸腰椎脊髓损伤患者与健康人对照研究发现,两组受试者在进行运动想象期间激活的脑区总体相似,如初级运动皮质、辅助运动区和前运动皮质被激活,但健康对照组激活程度要比脊髓损伤患者组更强。随后,ALKADHI等[19]研究也得到类似的结果,发现两组激活的脑区总体一致,如辅助运动区、前辅助运动区、角回运动区和背外侧运动前皮质等,且发现脊髓损伤患者进行运动想象期间某些大脑区域激活程度进一步增强,如壳核、尾状核、丘脑和小脑,推测主要原因是脊髓损伤患者长期缺乏对初级运动区和初级感觉区的感觉输入而导致皮质-皮质抑制改变,长期缺乏躯体感觉反馈导致的可塑性变化。此外,研究补充到中央前回、顶叶下叶和楔前叶、小脑皮质、舌回、外苍白球、顶下回丘脑、中央后回和颞上回也存在重叠脑激活[20-23]。 有研究发现脊髓损伤患者的初级运动皮质激活似乎比健康对照组更高[24-25],但在脊髓损伤患者的尝试和想象运动中,中央前回的活动显著但减少,即使在脊髓损伤多年后,动作的内部排练依赖于对身体某部位进行运动想象的动觉记忆,对身体部位进行想象仍可能激活辅助运动区和初级运动皮质[25]。激活的脑区及程度不同这一现象也不能排除脊髓损伤患者在进行运动想象时使用与健康受试者不同的策略,因为这些患者不需要抑制运动结果,他们的策略可能是一个动作的尝试,而不是想象它[25]。运动想象期间的激活强度通常比健康人降低30%-50%[24],尽管如此,脊髓损伤患者运动想象能力被适度保留,运动想象疗法仍可激发足够的中枢神经系统来刺激大脑神经可塑性,从而促进患者运动学习和提高肌肉运动能力[21,26-28]。虽然目前的研究显示脊髓损伤患者与健康人进行运动想象训练激活的脑区不尽相同,但大多数研究都发现初级运动皮质和辅助运动区存在重叠激活,这些脑区主要负责运动的计划、控制与执行,这些研究证明了脊髓损伤患者与健康人进行运动想象时可激活相似的脑区,在一定程度上揭示了运动想象疗法干预脊髓损伤患者康复的可能机制。 2.2.2 脊髓损伤患者进行运动想象与运动执行可激活相似的脑区 运动想象是一个动作的内在想象,不涉及动作的实际执行,作为脊髓损伤后一个新兴的刺激中枢神经系统的途径,神经科学研究已证实了脊髓损伤患者进行运动想象和运动尝试时在大脑运动网络中招募重叠的区域[15,21],如辅助运动区、壳核、尾状核等,这些网络脑区是实际运动准备和执行的基础。研究发现运动想象是运动行为的一种特殊形式,介于从运动准备到运动执行的连续体中,运动想象的神经机制类似于运动执行的早期阶段——准备和编程[29-30]。运动想象和运动执行之间的差异主要是由于运动想象期间缺乏明显运动和运动相关的反馈,而脊髓损伤患者这种反馈回路损伤,因此这种差异不明显[4]。SABBAH等[31]研究发现脊髓损伤患者在进行运动想象和运动尝试任务中,初级感觉运动皮质、运动前区和辅助运动区都观察到被激活,并指出功能磁共振成像可观察脊髓损伤患者进行运动想象及运动尝试期间的大脑功能变化。CHEN等[15]对17例右脚踝运动功能部分障碍的不完全脊髓损伤患者(其传入和传出通路部分保留)分别进行右侧踝关节背屈-跖屈的运动想象任务和运动执行任务,发现激活的脑区总体相似,包括双侧辅助运动区、额下回、小脑小叶、前脑岛、右额中回,与运动执行任务相比,进行运动想象任务时上述区域以及左侧中央旁小叶、楔前叶的激活强度和程度均显著降低,这表明不完全性脊髓损伤患者进行心理运动想象时脑区发生的相应变化,但目前的研究并没有解释其潜在的神经机制,这需要在未来澄清。脊髓损伤患者进行运动想象和运动执行时可招募相似的大脑运动网络区域,促进脊髓损伤患者中枢神经系统功能重组,这对损伤或手术后短期内存在运动功能障碍的脊髓损伤患者的康复可能会很有价值。 2.2.3 中枢神经系统的可塑性发展和功能重组 脊髓损伤后,患者大脑皮质发生了适应性变化[32],一项关于脊髓损伤后脑区变化的Meta分析显示,脊髓损伤后患者的运动皮质、小脑和顶叶发生了明显改变,并定性地报告了躯体感觉的脑结构、皮质重组、白质扩散和丘脑代谢物的改变[33]。大量的研究认为大脑皮质功能和结构可通过不断的运动想象训练诱导中枢神经可塑性发展和重组,促进运动功能的恢复[24-25,34-36]。脊髓损伤后患者大脑皮质受到的抑制减弱,这可能是中枢神经可塑性发展和功能重组的原因[37]。研究发现在脊髓损伤患者康复中加入运动想象训练后,脑磁图数据显示代偿性脑区激活减少,皮质活动接近健康人,提示运动想象训练参与了脊髓损伤患者的代偿性神经激活的逆转,促进了正常神经网络的整合[21]。也有研究认为运动相关脑区的激活增加主要是由于脊髓损伤不完全,受损的皮质脊髓束进行了重组,使患者可以控制肢体,促进功能恢复[15-16]。 脊髓损伤后参与运动控制的脑区发生重组,特别是脊髓损伤患者在与健康人相比时,表现出以下变化:①基底节左侧苍白球区和后壳核区激活面积扩大,这些是与动作的记忆习得和为动作执行做准备时所涉及的脑区;②初级感觉皮质激活区空间定位的转移[25]。GUSTIN等[22]和MATEO等[38]的研究也报道了类似的脑重构,他们观察到脊髓损伤患者在进行运动想象期间,补充运动区(参与运动的启动和抑制)、运动前皮质(参与运动的规划)和小脑皮质(参与运动准备,特别是运动指令抑制)比健康对照组激活更明显。此外,运动想象也被用于脑机接口实现外骨骼的完全和不完全脊髓损伤的控制模式[39-40]。即使在完全损伤的情况下,使用脑机接口-运动想象训练可促进中枢神经系统的可塑性发展和功能重组[39]。脊髓损伤后大脑皮质发生适应性变化,在加入运动想象训练后,脑区代偿活动减少,激活的脑区与健康人接近,运动想象训练参与了脊髓损伤患者的正常神经网络的整合,可促进中枢神经系统的可塑性发展和功能重组。 作者总结并列举了运动想象治疗脊髓损伤的机制的临床研究成果,见表1。 "


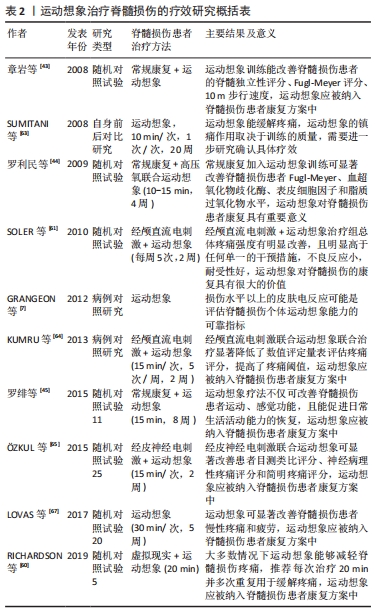
2.3 运动想象治疗脊髓损伤的临床应用 运动想象是患者反复进行模拟和排练某种运动的一种心理状态,也不需要依靠患者残存的功能,对特定身体部位运动的想象,运动想象所产生的大脑皮质兴奋激活功能区,促使中枢神经系统修复与重组,患者反复的练习从中枢输出的信息去刺激皮质、周围神经,直至外周的肌肉,最终产生实际运动,促进感觉运动功能恢复。运动想象训练需患者具备一定的想象能力,一般要求患者动觉和视觉运动想象问卷≥25分[4],它由20个项目组成,涉及头部和躯干的轴向运动以及上肢和下肢运动。研究指出根据运动想象期间检测相应水平上下的皮肤电反应的持续时间、潜伏期和振幅来评定运动想象能力[7],并且将该方法纳入运动想象问卷,以评估脊髓损伤患者运动想象能力。目前大量研究结果表明运动想象疗法能改善脊髓损伤患者的运动功能、神经源性疼痛及神经源性膀胱功能障碍,其疗效虽然存在一定的潜在异质性,但运动想象疗法对脊髓损伤患者的康复是非常有价值的,应该将运动想象疗法纳入脊髓损伤患者常规康复方案中[27]。 2.3.1 运动想象治疗脊髓损伤的运动功能障碍 脊髓损伤患者肌肉失去神经控制,表现为受损平面以下的肌力减弱、肌张力异常等,患者完全或部分丧失运动能力。运动想象可以激活与运动执行相似的大脑区域,促进中枢神经系统的重组与修复,重复的练习可以使患者的运动功能得以恢复[41]。DECETY等[9]首先将运动想象疗法用于脊髓损伤患者的康复训练,并得出在物理练习困难的情况下,运动想象疗法可作为一种促进功能恢复的方法。GRANGEON等[35]对C6损伤患者做了肱二头肌肌腱转移到肱三头肌肌腱上的手术,术后对左臂进行康复,康复训练在常规康复基础上进行10次运动想象训练,每次30 min,每周5次,干预2周后,发现肘关节屈肌和伸肌的力量有所增加。不完全性脊髓损伤患者和健康受试者在进行运动想象训练后,发现患者在运动想象期间与运动相关的壳核激活增加,且对侧硬膜和苍白球的活动也增强,训练后患者的运动功能有所提高[15,25,42]。脊髓损伤患者进行运动想象训练不仅可以改善患者的Fugl-Meyer评分、步态、日常生活活动能力,还能改善患者血超氧化物歧化酶、表皮细胞因子和脂质过氧化物水平,促进组织修复[38,43-45]。最近一项系统评价表示运动想象可改善脊髓损伤运动功能障碍,并推荐每次治疗时间为30-60 min,重复多次训练[46],但研究存在样本量较少、治疗方案差异较大等高度的异质性,仍需高质量研究进一步确定其疗效。总的来说,目前的结果提供了证据,脊髓损伤后大脑运动系统功能的许多特征是完整的,运动想象可有效改善脊髓损伤患者运动功能障碍,对脊髓损伤患者康复具有很大价值。 2.3.2 运动想象治疗脊髓损伤的疼痛 疼痛是脊髓损伤后最常见的症状之一,最常见的是神经性疼痛,其特点包括灼烧痛、压痛、阵发性疼痛、诱发性疼痛和感觉异常[47-48]。此外,脊髓损伤患者的身体除了感知真实肢体外,还会感知多余幻肢或多余幻肢疼痛[49]。在一项关于脊髓损伤患者出现的神经性疼痛的Meta分析中,发现脊髓损伤后神经病理性疼痛的患病率为53%,此外,脊髓损伤后1年的患者出现损伤水平以下的疼痛更为常见[50]。有研究显示脊髓损伤患者与健康人感受痛觉相关的多个大脑区域的神经解剖发生显著变化,这些区域包括丘脑腹后区、前额叶皮质、岛叶皮质、杏仁核和运动前皮质[22,51]。目前认为脊髓损伤水平下的神经性疼痛是由于对低于正常激活阈值的刺激而产生了过度的神经元反应,这种高兴奋性是由于各种受体、离子通道、胶质细胞刺激和背角内源性抑制性神经元减少而引起的[52]。解释这些疾病患者神经性疼痛背后机制的理论包括中枢水平的神经生理变化,如初级躯体感觉皮质重组的神经可塑性[53]。除了皮质组织的改变,神经性疼痛也与皮质和丘脑的功能改变有关[54-56]。脊髓损伤后的慢性疼痛的管理是非常具有挑战性的,药理学和非药理学治疗的有效性仍然缺乏证据[57]。 最近的研究表明,刺激运动皮质可以作为治疗疼痛的非药物方法之一[58-59],而运动想象正是一种可以用于这一目的的技术。有文献表明在大多数情况下运动想象能够减轻脊髓损伤疼痛[42,46,60-67],降低了目测类比评分、神经病理性疼痛评分和简明疼痛评分,提高了疼痛阈值,推荐每次治疗时间20 min并多次重复用于缓解疼痛,也可以与其他(如虚拟现实,经颅直流电刺激等)治疗方法联合使用,疗效更佳[68]。然而,有研究报道了运动想象训练会使脊髓损伤患者疼痛加剧[69],并且出现了新区域疼痛,这一现象曾有研究假设认为,脊髓损伤后的皮质重组水平与神经性疼痛水平成正比[55]。但后来被研究否定[70],神经性疼痛与脑可塑性增强无关,并提出中枢神经系统的重组可能是防止神经病理性疼痛发展的适应性过程。也有研究显示运动想象干预脊髓损伤患者疼痛无效[71],这些差异背后可能有许多原因,如患者对疼痛的敏感度、社会压力、患者对治疗的期望或运动想象方法方案的差异[72-73]。虽然有两项研究指出运动想象疗法不能甚至加剧脊髓损伤患者的疼痛,使其疗效存在较大异质性,但大多数研究认为临床上对于伴有神经性疼痛的脊髓损伤患者,运动想象疗法应纳入康复方案中。 2.3.3 运动想象治疗脊髓损伤后神经源性膀胱 脊髓损伤后,神经源性膀胱是由于神经环路受损引起的逼尿肌功能异常[74],脊髓损伤中的神经源性膀胱与多种并发症相关,包括尿失禁和潴留、泌尿道感染、肾功能损害及肾脏结石等,脊髓损伤患者并发神经源性膀胱的概率非常高,严重威胁患者的生命健康,膀胱功能的改善成为脊髓损伤患者研究的重要任务[75]。已有研究表明在脊髓损伤患者常规膀胱功能干预方案中加入运动想象训练后,可显著改善患者尿失禁次数、导尿次数、平均膀胱容量、最大排尿量、残余尿量、生活质量、心理状况,推荐每次20 min,每日4-6次[76-80]。娄玲娣等[81]探讨运动想象疗法治疗脊髓损伤后神经源性膀胱患者疗效的影响因素,对92例脊髓损伤后患者进行研究分析后,发现患者的文化程度、抑郁状态、神经源性膀胱类型、介入时间及疗程不同都会影响患者进行膀胱训练,这表明在对脊髓损伤患者进行运动想象疗法治疗时应该多加强影响疗效因素的宣传与指导。目前只有中文文献支撑运动想象疗法可改善脊髓损伤患者的膀胱功能,且这些中文文献的质量较低、研究数量较少,缺乏高质量文献支撑,需要更多的高质量研究进一步验证其疗效。 作者总结并列举了运动想象治疗脊髓损伤的疗效的相关临床研究成果,见表2。 "

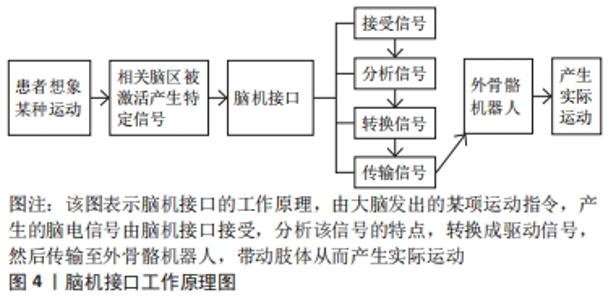
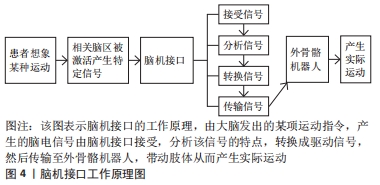
为了准确地使用运动想象-脑机接口,用户必须通过调节感觉运动节律来产生稳定的脑电信号[84],需要进行以下几个步骤[85],包括:①预处理以提高信号噪声比率;②频率选择,测量受试者运动想象期间感觉运动节律的最大振幅;③检测和分类,对参与者进行广泛的训练,让他们在有或没有线索的情况下想象一个动作。基于人机交互的脑机接口能有效地捕捉大脑产生的信号,有研究表明脊髓损伤患者在5个月的训练后,运动想象的脑电信号与健康受试者相匹配[86],C4和C5四肢瘫痪的患者已经逐渐能够通过大量重复不能实际完成的动作(如手或脚的运动)的运动想象训练来控制抓握脑机接口设备。由于运动想象-脑机接口的使用培训要求高水平的注意力,高要求或持续的运动想象过程会导致训练期间患者疲劳[87],疲劳会通过失去注意力和兴趣来影响训练效果,所以有研究提出了一种基于虚拟现实和游戏的运动想象-脑机接口训练环境[88],游戏的目的是提高注意力和参与积极性,对20位参与者训练后,提高了训练速度,该方法可以有效提高参与者进行运动想象-脑机接口操作的基本水平,同时在运动想象期间增加了信号传输效率。有研究表明,尽管有运动障碍的脑卒中或脊髓损伤患者在运动想象过程中的脑电图反应能力平均低于健康受试者,但经过几次训练后,所有患者都能够在脑机接口系统中获得高精准度,对运动功能障碍患者进行运动想象训练有益的[88-90]。在过去的几年里,机器人的外骨骼发展对脊髓损伤后存在运动功能障碍的患者来说是一种有希望的康复和辅助工具。脑机接口被认为是脊髓损伤后康复的革命性改变,例如脑机接口通过控制神经假体、外骨骼、功能性电刺激等让患者恢复运动功能[91],具有非常好的发展前景。 "

| [1] 陈星月,陈栋,陈春慧,等.中国创伤性脊髓损伤流行病学和疾病经济负担的系统评价[J].中国循证医学志,2018,18(2):143-150. [2] MATTHEW JE, MATTHEW JM. Trauma: spinal cord injury. Surg Clin North Am. 2017;97(5):1031-1045. [3] 朱辉.早期脊柱脊髓损伤综合救治新策略[J].解放军医药杂志,2012, 24(1):1-4. [4] DI RIENZO F, GUILLOT A, DALIGAULT S, et al. Motor inhibition during motor imagery: a MEG study with a quadriplegic patient. Neurocase. 2014;20(5):524-539. [5] 创伤性脊柱脊髓损伤康复治疗专家共识(2020版)[J].中华创伤杂志,2020,36(5):385-392. [6] CARVALHO R, AZEVEDO E, MARQUES P, et al. Physiotherapy based on problem-solving in upper limb function and neuroplasticity in chronic stroke patients: a case series. J Eval Clin Pract. 2018;24(9):552-560. [7] GRANGEON M, CHARVIER K, GUILLOT A, et al. Using sympathetic skin responses in individuals with spinal cord injury as a quantitative evaluation of motor imagery abilities. Phys Ther. 2012;92(6):831-840. [8] HOSSACK JC. Mental imagery. Manitoba Med Rev. 1950;30(8):543-545. [9] DECETY J, BOISSON D. Effect of brain and spinal cord injuries on motor imagery. Eur Arch Psychiatry Clin Neurosci. 1990;240(1):39-43. [10] GRUSH R. The emulation theory of representation: motor control, imagery, and perception. Behav Brain Sci. 2004;27(3):377-396. [11] HALL C, BUCKOLZ E, FISHBURNE GJ. Imagery and the acquisition of motor skills. Can J Sport Sci. 1992;17(1):19-27. [12] ALJOSCHA T, ANJA S, LANGTHALER PB, et al. Imagine there is no plegia. mental motor imagery difficulties in patients with traumatic spinal cord injury. Front Neurol. 2017;11(689):1-12. [13] SABARI JS. Motor learning concepts applied to activity-based intervention with adults with hemiplegia. Am J Occup Ther. 1991;45(6): 523-530. [14] PAGE SJ, LEVINE P, SISTO SA, et al. A randomized efficacy and feasibility study of imagery in acute stroke. Clin Rehabil. 2001;15(3):233-240. [15] CHEN X, WAN L, QIN W, et al. Functional preservation and reorganization of brain during motor imagery in patients with incomplete spinal cord injury: a pilot fMRI study. Front Hum Neurosci. 2016;10(46):1-10. [16] RIENZO FD, COLLET C, HOYEK N, et al. Impact of neurologic deficits on motor imagery: a systematic review of clinical evaluations. Neuropsychol Rev. 2014;24(4):116-147. [17] BURIANOVÁ H, MARSTALLER L, RICH AN, et al. Motor neuroplasticity: a MEG-fMRI study of motor imagery and execution in healthy ageing. Neuropsychologia. 2020;146:107539. [18] SABBAH P, DE SS, LEVEQUE C, et al. Sensorimotor cortical activity in patients with complete spinal cord injury: a functional magnetic resonance imaging study. Neurotrauma. 2002;19(1):53-60. [19] ALKADHI H. What disconnection tells about motor imagery: evidence from paraplegic patients. Cerebral Cortex. 2004;15(2):131-140. [20] CRAMER SC, LASTRA L, LACOURSE MG, et al. Brain motor system function after chronic, complete spinal cord injury. Brain. 2005;128(12): 2941-2950. [21] DI RIENZO F, GUILLOT A, MATEO S, et al. Neuroplasticity of prehensile neural networks after quadriplegia. Neuroscience. 2014;274:82-92. [22] GUSTIN SM, WRIGLEY PJ, HENDERSON LA, et al. Brain circuitry underlying pain in response to imagined movement in people with spinal cord injury. Pain. 2010;148(3):438-445. [23] GAO F, GUO Y, CHU H, et al. Lower-limb sensorimotor deprivation-related brain activation in patients with chronic complete spinal cord injury. Front Neurol. 2020;11:1-12. [24] LOTZE M, HALSBAND U. Motor imagery. J Physiol Paris. 2006;99(4):386-395. [25] CRAMER SC, ORR ELR, COHEN MJ, et al. Effects of motor imagery training after chronic, complete spinal cord injury. Exp Brain Res. 2007; 177(2):233-242. [26] DI RIENZO F, GUILLOT A, MATEO S, et al. Neuroplasticity of imagined wrist actions after spinal cord injury: a pilot study. Exp Brain Res. 2015; 233(1):291-302. [27] HOTZ-BOENDERMAKER S, FUNK M, SUMMERS P, et al. Preservation of motor programs in paraplegics as demonstrated by attempted and imagined foot movements. Neuroimage. 2008;39(1):383-394. [28] MUNZERT J, LOREY B, ZENTGRAF K. Cognitive motor processes: the role of motor imagery in the study of motor representations. Brain Res Rev. 2009;60(2):306-326. [29] BRUNO V, FOSSATARO C, GARBARINI F. “Inhibition or facilitation? Modulation of corticospinal excitability during motor imagery”. Neuropsychologia. 2018;111:360-368. [30] SÉBASTIEN H, MATHIEU G, ARNAUD S, et al. The neural network of motor imagery: an ALE meta-analysis. Neurosci Biobehav Rev. 2013;37(5):930-949. [31] SABBAH P, C LÉVÊQUE, PFEFER F, et al. Functional MR imaging and traumatic paraplegia: preliminary report. J Neuroradiol. 2000;27(4): 233-237. [32] 刘亚东,关骅.脊髓损伤后大脑皮质的变化[J].中国康复理论与实践,2008,14(8):713-715. [33] SOLSTRAND DL, BECERRA L, BORSOOK D, et al. Brain changes after spinal cord injury, a quantitative meta-analysis and review. Neurosci Biobehav Rev. 2018;90:272-293. [34] SARAH AD. Activity-dependent plasticity: implications for recovery after spinal cord injury. Trends Neurosci. 2008;31(8):410-418. [35] GRANGEON M, GUILLOT A, SANCHO PO, et al. Rehabilitation of the elbow extension with motor imagery in a patient with quadriplegia after tendon transfer. Arch Phys Med Rehabil. 2010;91(7):1143-1146. [36] JACKSON PL, LAFLEUR MF, MALOUIN F, et al. Functional cerebral reorganization following motor sequence learning through mental practice with motor imagery. Neuroimage. 2003;20(2):1171-1180. [37] ROY FD, ZEWDIE ET, GORASSINI MA. Short-interval intracortical inhibition with incomplete spinal cord injury. Clin Neurophys. 2011; 122(7):1387-1395. [38] MATEO S, DI RIENZO F, REILLY KT, et al. Improvement of grasping after motor imagery in C6-C7 tetraplegia: a kinematic and MEG pilot study. Restor Neurol Neurosci. 2015;33:543-555. [39] LIU J, ABD-EL-BARR M, CHI JH. Long-term training with a brain-machine interface-based gait protocol induces partial neurological recovery in paraplegic patients. Neurosurgery. 2016;79(6):N13-N14. [40] RAJASEKARAN V, LÓPEZ-LARRAZ E, TRINCADO-ALONSO F, et al. Volition-adaptive control for gait training using wearable exoskeleton: preliminary tests with incomplete spinal cord injury individuals. J Neuroeng Rehabil. 2018;15(4):1-15. [41] DICKSTEIN R, DEUTSCH JE. Motor imagery in physical therapist practice. Phys Ther. 2007;87(7):942-953. [42] SHARP KG, GRAMER R, BUTLER L, et al. Effect of overground training augmented by mental practice on gait velocity in chronic, incomplete spinal cord injury. Arch Phys Med Rehabil. 2014;95(4):615-621. [43] 章岩,秦福兰,谢宏文,等.运动想象、功能电刺激、减重平板步行训练改善不完全脊髓损伤患者步行能力的研究[J].山东医药, 2008,48(42):38-39. [44] 罗利民,布林,张杰英.高压氧联合运动想象对交通性脊髓挫伤致截瘫患者神经功能恢复的治疗效果[J].中国全科医学,2009,12(22): 2069-2071. [45] 罗绯,刘建成,李艳波,等.运动想象疗法对不完全脊髓损伤患者肢体功能及ADL的影响[J].中国康复,2015,30(5):364-365. [46] OPSOMMER E, CHEVALLEY O, KOROGOD N. Motor imagery for pain and motor function after spinal cord injury: a systematic review. Spinal cord. 2020;58(3):262-274. [47] MAHNIG S, LANDMANN G, STOCKINGER L, et al. pain assessment according to the international spinal cord injury pain classification in patients with spinal cord injury referred to a multidisciplinary pain center. Spinal Cord. 2016;54(10):1-7. [48] LEE S, ZHAO X, HATCH M, et al. Central neuropathic pain in spinal cord injury. Crit Rev Phys Rehabil Med. 2013;25(3-4):159-172. [49] CHOI JY, KIM HI, LEE KC, et al. Atypical supernumerary phantom limb and phantom limb pain in a patient with spinal cord injury: case report. Ann Rehabil Med. 2013;37(6):901-906. [50] BURKE D, FULLEN BM, STOKES D, et al. Neuropathic pain prevalence following spinal cord injury: a systematic review and meta-analysis. Eur J Pain. 2017;21(1):29-44. [51] GUSTIN SM, WRIGLEY PJ, SIDDALL PJ, et al. Brain anatomy changes associated with persistent neuropathic pain following spinal cord injury. Cereb Cortex. 2009;20(6):1409-1419 [52] HADJIPAVLOU G, CORTESE AM, RAMASWAMY B. Spinal cord injury and chronic pain. BJA Educ. 2016;16(8):264-268. [53] LAUMET G, CHEN SR, PAN HL. NMDA receptors and signaling in chronic neuropathic pain. NMDA Receptors. 2017;4:103-119. [54] ANDERSON-BARNES VC, MCAULIFFE C, SWANBERG KM, et al. Phantom limb pain -a phenomenon of proprioceptive memory? Med Hypotheses. 2009;73(4):555-558. [55] WRIGLEY PJ, PRESS SR, GUSTIN SM, et al. Neuropathic pain and primary somatosensory cortex reorganization following spinal cord injury. Pain. 2009;141(1):52-59. [56] MOXON KA, OLIVIERO A, AGUILAR J, et al. Cortical reorganization after spinal cord injury: always for good? Neurosci. 2014;283:78-94. [57] FINNERUP NB, ATTAL N, HAROUTOUNIAN S, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015;14(2):162-173 [58] TSUBOKAWA T, KATAYAMA Y, YAMAMOTO T, et al. Treatment of thalamic pain by chronic motor cortex stimulation. Pacing Clin Electrophysiol. 1991;14:131-134. [59] LE DEAN Y, BRISSEBRAT B, CASTEL-LACANAL E, et al. Management of neuropathic central pain by noninvasive brain stimulation and mirror therapy. Ann Phys Rehabil Med. 2016;59S:e145. [60] RICHARDSON EJ, MCKINLEY EC, RAHMAN AK, et al. Effects of virtual walking on spinal cord injury-related neuropathic pain: a randomized, controlled trial. Rehabil psy. 2019;64(1):13-24. [61] SOLER MD, KUMRU H, PELAYO R, et al. Effectiveness of transcranial direct current stimulation and visual illusion on neuropathic pain in spinal cord injury. Brain. 2010;133(9):2565-2577. [62] MOSELEY GL. Using visual illusion to reduce at-level neuropathic pain in paraplegia. Pain. 2007;130:294-298. [63] SUMITANI M, MIYAUCHI S, MCCABE CS, et al. Mirror visual feedback alleviates deafferentation pain, depending on qualitative aspects of the pain: a preliminary report. Rheumatology (Oxford). 2008;47(7):1038-1043. [64] KUMRU H, SOLER D, VIDAL J, et al. The effects of transcranial direct current stimulation with visual illusion in neuropathic pain due to spinal cord injury: an evoked potentials and quantitative thermal testing study. Eur J Pain. 2013;17(1):55-66. [65] ÖZKUL Ç, KILINÇ M, YILDIRIM SA, et al. Effects of visual illusion and transcutaneous electrical nerve stimulation on neuropathic pain in patients with spinal cord injury: a randomised controlled cross-over trial. J Back Musculoskelet Rehabil. 2015;28(4):709-719. [66] KATAYAMA O, IKI H, SAWA S, et al. The effect of virtual visual feedback on supernumerary phantom limb pain in a patient with high cervical cord injury: a single-case design study. Neurocase. 2015;21(6):786-792. [67] LOVAS J, TRAN Y, MIDDLETON J, et al. Managing pain and fatigue in people with spinal cord injury: a randomized controlled trial feasibility study examining the efficacy of massage therapy. Spinal Cord. 2017; 55(2):162-166. [68] KAUR J, GHOSH S, SAHANI AK, et al. Mental imagery training for treatment of central neuropathic pain: a narrative review. Acta Neurol Belg. 2019;119(2):175-186. [69] GUSTIN SM, WRIGLEY PJ, GANDEVIA SC, et al. Movement imagery increases pain in people with neuropathic pain following complete thoracic spinal cord injury. Pain. 2008;137:237-244. [70] JUTZELER CR , FREUND P , HUBER E , et al. Neuropathic pain and functional reorganization in the primary sensorimotor cortex after spinal cord injury. J Pain. 2015;16(12):1256-1267. [71] ROOSINK M, ROBITAILLE N, JACKSON PL, et al. Interactive virtual feedback improves gait motor imagery after spinal cord injury: an exploratory study. Restor Neurol Neurosci. 2016;34:227-235. [72] OPSOMMER E, KOROGOD N. Mental practice for chronic pain in people with spinal cord injury: a systematic review protocol. JBI database Syst Rev Implement Rep. 2017;15:2004-2012. [73] COHEN SP, MAO J. Neuropathic pain: mechanisms and their clinical implications. BMJ. 2014;348:f7656. [74] 王元姣,林坚,娄玲娣,等.运动想象疗法治疗脊髓损伤后神经源性膀胱的疗效观察[J].中华物理医学与康复杂志,2012,34(12):928-930. [75] STAMPAS A, KORUPOLU R, ZHU L, et al. Safety, feasibility, and efficacy of transcutaneous tibial nerve stimulation in acute spinal cord injury neurogenic bladder: a randomized control pilot trial. Neuromodulation. 2019;22(6):716-722. [76] 赖靖慧,戴清月,程熙,等.运动想象疗法治疗脊髓损伤后神经源性膀胱的临床疗效观察[J].医学理论与实践,2017,30(17):2637-2638. [77] 张卫卫,杨阳,邹丽丽,等.运动想象疗法联合间歇导尿在脊髓损伤后神经源性膀胱中的应用[J].医药论坛杂志,2021,42(8):35-38. [78] 唐琦,张颖,俞建洪.运动想象联合间歇导尿在神经源性膀胱患者中的应用[J].现代实用医学,2021,33(1):87-89. [79] 门晓婷.运动想象结合本体感觉神经肌肉促进疗法对脊髓损伤后神经源性膀胱患者的临床研究[D].呼和浩特:内蒙古医科大学, 2018. [80] 徐淑芬,王元姣,柴文娟,等.运动想象疗法联合间歇性导尿治疗神经源性膀胱的康复护理[J].护理与康复,2016,15(4):362-364. [81] 娄玲娣,付金英,李学军,等.运动想象疗法治疗脊髓损伤神经源性膀胱患者的影响因素分析[J].中华现代护理杂志,2015,21(5): 501-504. [82] YUAN H, HE B. Brain-computer interfaces using sensorimotor rhythms: current state and future perspectives. IEEE Transactions on Biomed Eng. 2014;61(5):1425-1435. [83] 常琪,单新颖,毕胜.基于脑电图的脑机接口在肢体康复中的应用进展[J].中国康复医学杂志,2019,34(12):1488-1492. [84] ŠKOLA F, TINKOVÁ S, LIAROKAPIS F. Progressive training for motor imagery brain-computer interfaces using gamification and virtual reality embodiment. Front Hum Neurosci. 2019;13(329):1-16. [85] MATEO S, FRANCK DR, VANCE B, et al. Motor imagery reinforces brain compensation of reach-to-grasp movement after cervical spinal cord injury. Front Behav Neurosci. 2015;9(234):1-12. [86] PFURTSCHELLER G, GUGER C, MÜLLER G, et al. Brain oscillations control hand orthosis in a tetraplegic. Neurosci Lett. 2000;292(3):211-214. [87] TALUKDAR U, HAZARIKA SM, GAN JQ. Motor imagery and mental fatigue: inter-relationship and EEG based estimation. J Comput Neurosci. 2019;46(1):55-76. [88] LIBURKINA SP, VASILYEV AN, KAPLAN AY, et al. Brain-computer interface-based motor imagery training for patients with neurological movement disorders. Zh Nevrol Psikhiatr Im S Korsakova. 2018;118(9):63-68. [89] ONOSE G, GROZEA C, ANGHELESCU A, et al. On the feasibility of using motor imagery EEG-based brain-computer interface in chronic tetraplegics for assistive robotic arm control: a clinical test and long-term post-trial follow-up. Spinal Cord. 2012;50(8):599-608. [90] SALISBURY DB, PARSONS TD, MONDEN KR, et al. Brain-computer interface for individuals after spinal cord injury. Rehabil Psychol. 2016; 61(4):435-441. [91] HÖLLER Y, THOMSCHEWSKI A, UHL A, et al. HD-EEG based classification of motor-imagery related activity in patients with spinal cord injury. Front Neurol. 2018;9(955):1-21. [92] VILLIGER M, GRABHER P, HEPP-REYMOND MC, et al. Relationship between structural brainstem and brain plasticity and lower-limb training in spinal cord injury: a longitudinal pilot study. Front Hum Neurosci. 2015;9(254):1-15. [93] ALKINOOS A, NIKOS T, NIKI P, et al. Functional brain connectivity during multiple motor imagery tasks in spinal cord injury. Neural Plast. 2018;2018(3-4):1-20. [94] ALIMARDANI M, NISHIO S, ISHIGURO H. The importance of visual feedback design in BCIs: from Embodiment to motor imagery learning. PLoS One. 2016;11(9):1-17 |
| [1] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [2] | Jin Tao, Liu Lin, Zhu Xiaoyan, Shi Yucong, Niu Jianxiong, Zhang Tongtong, Wu Shujin, Yang Qingshan. Osteoarthritis and mitochondrial abnormalities [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1452-1458. |
| [3] | Zhang Lichuang, Xu Hao, Ma Yinghui, Xiong Mengting, Han Haihui, Bao Jiamin, Zhai Weitao, Liang Qianqian. Mechanism and prospects of regulating lymphatic reflux function in the treatment of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1459-1466. |
| [4] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1260-1265. |
| [5] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1272-1277. |
| [6] | Kan Houming, Fan Lijun, Chen Xuetai, Shen Wen. Application of platelet-rich plasma in neuropathic pain [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1286-1292. |
| [7] | Hu Wei, Xie Xingqi, Tu Guanjun. Exosomes derived from bone marrow mesenchymal stem cells improve the integrity of the blood-spinal cord barrier after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 992-998. |
| [8] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [9] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1119-1124. |
| [10] | Hui Xiaoshan, Bai Jing, Zhou Siyuan, Wang Jie, Zhang Jinsheng, He Qingyong, Meng Peipei. Theoretical mechanism of traditional Chinese medicine theory on stem cell induced differentiation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1125-1129. |
| [11] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [12] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1137-1142. |
| [13] | Guo Jia, Ding Qionghua, Liu Ze, Lü Siyi, Zhou Quancheng, Gao Yuhua, Bai Chunyu. Biological characteristics and immunoregulation of exosomes derived from mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1093-1101. |
| [14] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1102-1106. |
| [15] | Zhou Hongqin, Wu Dandan, Yang Kun, Liu Qi. Exosomes that deliver specific miRNAs can regulate osteogenesis and promote angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1107-1112. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||