Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (7): 1093-1101.doi: 10.12307/2022.150
Previous Articles Next Articles
Biological characteristics and immunoregulation of exosomes derived from mesenchymal stem cells
Guo Jia, Ding Qionghua, Liu Ze, Lü Siyi, Zhou Quancheng, Gao Yuhua, Bai Chunyu
- Institute of Precision Medicine, Jining Medical University, Jining 272067, Shandong Province, China
-
Received:2021-02-24Revised:2021-02-25Accepted:2021-03-24Online:2022-03-08Published:2021-10-29 -
Contact:Gao Yuhua, MD, Associate professor, Institute of Precision Medicine, Jining Medical University, Jining 272067, Shandong Province, China Bai Chunyu, MD, Associate professor, Institute of Precision Medicine, Jining Medical University, Jining 272067, Shandong Province, China -
About author:Guo Jia, Institute of Precision Medicine, Jining Medical University, Jining 272067, Shandong Province, China Ding Qionghua, Institute of Precision Medicine, Jining Medical University, Jining 272067, Shandong Province, China -
Supported by:the National Natural Science Foundation of China, No. 31972755 (to BCY); Shandong Provincial Natural Science Foundation, China, No. ZR2020KH031 (to BCY); National College Student Innovation and Entrepreneurship Training Program, No. 201910443012 (to GJ)
CLC Number:
Cite this article
Guo Jia, Ding Qionghua, Liu Ze, Lü Siyi, Zhou Quancheng, Gao Yuhua, Bai Chunyu. Biological characteristics and immunoregulation of exosomes derived from mesenchymal stem cells[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1093-1101.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
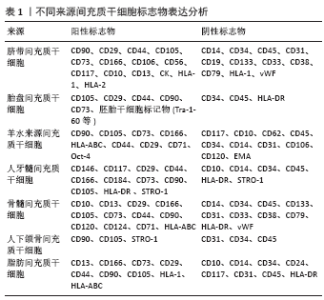
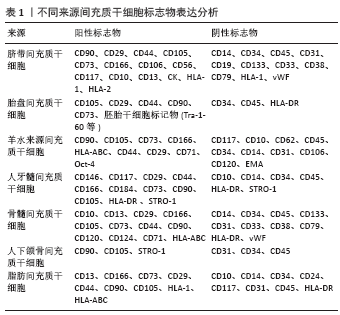
2.1 间充质干细胞 干细胞是一类具有自我更新和多分化潜能的细胞,在一定条件下,它可以分化成不同胚层的细胞。根据其所处的发育阶段可分为胚胎干细胞和成体干细胞;根据其发育潜能可分为3类:全能干细胞、多能干细胞和单能干细胞[9]。干细胞在转化医学中充分利用其再生能力来修复损伤的组织,当前对干细胞的临床应用多见于间充质干细胞。间充质干细胞属成体干细胞,来源丰富,分布广泛,几种常见来源组织有骨髓、脐带、胎盘、脂肪等。间充质干细胞具有多向分化潜能且免疫原性低,通过旁分泌发挥不同的调控作用[10]。人脐带间充质干细胞高表达间充质干细胞共同标记物如Thy-1、CD90、CD73等,不表达HLA-DR、vWF和血小板-内皮细胞黏附分子PECAM-1(CD31)等[11-16];人胎盘间充质干细胞除表达间充质干细胞共同标记物外还特异表达胚胎干细胞标记物,如Tra-1–60、Tra-1–81、SSEA-1、SSEA-4等[17-19];羊水来源间充质干细胞的胚胎干细胞标志物Oct-4呈阳性表达[20-21];人牙髓间充质干细胞表达STRO-1,而CD10则为阴性[22]。不同文献报道的骨髓间充质干细胞标记物表达略有不同,但均高表达CD73、CD90、CD105和HLA-ABC等,而CD14、CD34、CD45、HLA-DR、vWF等为低表达或不表达[12,16-17,20,23-24]。国际细胞治疗学会于2006年针对骨髓间充质干细胞提出鉴定标准为:高表达CD73、CD90和CD105,而不表达CD14、CD34、CD45和HLA-DR[25-26]。人颌骨间充质干细胞阳性表达间充质干细胞标志物CD90,而CD31表达阴性[27]。人脂肪间充质干细胞标记物CD13及HLA-1、HLA-ABC等均为阳性表达,CD10为阴性表达[22,28-29]。当前对于不同来源间充质干细胞的鉴定,一致认同可以用于鉴定的标准为CD90、CD105、CD73、STRO-1、CD146表达阳性,CD14、CD34、CD45和HLA-DR阴性[25]。不同间充质干细胞生物学特性详见表1。"
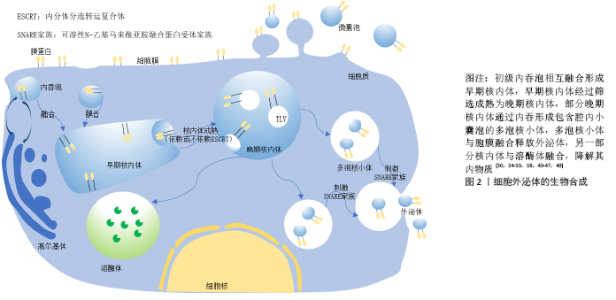
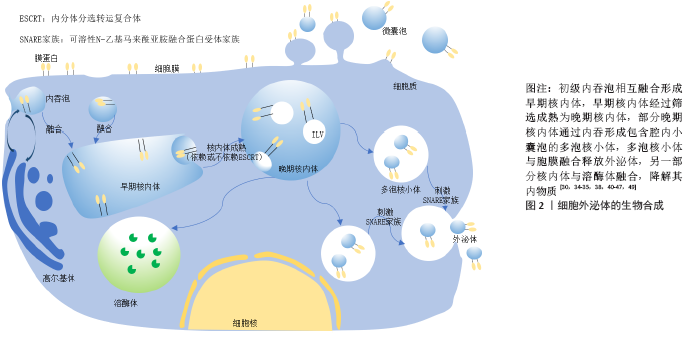
间充质干细胞的作用复杂多样,近年来间充质干细胞的免疫抑制作用成为研究热点。间充质干细胞可影响T细胞亚群分泌细胞因子以及抑制炎症反应,这使间充质干细胞可能在一些疾病治疗中发挥重要作用[30]。在新型冠状病毒肺炎的治疗中,间充质干细胞不仅参与肺部组织的修复,还通过对免疫系统的调控作用抑制细胞因子风暴的发生[31]。但是,间充质干细胞具有多分化潜能,存在形成肿瘤的风险,人们逐渐将目光放在有同样功效且风险更小的间充质干细胞来源外泌体上,希望其替代间充质干细胞发挥治疗作用。 2.2 外泌体的生成与分泌 细胞外囊泡是细胞主动释放的纳米级囊泡颗粒,可以根据其来源、大小与生物学特性分为3类:外泌体(40-200 nm)、微囊泡(100-1 000 nm)和凋亡小体 (1 000-3 000 nm)。通常情况下人们所指的胞外囊泡为外泌体和微囊泡,分别来自核内体系统和质膜[22]。由于对胞外囊泡鉴定方法说法不一,2014年国际胞外囊泡协会(ISEV)发表了胞外囊泡鉴定的最低标准,第一个标准要求分离样本为细胞外液体,也就是从条件培养基或体液中分离出来;其次要有典型的标记蛋白如CD9、CD63、CD81、Alix、TSG101等,胞外囊泡直径通常在50-1 000 nm之间[26,32-33]。外泌体主要呈圆形或椭圆形,杯口样[34],直径在40-200 nm之间[35]。机体内几乎所有细胞均能分泌外泌体,而间充质干细胞分泌外泌体的能力最强[36-39]。 外泌体是经核内体途径产生,另外在一些特定的、类似核内体的质膜区域也可以形成,但核内体起源是定义外泌体的常用标准[40]。 细胞质膜内翻后形成大量含母源细胞成分的初级内吞泡,这些内吞泡经过严格筛选相互融合后形成早期核内体,而这严格的筛选机制需要多种蛋白参与完成。内吞体分选复合体(endosomal sorting complex required for transport,ESCRT) 蛋白家族起到了重要作用,包括内吞体分选复合体0、内吞体分选复合体Ⅰ、内吞体分选复合体Ⅱ、内吞体分选复合体Ⅲ4个不同功能的蛋白质复合体。内吞体分选复合体是膜形成和断裂的引擎,以一定的顺序发挥功能,首先内吞体分选复合体0和内吞体分选复合体Ⅰ将泛素化的跨膜物质亚基限制在微囊泡的限制性区域内,同时膜结构发生挤压变形,溶血磷脂酸诱导膜内陷反向融合形成腔内囊泡,内吞体分选复合体Ⅱ作为招募所需物质的桥梁,内吞体分选复合体Ⅲ执行微区域萌芽和切割,这样初级内吞泡再一次内陷包裹细胞内物质形成多个腔内小囊泡,进一步转变成晚期核内体即多泡体[41]。这些多泡体随后在GTPase家族中的RAB酶调节下与胞膜融合以出芽方式向外释放形成外泌体[30],但仅有一部分晚期核内体能包裹腔内小囊泡进一步形成多泡体,更多的核内体倾向于与溶酶体融合而被降解。虽然多数研究认为腔内小囊泡的形成是内吞体分选复合体依赖模式,敲除内吞体分选复合体后,仍有外泌体的释放,这说明机体内存在依赖内吞体分选复合体模式,但仍需要四次跨膜蛋白家族的重要成员tetraspanins参与筛选囊泡内容物以及在CD63、鞘磷脂神经酰胺、热休克蛋白或单体GTP酶31(Rab31)的存在下,才能在膜上依靠自己的结构使膜的曲度发生改变。因此,腔内小囊泡的生成依赖与不依赖内吞体分选复合体途径,都需要多种复合体协同工作,而是否依赖于内吞体分选复合体途径取决于不同外泌体亚群[38,40-49],外泌体的生物合成过程见图2。"

2.3 外泌体的生物学特性及调控作用 外泌体表面具有特定的蛋白标志物,其内含物也极为丰富,如蛋白质、脂质、核酸等,这些生物活性物质根据其来源、内吞途径而有所不同。不同间充质干细胞来源外泌体在标志性蛋白表达上无差异,包括Alix、TSG101、CD9、CD81、CD63、CRR2、HSP70、MHC Ⅱ类等[10,14,43],外泌体内容物表达来源间充质干细胞的一些黏附分子,如CD29、CD44、CD73、CD90、CD105等,同时发挥来源间充质干细胞的特定作用。除了外泌体在内陷过程中精选的蛋白质,外泌体还富含RNA载体,以便所需RNA特异性优先在外泌体中积累。外泌体富含胆固醇、鞘磷脂和己糖神经酰胺等脂质成分[34],所含的这些脂质分子不仅参与外泌体的形态维持,也作为信号分子参与外泌体的信息传递,此外,胆固醇、氧甾醇、神经酰胺和脂质转运体被证明参与外泌体的产生[50-51]。外泌体内含核酸是与囊泡区分的重要标志,其内含核酸主要有DNA、mRNA和miRNA等。miRNA参与mRNA转录后调控,与胚胎发育、疾病发生以及免疫进程有关,细胞间的通信可能就是通过细胞间外泌体交换进行,例如miRNA的交换,目前研究发现介导免疫调节的miRNA有miR-146a、miR-181c、miR-375、miR-357等[52],在组织修复过程中调节炎症反应的有miR-21、miR-146a和miR-181等[53],如miR-21、miR-146a可以通过调控核因子κB对抗炎症反应[54]。不同干细胞来源外泌体所含miRNA也不相同,脂肪间充质干细胞来源外泌体中富含miR-486-5p、miR-10a-5p、miR-10b-5p、miR-191-5p和miR-222-3p,而骨髓间充质干细胞来源外泌体中miR-143-3p、miR-10b-5p、miR-486-5p、miR-22-3p、miR-21-5p的含量相对较多,见表2。另外,外泌体也含有少量的线粒体DNA(mtDNA)、piRNA、lncRNA、rRNA、snRNA、snoRNA和tRNA等[38],随着研究的深入,这些核酸的功能将会被逐渐阐明。"

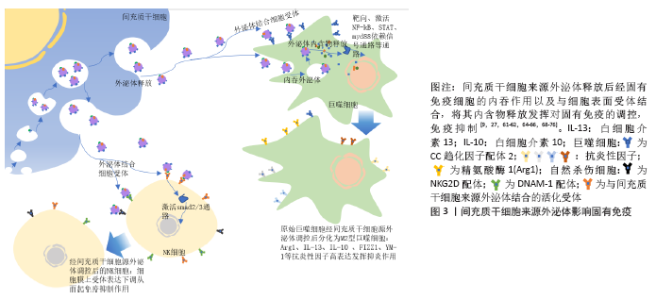
随着间充质干细胞在临床治疗的深入开展,间充质干细胞可能会产生细胞栓塞、异常分化甚至肿瘤形成等缺点也日益展现[8],如果相关基因表达丢失,会造成间充质干细胞的治疗潜力几乎丧失[55]。但研究人员在大鼠心肌缺血模型中发现:间充质干细胞来源外泌体对心肌细胞具有调控作用[56],在急性肾损伤研究中也发现骨髓间充质干细胞的培养上清与骨髓间充质干细胞具有相同作用,可以将药物带来的肾损伤降低到最小化,而且从培养上清中分离的外泌体同样可以抑制肾小管坏死。在肺动脉高压模型中,间充质干细胞培养上清分离的外泌体相对于对照组(成纤维细胞培养上清)发挥了更明显的保护作用[57]。这些结果证明,外泌体可能是间充质干细胞调控的主要介质,同时认为外泌体的调控作用可能是由RNA(外泌体携带的microRNA或mRNA)介导,同样也有报道认为是外泌体中蛋白的作用[10,58-59]。目前越来越多的文献证实了间充质干细胞来源外泌体具有与间充质干细胞相似的作用(免疫调节、抗炎、抗凋亡、促进组织细胞增殖再生作用等)。与间充质干细胞相比,外泌体没有细胞结构,其储备可能更经济更方便,临床应用更安全,甚至治疗效益更强[60-63]。 2.4 间充质干细胞来源外泌体的作用 间充质干细胞的调控作用主要依赖于外泌体的旁分泌途径。间充质干细胞通过趋化作用,将外泌体转运至目标靶点并发挥作用。间充质干细胞来源外泌体应用的优势有:①外泌体膜同样为脂质双分子层结构,通过其表面存在的信号分子进行信息传导,调节信号通路从而发挥作用;②间充质干细胞来源外泌体含有多种细胞因子、生长因子、代谢产物以及间充质干细胞自身产生的miRNAs,当外泌体与相应靶细胞膜融合后,外泌体内容物释放,以此对受体细胞进行信号调节;③外泌体可以通过释放内部的信号分子作用于细胞膜表面的受体发挥功能。 2.4.1 对固有免疫的调节作用 (1)对巨噬细胞的调节:巨噬细胞作为免疫细胞,在固有免疫中发挥极其重要的作用,其主要功能是吞噬并杀伤病原微生物、抗原提呈、介导特异性免疫应答、维持自身代谢稳定等。巨噬细胞具有在炎性因子诱导下进行分化即极化的特点,分为经典活化(M1型)和替代性活化巨噬细胞(M2型)。巨噬细胞在干扰素7和脂多糖等致炎因子刺激下极化为M1型巨噬细胞,产生包括白细胞介素(白细胞介素1、白细胞介素6)、诱导型一氧化氮合酶等在内的炎性因子和单核细胞趋化蛋白1、C-C基序2-4等趋化因子,介导炎症反应和Th1细胞的免疫应答。随着炎性因子和Th1细胞的过度产生,可导致自身免疫性疾病的发生,如细胞因子风暴综合征。M2型巨噬细胞通过释放精氨酸酶1、FIZZ1、YM-1、白细胞介素4、白细胞介素10和白细胞介素13等免疫调节因子在抗炎和修复过程中发挥作用。M2型巨噬细胞还通过吞噬凋亡的中性粒细胞以及与组织重塑和血管生成相关的介质,如转化生长因子β、血管内皮生长因子和表皮生长因子等促进炎症的消除。同时,M2型巨噬细胞亦支持Th2细胞的相关功能,因此在疾病中调节M1/M2型巨噬细胞的相互转化和存在比例尤为重要[64-65]。当间充质干细胞和巨噬细胞共培养时,间充质干细胞分泌外泌体向巨噬细胞转移,被巨噬细胞吞噬摄取[61],间充质干细胞来源外泌体主要通过以下途径对巨噬细胞进行调节:①miRNA的调控作用。当间充质干细胞受到刺激时,外泌体内miRNA的表达会发生显著变化,巨噬细胞吞噬外泌体后,外泌体miRNA靶向调节相应mRNA,并对巨噬细胞的极化进行调控,如miR-146a调控靶基因IRAK1、TRAF6、IRF5,miR-223调控靶基因Pknox1,miR-let-7c 调控靶基因C/EBP-δ,miR-30d-5p调控靶基因Beclin-1、Atg5,miR-451调控靶基因肿瘤坏死因子以及巨噬细胞迁移抑制因子,miR-181c抑制Toll样受体靶向TLR4、NF-κB等促进M2型巨噬细胞的转化生成[27,62,66-70]。②对CC趋化因子受体2 (CCR2)的竞争抑制作用。在机体发生炎性刺激时,单核巨噬细胞触发招募与活化,这种炎症反应可造成机体损伤,当单核细胞存在CC趋化因子受体2时,其与巨噬细胞表面表达的CC趋化因子配体2(CCL-2)结合,促进单核细胞迁移活化,从而进一步加深组织损伤。而间充质干细胞来源外泌体高表达CC趋化因子受体2,与CC趋化因子配体2竞争性结合,抑制巨噬细胞的招募活化,防止巨噬细胞聚集,使CC趋化因子配体2诱导的炎性细胞因子(白细胞介素6、肿瘤坏死因子α、白细胞介素1β等)表达降低,减少机体炎症反应导致的损伤[71]。③间充质干细胞来源外泌体对Toll样受体的诱导作用。当巨噬细胞摄取间充质干细胞来源外泌体后,通过外泌体识别Toll样受体3激活巨噬细胞myd88依赖信号通路诱导其分化为M2型细胞[72]。外泌体传递磷酸化的信号传导及转录激活蛋白3,信号传导及转录激活蛋白3与精氨酸酶1启动子结合,促进精氨酸酶1在M2型巨噬细胞的表达。在临床研究中发现,精氨酸酶1高表达的M2型巨噬细胞表达一种酪氨酸羟化酶,该酶是儿茶酚胺限速酶,其对心肾损伤恢复有一定作用,进而对组织修复起到了促进作用[9,61]。④间充质干细胞来源外泌体对细胞因子的调控。间充质干细胞来源外泌体可以减少炎性因子及趋化因子如CXC趋化因子配体10、单核细胞趋化蛋白1、CXC趋化因子配体9、蛋白酶组织抑制因子1等因子的积累。同时,间充质干细胞来源外泌体还可以下调M1型巨噬细胞炎症信号的表达,如CC趋化因子配体5、肿瘤坏死因子α、诱导型一氧化氮合酶、白细胞介素6和白细胞介素12等,上调M2型巨噬细胞抗炎性因子的表达如精氨酸酶1、白细胞介素13、白细胞介素10、FIZZ1、YM-1等[73]。 (2)对自然杀伤细胞的调节:自然杀伤细胞作为重要的效应细胞参与固有免疫,不仅与抗肿瘤、抗病毒感染和免疫调节有关,并且在特定条件下会参与超敏反应和自身免疫性疾病的发生,起到识别、杀伤靶细胞的作用。研究表明,间充质干细胞及其外泌体对自然杀伤细胞的增殖有抑制作用,抑制程度取决于自然杀伤细胞与间充质干细胞来源外泌体的数量比值,其通过抑制自然杀伤细胞表面标志物的表达,进而抑制自然杀伤细胞静息状态下的增殖活化,最终抑制了自然杀伤细胞毒性的发挥,但是对活化的自然杀伤细胞没有此作用[74]。间充质干细胞来源外泌体表面表达TSP1(潜在的转化生长因子β激活剂)、转化生长因子β、潜伏期相关肽,潜伏期相关肽与TSP1结合后在外泌体表面以活性形式释放,水解激活转化生长因子β,通过smad2/3通路抑制活化受体NKG2D与NKp30的mRNA表达,抑制自然杀伤细胞毒性。另外,携带ULBPS和MICA(NKG2D配体家族)、PVR以及 Nectin-2(DNAM-1配体)的间充质干细胞来源外泌体能够通过下调自然杀伤细胞上的受体表达从而起到免疫抑制作用。更有趣的是,间充质干细胞暴露于炎性环境时,HLA-Ⅰ、Ⅱ上调,使得自然杀伤细胞不易识别间充质干细胞,达到免疫逃避效果[75-76],见图3。"
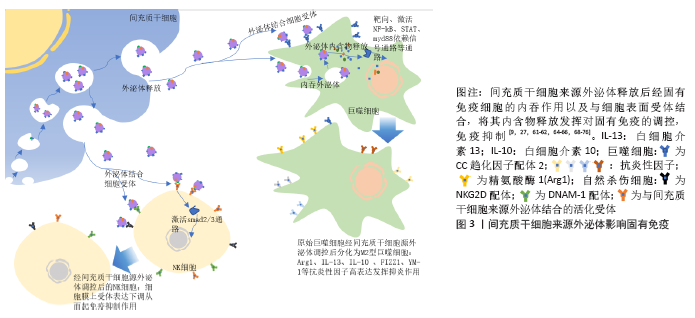
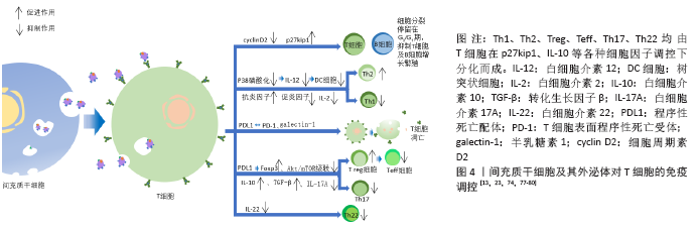
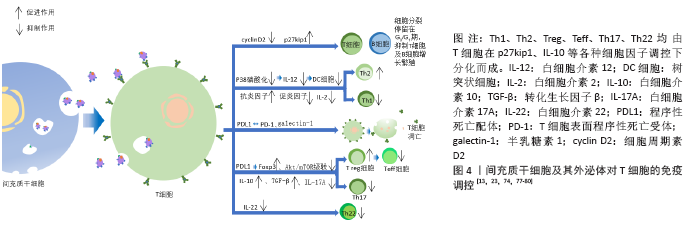
2.4.2 影响适应性免疫 (1)对T细胞的影响:间充质干细胞来源外泌体对淋巴细胞因子及T细胞增殖的调控。越来越多的研究证明,间充质干细胞及其来源外泌体有抑制淋巴细胞增殖和影响调节因子干扰素γ和干扰素7等分泌的作用,且此作用呈现浓度依赖性。与间充质干细胞或其来源外泌体共培养或孵育状态下,T细胞cyclin D2表达量下调,而p27kip1表达量上调,使T细胞停留在G0/G1期,阻止其进入S期,推测间充质干细胞及其外泌体通过影响T细胞的细胞周期抑制T细胞生长增殖[77-79]。①间充质干细胞来源外泌体对Th1细胞及Th2细胞的调控。 间充质干细胞来源外泌体与植物血凝素激活的T细胞共同培养后,炎性因子尤其是白细胞介素2的分泌明显下降,且Th1细胞的增殖明显受到抑制。有研究表明,同种异体抗原主要刺激T细胞中的Th1亚群分泌白细胞介素2,白细胞介素2又可以刺激T细胞增殖使Th1细胞数量增加,所以当白细胞介素2的分泌受到抑制,经同种异体抗原刺激后的Th亚群激活功能也明显受到抑制。T细胞分化为Th1细胞或Th2细胞很大程度取决于白细胞介素12及树突细胞的激活状态,间充质干细胞来源外泌体使白细胞介素12、MHCⅡ类分子、树突细胞共刺激分子表达量下降,有利于T细胞向Th2细胞转化[23,74,80]。②间充质干细胞及其外泌体对T细胞凋亡的影响。间充质干细胞及其外泌体通过表达程序性死亡配体及半乳糖素1诱导T细胞凋亡并促进T细胞增殖分化为Treg细胞。而相对于间充质干细胞仅能抑制成熟活化T细胞增殖,其外泌体对诱导凋亡更具有优势。程序性死亡配体与T细胞表面程序性死亡受体相互作用抑制T细胞增殖,而且半乳糖素1可以诱导已激活的T细胞凋亡[81]。③间充质干细胞及其外泌体对Treg细胞的促进作用。Treg细胞是一类具有免疫抑制功能的CD4+T细胞亚群,抑制效应T细胞的转化及免疫介导的组织损伤,发挥免疫耐受作用,对机体维持免疫稳态、发挥免疫调节及诱导外周免疫耐受具有重要影响。间充质干细胞来源外泌体能在体外诱导单核细胞株THP-1和外周单核细胞向Treg细胞分化,上调免疫抑制因子表达如白细胞介素10、转化生长因子β等,促进Treg细胞增殖,产生免疫抑制作用;其表达的免疫调节分子有程序性死亡配体、半乳糖素1和转化生长因子β,三者均是效应T细胞的负反馈调节分子。程序性死亡配体通过维持和增强Treg细胞中的Foxp3表达,促进Treg细胞分化并维持其功能,同时抑制Akt/mTOR信号级联,使初始T细胞向Treg细胞分化;转化生长因子β则是诱导Treg细胞分化的主要功能分子;而半乳糖素1如上文提到诱导T细胞凋亡。间充质干细胞来源外泌体仅在激活的免疫系统中发挥此作用,这就降低了间充质干细胞来源外泌体在治疗过程中遭到免疫系统排斥从而受损的风险[72,82-83]。④间充质干细胞及其外泌体对Th22细胞的抑制作用。Th22细胞(CD3+CD4+ IFN-γ-IL17-IL22+ T 细胞)是一种新发现的独立的CD4+T细胞亚群,在皮肤炎性疾病、肿瘤、特发性血小板减少性紫癜、风湿、类风湿和烧伤等疾病模型中,均发挥促进炎症产生的作用。间充质干细胞来源外泌体可显著抑制Th22细胞增殖,下调Th22细胞中白细胞介素22水平[13],见图4。 (2)对抗原提呈的影响:适应性免疫发挥作用依赖于抗原提呈以及免疫细胞本身的识别。树突细胞是抗原提呈能力最强的细胞,接受抗原刺激后可以大量表达MHC-Ⅱ的树突细胞能够通过对抗原的提呈从而刺激免疫细胞增殖活化。研究表明,在与间充质干细胞来源外泌体共同培养的条件下,未成熟的树突状细胞也可以表达成熟树突状细胞的标志物,造成迷惑现象。由此,间充质干细胞来源外泌体可以通过阻断树突状细胞的成熟,进而阻断抗原的提呈。间充质干细胞来源外泌体处理的树突细胞中白细胞介素4表达降低,转化生长因子β表达增加,而转化生长因子β表达增加可能会诱导调节性T细胞的分化,从而发挥免疫抑制作用。牙髓间充质干细胞来源外泌体处理的树突细胞中Toll样受体2、Toll样受体4及核因子κB的mRNA表达均显著增加,故认为牙髓间充质干细胞来源外泌体可能通过调控Toll样受体-核因子κB信号通路抑制树突细胞分化成熟。白细胞介素12对树突细胞的成熟起重要作用,而间充质干细胞使分泌白细胞介素12的信号通路(P38)磷酸化程度降低,从而抑制白细胞介素12的分泌,进而抑制树突细胞的成熟分化[4,16,80]。 2.4.3 再生功能 间充质干细胞来源外泌体与靶细胞结合后释放可溶性因子如生长因子、细胞因子、趋化因子及各种生物活性脂质(S1P、C1P、溶血磷脂酸等),可抑制靶细胞凋亡、刺激血管内皮细胞增殖、介导细胞表型改变。在应激反应期间,间充质干细胞来源外泌体中抗凋亡基因、血管生成素及调控基因表达增强,使外泌体具有抗凋亡、促进再生的功能。另外,间充质干细胞来源外泌体参与了某些细胞增殖,促进这些细胞周期蛋白D1表达水平增加。总之,在各种组织器官修复研究中发现其修复的特征为细胞增殖增加、基质合成增强以及再生免疫表型增多,推测该过程可能与不同信号通路激活有关[84-88]。 在对机体的各种调控中,基因表达调控占据了重要地位。随着间充质干细胞及其外泌体研究的逐步深入,人们发现外泌体通过携带miRNA参与细胞间通讯作用。通过miRNA比对可发现,不同间充质干细胞分泌的外泌体中miRNA表达变化不同,此应为不同间充质干细胞来源外泌体作用效果存在差异的原因[87]。 2.5 间充质干细胞来源外泌体的应用研究 间充质干细胞来源外泌体具备各种各样的生物作用,其临床应用前景十分广阔。目前主要与免疫调控及再生医学有关,许多疾病的发生发展都伴随着炎症反应的过激,导致免疫细胞比例失衡,从而造成不良预后。间充质干细胞来源外泌体的免疫抑制作用主要体现在对免疫细胞的调控以及影响炎性因子产生等方面。因此,间充质干细胞来源外泌体在自身免疫性疾病、移植物抗宿主反应以及损伤修复等方向具有极大的应用价值。 2.5.1 间充质干细胞来源外泌体与移植物抗宿主反应 由于自身免疫系统的激活,器官移植往往会产生排异反应即移植物抗宿主反应,有作者对1例类固醇难治性移植物抗宿主病患者的研究表明逐渐加大剂量给予患者骨髓间充质干细胞来源外泌体后,患者外周血单核细胞对细胞因子的反应与治疗前相比明显减弱,白细胞介素1β、肿瘤坏死因子α和干扰素γ表达减少50%以上,患者排异反应症状2周内明显改善[63]。对急性移植物抗宿主反应模型小鼠系统性输注人骨髓间充质干细胞来源外泌体,与对照组小鼠相比,其生存期延长,移植物抗宿主病症状得到改善,多个移植物抗宿主病靶向器官病理损伤减轻,同时体外研究证明T细胞的扩增与分化受到人骨髓间充质干细胞来源外泌体抑制,而Treg细胞以及非T细胞群包括B细胞、单核细胞等数量增加[8,63,89]。 2.5.2 间充质干细胞来源外泌体与系统性红斑狼疮 系统性红斑狼疮是一种免疫介导的弥散性结缔组织疾病,这种疾病能引起全身多器官损伤,对肾脏、关节以及免疫系统表现最明显。在狼疮小鼠模型体内输注骨髓间充质干细胞来源外泌体,能有效抑制过强的免疫反应,减少肾脏损伤以及保护关节完整性[90];ZHANG等[91]每周在骨损伤大鼠关节内注射间充质干细胞来源外泌体,在12周内能诱导软骨和软骨下骨的有序再生;BRUNO等[92]多次向肾损伤模型小鼠注射间充质干细胞来源外泌体,肾小管炎症受到抑制,血尿素氮和肌酐水平得到控制,小鼠存活率明显上升,关于间充质干细胞来源外泌体对肾损伤的研究表明,肾损伤模型动物的肾功能及结构均得到改善和保护,这依赖于间充质干细胞来源外泌体的抗炎作用[91-93]。 2.5.3 间充质干细胞来源外泌体与心血管疾病 心血管疾病是导致死亡及残疾的主要原因之一,越来越多的证据表明,间充质干细胞来源外泌体在受损心血管修复中发挥重要作用。ZHAO等[94]研究发现,小鼠缺血再灌注后将外泌体植入心脏一段时间后发现白细胞介素6表达下降而白细胞介素10表达上升,M1型巨噬细胞大量转变为M2型,心脏的炎症反应与对照组相比明显缓解。LAI等[39]在再灌注前给予小鼠静脉注射外泌体,小鼠心肌梗死面积大幅减少,心脏功能及氧化应激能力也有保留。在诱导的心肌梗死小鼠心脏中注射外泌体发现心肌细胞和纤维细胞可将外泌体内化,一段时间后发现成纤维细胞向肌成纤维细胞转化明显减少,毛细血管数量明显增多,这可能为间充质干细胞来源外泌体阻止心肌梗死后心肌重塑的原因。已经确认外泌体是间充质干细胞旁分泌的心脏保护成分,间充质干细胞来源外泌体除了能够减小心肌梗死面积、阻止心肌重塑、抑制炎症反应、增加血管生成外,还可以减少氧化应激、活化Akt和GSK3、抑制c-JNK等[94-97]。 2.5.4 间充质干细胞来源外泌体与神经性疾病 间充质干细胞来源外泌体可以穿过血脑屏障,与完整细胞相比更具有优势。据目前了解,神经退行性疾病阿尔茨海默病是由于β-淀粉样蛋白的产生和清除之间不平衡而在大脑中积累所致,Neprilvsin(NEP/CD10)作为大脑中最重要的β-淀粉样蛋白降解酶,可以作为治疗阿尔茨海默症的突破点。KATSUDA等[98]研究发现间充质干细胞来源外泌体表达具有酶活性的NEP,将间充质干细胞来源外泌体转移至富含β-淀粉样蛋白的神经母细胞瘤细胞中发现β-淀粉样蛋白含量降低。更有趣的是,脂肪间充质干细胞来源外泌体中NEP表达水平高于骨髓间充质干细胞来源,这为接下来疾病治疗中外泌体的选择提供依据[99]。LOPEZ-VERRILLI等[100]研究发现脑卒中大鼠静脉注射间充质干细胞来源外泌体,其神经细胞突起分支数量和长度均增加,轴突密度以及突触也增加,神经血管生成增加,大鼠运动能力逐渐恢复。XIAN等[101]发现间充质干细胞来源外泌体可显著降低脂多糖诱导的细胞毒性、反应性星形胶质细胞增生和炎症反应,改善脂多糖诱导的钙信号异常和线粒体功能障碍,间充质干细胞来源外泌体作用的发挥主要依赖于Nrf2-NF-κB通路。 2.5.5 外泌体的载体作用 外泌体具有靶向性、高稳定性、易于储存及低免疫原性以及逃避免疫识别和防止过早降解的能力,因此可作为理想的纳米载体运送药物至靶点进行疾病治疗,此方式在多种细胞外泌体研究中均有涉及。如B细胞源外泌体可作为载体将外源性miR-155模拟物或抑制剂导入肝细胞或巨噬细胞进行调控以治疗阿尔茨海默症。2020年暴发新型冠状病毒肺炎期间,在缺乏有效疫苗及特效药物的情况下,研究人员将间充质干细胞加入到治疗方案中,并得到了预期结果,但干细胞治疗仍存在未知风险,所以无细胞治疗将成为新的研究方向。在此之前,尽管间充质干细胞来源外泌体在肺部疾病的治疗效果得到肯定,但其在稳定性和功能性仍需进一步验证,所以对于间充质干细胞来源外泌体能否应用于新型冠状病毒肺炎的治疗仍待进一步研究[102-103]。"
| [1] LE BLANC K, RINGDÉN O. Immunobiology of human mesenchymal stem cells and future use in hematopoietic stem cell transplantation. Biol Blood Marrow Transplant. 2005;11(5):321-334. [2] RYAN JM, BARRY FP, MURPHY JM, et al. Mesenchymal stem cells avoid allogeneic rejection. J Inflamm (Lond). 2005;2:8. [3] SHAO L, ZHANG Y, LAN B, et al. MiRNA-Sequence Indicates That Mesenchymal Stem Cells and Exosomes Have Similar Mechanism to Enhance Cardiac Repair. Biomed Res Int. 2017;2017:4150705. [4] NAKAMURA Y, MIYAKI S, ISHITOBI H, et al. Mesenchymal-stem-cell-derived exosomes accelerate skeletal muscle regeneration. FEBS Lett. 2015;589(11):1257-1265. [5] ZHANG Y, CHOPP M, MENG Y, et al. Effect of exosomes derived from multipluripotent mesenchymal stromal cells on functional recovery and neurovascular plasticity in rats after traumatic brain injury. J Neurosurg. 2015;122(4):856-867. [6] KORDELAS L, REBMANN V, LUDWIG AK, et al. MSC-derived exosomes: a novel tool to treat therapy-refractory graft-versus-host disease. Leukemia. 2014;28(4):970-973. [7] NASSAR W, EL-ANSARY M, SABRY D, et al. Umbilical cord mesenchymal stem cells derived extracellular vesicles can safely ameliorate the progression of chronic kidney diseases. Biomater Res. 2016;20:21. [8] 蔡雨孜,崔换天,王丽,等.间充质干细胞外泌体作用机制的研究进展[J].天津中医药大学学报,2019,38(5):512-517. [9] SEO Y, KIM HS, HONG IS. Stem Cell-Derived Extracellular Vesicles as Immunomodulatory Therapeutics. Stem Cells Int. 2019;2019:5126156. [10] BÖRGER V, BREMER M, FERRER-TUR R, et al. Mesenchymal Stem/Stromal Cell-Derived Extracellular Vesicles and Their Potential as Novel Immunomodulatory Therapeutic Agents. Int J Mol Sci. 2017;18(7):1450. [11] 郭礼妍,赖沛龙,耿素霞,等.人脐带间充质干细胞来源外泌体对Treg和TH17细胞的调节作用[J].中国实验血液学杂志,2019,27(1): 221-226. [12] BIEBACK K, KERN S, KLÜTER H, et al. Critical parameters for the isolation of mesenchymal stem cells from umbilical cord blood. Stem Cells. 2004;22(4):625-634. [13] 李伟伟,李晓丰,侯萍,等.人脐带间充质干细胞外泌体可抑制Th22细胞的表达及功能[J].中国组织工程研究,2018,22(29):4657-4662. [14] 刘明,汪劲松,刘沐芸,等.人脐带间充质干细胞外泌体免疫调节功能的研究[J].中华医学杂志,2015,95(32):2630-2633. [15] 林庆铿,尹德宏,刘菊芬,等.第2代和第5代人脐带间充质干细胞外泌体miRNA谱的比较[J].中国组织工程研究,2018,22(17): 2686-2691. [16] LA ROCCA G, ANZALONE R, CORRAO S, et al. Isolation and characterization of Oct-4+/HLA-G+ mesenchymal stem cells from human umbilical cord matrix: differentiation potential and detection of new markers. Histochem Cell Biol. 2009;131(2):267-282. [17] MIAO Z, JIN J, CHEN L, et al. Isolation of mesenchymal stem cells from human placenta: comparison with human bone marrow mesenchymal stem cells. Cell Biol Int. 2006;30(9):681-687. [18] RAYNAUD CM, MALEKI M, LIS R, et al. Comprehensive characterization of mesenchymal stem cells from human placenta and fetal membrane and their response to osteoactivin stimulation. Stem Cells Int. 2012; 2012:658356. [19] CARLIN R, DAVIS D, WEISS M, et al. Expression of early transcription factors Oct-4, Sox-2 and Nanog by porcine umbilical cord (PUC) matrix cells. Reprod Biol Endocrinol. 2006;4:8. [20] TSAI MS, LEE JL, CHANG YJ, et al. Isolation of human multipotent mesenchymal stem cells from second-trimester amniotic fluid using a novel two-stage culture protocol. Hum Reprod. 2004;19(6):1450-1456. [21] IN ‘T ANKER PS, SCHERJON SA, KLEIJBURG-VAN DER KEUR C, et al. Amniotic fluid as a novel source of mesenchymal stem cells for therapeutic transplantation. Blood. 2003;102(4):1548-1549. [22] MUSHAHARY D, SPITTLER A, KASPER C, et al. Isolation, cultivation, and characterization of human mesenchymal stem cells. Cytometry A. 2018;93(1):19-31. [23] 赵霞,贺韦东,马秀明,等.骨髓间充质干细胞体外对T淋巴细胞分泌IL-2、IL-4功能的影响[J].中国免疫学杂志,2008,24(2):126-130. [24] PITTENGER MF, MACKAY AM, BECK SC, et al. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284(5411):143-147. [25] HUANG GT, GRONTHOS S, SHI S. Mesenchymal stem cells derived from dental tissues vs. those from other sources: their biology and role in regenerative medicine. J Dent Res. 2009;88(9):792-806. [26] LÖTVALL J, HILL AF, HOCHBERG F, et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. J Extracell Vesicles. 2014;3:26913. [27] 袁林,曹依娜,杨征毅,等.人颌骨间充质干细胞的外泌体在巨噬细胞调控中的作用[J].实用口腔医学杂志,2017,33(3):344-348. [28] HONG P, YANG H, WU Y, et al. The functions and clinical application potential of exosomes derived from adipose mesenchymal stem cells: a comprehensive review. Stem Cell Res Ther. 2019;10(1):242. [29] PENDLETON C, LI Q, CHESLER DA, et al. Mesenchymal stem cells derived from adipose tissue vs bone marrow: in vitro comparison of their tropism towards gliomas. PLoS One. 2013;8(3):e58198. [30] YU B, ZHANG X, LI X. Exosomes derived from mesenchymal stem cells. Int J Mol Sci. 2014;15(3):4142-4157. [31] BAMBA C, SINGH SP, CHOUDHURY S. Can mesenchymal stem cell therapy be the interim management of COVID-19? Drug Discov Ther. 2020;14(3):139-142. [32] BIAN S, ZHANG L, DUAN L, et al. Extracellular vesicles derived from human bone marrow mesenchymal stem cells promote angiogenesis in a rat myocardial infarction model. J Mol Med (Berl). 2014;92(4):387-397. [33] GOULD SJ, RAPOSO G. As we wait: coping with an imperfect nomenclature for extracellular vesicles. J Extracell Vesicles. 2013;2. [34] RAPOSO G, STOORVOGEL W. Extracellular vesicles: exosomes, microvesicles, and friends. J Cell Biol. 2013;200(4):373-383. [35] 林颖,胡锦章,颛孙永勋,等.骨髓间充质干细胞外泌体调节哮喘小鼠Foxp3+ Treg/Th17的平衡[J].中国组织工程研究,2018,22(17): 2637-2643. [36] HARDING C, HEUSER J, STAHL P. Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes. J Cell Biol. 1983;97(2):329-339. [37] PAN BT, TENG K, WU C, et al. Electron microscopic evidence for externalization of the transferrin receptor in vesicular form in sheep reticulocytes. J Cell Biol. 1985;101(3):942-948. [38] 缪着,卢福琼,马波,等.人间充质干细胞外泌体研究进展[J].中国医药生物技术,2019,14(4):361-365. [39] LAI RC, ARSLAN F, LEE MM, et al. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury. Stem Cell Res. 2010;4(3):214-222. [40] SIMONS M, RAPOSO G. Exosomes--vesicular carriers for intercellular communication. Curr Opin Cell Biol. 2009;21(4):575-581. [41] HURLEY JH. ESCRT complexes and the biogenesis of multivesicular bodies. Curr Opin Cell Biol. 2008;20(1):4-11. [42] HUOTARI J, HELENIUS A. Endosome maturation. EMBO J. 2011;30(17): 3481-3500. [43] COLOMBO M, RAPOSO G, THÉRY C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol. 2014;30:255-289. [44] RUSSELL MR, NICKERSON DP, ODORIZZI G. Molecular mechanisms of late endosome morphology, identity and sorting. Curr Opin Cell Biol. 2006;18(4):422-428. [45] WEI D, ZHAN W, GAO Y, et al. RAB31 marks and controls an ESCRT-independent exosome pathway. Cell Res. 2021;31(2):157-177. [46] VAN NIEL G, D’ANGELO G, RAPOSO G. Shedding light on the cell biology of extracellular vesicles. Nat Rev Mol Cell Biol. 2018;19(4):213-228. [47] GRUENBERG J, STENMARK H. The biogenesis of multivesicular endosomes. Nat Rev Mol Cell Biol. 2004;5(4):317-323. [48] XUNIAN Z, KALLURI R. Biology and therapeutic potential of mesenchymal stem cell-derived exosomes. Cancer Sci. 2020;111(9): 3100-3110. [49] JAN AT, RAHMAN S, KHAN S, et al. Biology, Pathophysiological Role, and Clinical Implications of Exosomes: A Critical Appraisal. Cells. 2019; 8(2):99. [50] DENG H, SUN C, SUN Y, et al. Lipid, Protein, and MicroRNA Composition Within Mesenchymal Stem Cell-Derived Exosomes. Cell Reprogram. 2018;20(3):178-186. [51] MAQSOOD M, KANG M, WU X, et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sci. 2020;256:118002. [52] 余思,刘尧,陈旭.间充质干细胞外泌体免疫调节作用及其机制的研究进展[J].中国医科大学学报,2018,47(10): 939-941,947. [53] FATIMA F, EKSTROM K, NAZARENKO I, et al. Non-coding RNAs in Mesenchymal Stem Cell-Derived Extracellular Vesicles: Deciphering Regulatory Roles in Stem Cell Potency, Inflammatory Resolve, and Tissue Regeneration. Front Genet. 2017;8:161. [54] 蔡昊,王强利,李涵,等.间充质干细胞来源的外泌体治疗心肌梗死的研究进展[J].生理科学进展,2019,50(2):99-103. [55] LEE RH, PULIN AA, SEO MJ, et al. Intravenous hMSCs improve myocardial infarction in mice because cells embolized in lung are activated to secrete the anti-inflammatory protein TSG-6. Cell Stem Cell. 2009;5(1):54-63. [56] GNECCHI M, HE H, LIANG OD, et al. Paracrine action accounts for marked protection of ischemic heart by Akt-modified mesenchymal stem cells. Nat Med. 2005;11(4):367-368. [57] LEE C, MITSIALIS SA, ASLAM M, et al. Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension. Circulation. 2012;126(22):2601-2611. [58] REIS LA, BORGES FT, SIMÕES MJ, et al. Bone marrow-derived mesenchymal stem cells repaired but did not prevent gentamicin-induced acute kidney injury through paracrine effects in rats. PLoS One. 2012;7(9):e44092. [59] SONG P, KWON Y, JOO JY, et al. Secretomics to Discover Regulators in Diseases. Int J Mol Sci. 2019;20(16):3893. [60] SPEES JL, LEE RH, GREGORY CA. Mechanisms of mesenchymal stem/stromal cell function. Stem Cell Res Ther. 2016;7(1):125. [61] ZHAO H, SHANG Q, PAN Z, et al. Exosomes From Adipose-Derived Stem Cells Attenuate Adipose Inflammation and Obesity Through Polarizing M2 Macrophages and Beiging in White Adipose Tissue. Diabetes. 2018; 67(2):235-247. [62] PHINNEY DG, DI GIUSEPPE M, NJAH J, et al. Mesenchymal stem cells use extracellular vesicles to outsource mitophagy and shuttle microRNAs. Nat Commun. 2015;6:8472. [63] FUJII S, MIURA Y, FUJISHIRO A, et al. Graft-Versus-Host Disease Amelioration by Human Bone Marrow Mesenchymal Stromal/Stem Cell-Derived Extracellular Vesicles Is Associated with Peripheral Preservation of Naive T Cell Populations. Stem Cells. 2018;36(3): 434-445. [64] 杨正弦,王涛,苗春木.巨噬细胞极化及其信号通路的研究进展[J].检验医学与临床,2019,16(15):2252-2255. [65] LASKIN DL, SUNIL VR, GARDNER CR, et al. Macrophages and tissue injury: agents of defense or destruction? Annu Rev Pharmacol Toxicol. 2011;51:267-288. [66] LO SICCO C, REVERBERI D, BALBI C, et al. Mesenchymal Stem Cell-Derived Extracellular Vesicles as Mediators of Anti-Inflammatory Effects: Endorsement of Macrophage Polarization. Stem Cells Transl Med. 2017;6(3):1018-1028. [67] SONG Y, DOU H, LI X, et al. Exosomal miR-146a Contributes to the Enhanced Therapeutic Efficacy of Interleukin-1β-Primed Mesenchymal Stem Cells Against Sepsis. Stem Cells. 2017;35(5):1208-1221. [68] ZHUANG G, MENG C, GUO X, et al. A novel regulator of macrophage activation: miR-223 in obesity-associated adipose tissue inflammation. Circulation. 2012;125(23):2892-2903. [69] BANERJEE S, XIE N, CUI H, et al. MicroRNA let-7c regulates macrophage polarization. J Immunol. 2013;190(12):6542-6549. [70] JIANG M, WANG H, JIN M, et al. Exosomes from MiR-30d-5p-ADSCs Reverse Acute Ischemic Stroke-Induced, Autophagy-Mediated Brain Injury by Promoting M2 Microglial/Macrophage Polarization. Cell Physiol Biochem. 2018;47(2):864-878. [71] SHEN B, LIU J, ZHANG F, et al. CCR2 Positive Exosome Released by Mesenchymal Stem Cells Suppresses Macrophage Functions and Alleviates Ischemia/Reperfusion-Induced Renal Injury. Stem Cells Int. 2016;2016:1240301. [72] ZHANG B, YIN Y, LAI RC, et al. Mesenchymal stem cells secrete immunologically active exosomes. Stem Cells Dev. 2014;23(11):1233-1244. [73] WILLIS GR, FERNANDEZ-GONZALEZ A, ANASTAS J, et al. Mesenchymal Stromal Cell Exosomes Ameliorate Experimental Bronchopulmonary Dysplasia and Restore Lung Function through Macrophage Immunomodulation. Am J Respir Crit Care Med. 2018;197(1):104-116. [74] 韩睿,李琳,王润清,等.间充质干细胞来源外泌体对免疫功能调控的作用与应用前景[J].中国组织工程研究,2019,23(17):2762-2769. [75] FaN Y, HERR F, VERNOCHET A, et al. Human Fetal Liver Mesenchymal Stem Cell-Derived Exosomes Impair Natural Killer Cell Function. Stem Cells Dev. 2019;28(1):44-55. [76] SPAGGIARI GM, CAPOBIANCO A, BECCHETTI S, et al. Mesenchymal stem cell-natural killer cell interactions: evidence that activated NK cells are capable of killing MSCs, whereas MSCs can inhibit IL-2-induced NK-cell proliferation. Blood. 2006;107(4):1484-1490. [77] 杨向荣,丁娟,徐正阳,等.人脐带间充质干细胞来源外泌体的生物学特性研究[J].华中科技大学学报(医学版),2016,45(2):154-159. [78] 冯影,卢士红,王昕,等.人骨髓来源间充质干细胞分泌外泌体特性研究[J].中国实验血液学杂志,2014,22(3):595-599. [79] GLENNIE S, SOEIRO I, DYSON PJ, et al. Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells. Blood. 2005; 105(7):2821-2827. [80] JIANG XX, ZHANG Y, LIU B, et al. Human mesenchymal stem cells inhibit differentiation and function of monocyte-derived dendritic cells. Blood. 2005;105(10):4120-4126. [81] RABINOVICH GA, ALONSO CR, SOTOMAYOR CE, et al. Molecular mechanisms implicated in galectin-1-induced apoptosis: activation of the AP-1 transcription factor and downregulation of Bcl-2. Cell Death Differ. 2000;7(8):747-753. [82] FRANCISCO LM, SALINAS VH, BROWN KE, et al. PD-L1 regulates the development, maintenance, and function of induced regulatory T cells. J Exp Med. 2009;206(13):3015-3029. [83] DEL FATTORE A, LUCIANO R, PASCUCCI L, et al. Immunoregulatory Effects of Mesenchymal Stem Cell-Derived Extracellular Vesicles on T Lymphocytes. Cell Transplant. 2015;24(12):2615-2627. [84] 张莉珊,曾勉.间充质干细胞来源外泌体治疗急性肺损伤的作用机制[J].中国组织工程研究,2019,23(29):4714-4721. [85] RATAJCZAK MZ, KUCIA M, JADCZYK T, et al. Pivotal role of paracrine effects in stem cell therapies in regenerative medicine: can we translate stem cell-secreted paracrine factors and microvesicles into better therapeutic strategies? Leukemia. 2012;26(6):1166-1173. [86] MANSOOR H, ONG HS, RIAU AK, et al. Current Trends and Future Perspective of Mesenchymal Stem Cells and Exosomes in Corneal Diseases. Int J Mol Sci. 2019;20(12):2853. [87] 张恩国,陈尚雅,杨叶,等.干细胞源外泌体应用于再生医学的研究进展[J].中国组织工程研究,2018,22(5):801-806. [88] KIM S, LEE SK, KIM H, et al. Exosomes Secreted from Induced Pluripotent Stem Cell-Derived Mesenchymal Stem Cells Accelerate Skin Cell Proliferation. Int J Mol Sci. 2018;19(10):3119. [89] PEREZ-HERNANDEZ J, REDON J, CORTES R. Extracellular Vesicles as Therapeutic Agents in Systemic Lupus Erythematosus. Int J Mol Sci. 2017;18(4):717. [90] LIU S, LIU D, CHEN C, et al. MSC Transplantation Improves Osteopenia via Epigenetic Regulation of Notch Signaling in Lupus. Cell Metab. 2015; 22(4):606-618. [91] ZHANG S, CHU WC, LAI RC, et al. Exosomes derived from human embryonic mesenchymal stem cells promote osteochondral regeneration. Osteoarthritis Cartilage. 2016;24(12):2135-2140. [92] BRUNO S, GRANGE C, COLLINO F, et al. Microvesicles derived from mesenchymal stem cells enhance survival in a lethal model of acute kidney injury. PLoS One. 2012;7(3):e33115. [93] LIN KC, YIP HK, SHAO PL, et al. Combination of adipose-derived mesenchymal stem cells (ADMSC) and ADMSC-derived exosomes for protecting kidney from acute ischemia-reperfusion injury. Int J Cardiol. 2016;216:173-185. [94] ZHAO J, LI X, HU J, et al. Mesenchymal stromal cell-derived exosomes attenuate myocardial ischaemia-reperfusion injury through miR-182-regulated macrophage polarization. Cardiovasc Res. 2019;115(7): 1205-1216. [95] LI J, XUE H, LI T, et al. Exosomes derived from mesenchymal stem cells attenuate the progression of atherosclerosis in ApoE-/- mice via miR-let7 mediated infiltration and polarization of M2 macrophage. Biochem Biophys Res Commun. 2019;510(4):565-572. [96] TENG X, CHEN L, CHEN W, et al. Mesenchymal Stem Cell-Derived Exosomes Improve the Microenvironment of Infarcted Myocardium Contributing to Angiogenesis and Anti-Inflammation. Cell Physiol Biochem. 2015;37(6):2415-2424. [97] SUZUKI E, FUJITA D, TAKAHASHI M, et al. Therapeutic Effects of Mesenchymal Stem Cell-Derived Exosomes in Cardiovascular Disease. Adv Exp Med Biol. 2017;998:179-185. [98] KATSUDA T, TSUCHIYA R, KOSAKA N, et al. Human adipose tissue-derived mesenchymal stem cells secrete functional neprilysin-bound exosomes. Sci Rep. 2013;3:1197. [99] HA DH, KIM HK, LEE J, et al. Mesenchymal Stem/Stromal Cell-Derived Exosomes for Immunomodulatory Therapeutics and Skin Regeneration. Cells. 2020;9(5):1157. [100] LOPEZ-VERRILLI MA, CAVIEDES A, CABRERA A, et al. Mesenchymal stem cell-derived exosomes from different sources selectively promote neuritic outgrowth. Neuroscience. 2016;320:129-139. [101] XIAN P, HEI Y, WANG R, et al. Mesenchymal stem cell-derived exosomes as a nanotherapeutic agent for amelioration of inflammation-induced astrocyte alterations in mice. Theranostics. 2019;9(20):5956-5975. [102] MOMEN-HERAVI F, BALA S, BUKONG T,et al. Exosome-mediated delivery of functionally active miRNA-155 inhibitor to macrophages. Nanomedicine. 2014;10(7):1517-1527. [103] PINKY, GUPTA S, KRISHNAKUMAR V, et al. Mesenchymal Stem Cell Derived Exosomes: a Nano Platform for Therapeutics and Drug Delivery in Combating COVID-19. Stem Cell Rev Rep. 2021;17(1):33-43. [104] DEL FATTORE A, LUCIANO R, SARACINO R, et al. Differential effects of extracellular vesicles secreted by mesenchymal stem cells from different sources on glioblastoma cells. Expert Opin Biol Ther. 2015; 15(4):495-504. [105] ZHU W, HUANG L, LI Y, et al. Exosomes derived from human bone marrow mesenchymal stem cells promote tumor growth in vivo. Cancer Lett. 2012;315(1):28-37. |
| [1] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1316-1322. |
| [2] | Xiao Hao, Liu Jing, Zhou Jun. Research progress of pulsed electromagnetic field in the treatment of postmenopausal osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1323-1329. |
| [3] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1330-1335. |
| [4] | Tian Chuan, Zhu Xiangqing, Yang Zailing, Yan Donghai, Li Ye, Wang Yanying, Yang Yukun, He Jie, Lü Guanke, Cai Xuemin, Shu Liping, He Zhixu, Pan Xinghua. Bone marrow mesenchymal stem cells regulate ovarian aging in macaques [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 985-991. |
| [5] | Hou Jingying, Guo Tianzhu, Yu Menglei, Long Huibao, Wu Hao. Hypoxia preconditioning targets and downregulates miR-195 and promotes bone marrow mesenchymal stem cell survival and pro-angiogenic potential by activating MALAT1 [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1005-1011. |
| [6] | Zhou Ying, Zhang Huan, Liao Song, Hu Fanqi, Yi Jing, Liu Yubin, Jin Jide. Immunomodulatory effects of deferoxamine and interferon gamma on human dental pulp stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1012-1019. |
| [7] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [8] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1137-1142. |
| [9] | Liang Xuezhen, Yang Xi, Li Jiacheng, Luo Di, Xu Bo, Li Gang. Bushen Huoxue capsule regulates osteogenic and adipogenic differentiation of rat bone marrow mesenchymal stem cells via Hedgehog signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1020-1026. |
| [10] | Wang Jifang, Bao Zhen, Qiao Yahong. miR-206 regulates EVI1 gene expression and cell biological behavior in stem cells of small cell lung cancer [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1027-1031. |
| [11] | Liu Feng, Peng Yuhuan, Luo Liangping, Wu Benqing. Plant-derived basic fibroblast growth factor maintains the growth and differentiation of human embryonic stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1032-1037. |
| [12] | Wen Dandan, Li Qiang, Shen Caiqi, Ji Zhe, Jin Peisheng. Nocardia rubra cell wall skeleton for extemal use improves the viability of adipogenic mesenchymal stem cells and promotes diabetes wound repair [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1038-1044. |
| [13] | Wang Xinmin, Liu Fei, Xu Jie, Bai Yuxi, Lü Jian. Core decompression combined with dental pulp stem cells in the treatment of steroid-associated femoral head necrosis in rabbits [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1074-1079. |
| [14] | Fang Xiaolei, Leng Jun, Zhang Chen, Liu Huimin, Guo Wen. Systematic evaluation of different therapeutic effects of mesenchymal stem cell transplantation in the treatment of ischemic stroke [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1085-1092. |
| [15] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1102-1106. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||