Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (36): 5889-5896.doi: 10.12307/2022.715
Previous Articles Next Articles
Active components of flemingia in regulating the signaling pathways related to knee osteoarthritis
Lin Zhiyu, Han Jie, Ren Guowu, Chai Yuan, Wen Shuaibo, Wu Yukun, Xie Xiaozhong, Jin Wanqing
- Department of Joint and Sports Medicine, Ruikang Hospital Affiliated to Guangxi University of Traditional Chinese Medicine, Nanning 530011, Guangxi Zhuang Autonomous Region, China
-
Received:2021-11-02Accepted:2021-12-15Online:2022-12-28Published:2022-04-28 -
Contact:Han Jie, Master, Chief physician, Department of Joint and Sports Medicine, Ruikang Hospital Affiliated to Guangxi University of Traditional Chinese Medicine, Nanning 530011, Guangxi Zhuang Autonomous Region, China -
About author:Lin Zhiyu, Master candidate, Department of Joint and Sports Medicine, Ruikang Hospital Affiliated to Guangxi University of Traditional Chinese Medicine, Nanning 530011, Guangxi Zhuang Autonomous Region, China -
Supported by:the Health and Family Planning Commission Project of Guangxi Zhuang Autonomous Region of China, No. S2019070 (to HJ); the Preparation Quality Improvement Project of Zhuang Yao Medicine Hospital of Guangxi Zhuang Autonomous Region Administration of Traditional Chinese Medicine, No. GZZJ202011 (to HJ); the University Young and Middle-Aged Teachers Scientific Research Basic Ability Improvement Project of Guangxi Zhuang Autonomous Region of China, No. 2020KY07017 (to HJ)
CLC Number:
Cite this article
Lin Zhiyu, Han Jie, Ren Guowu, Chai Yuan, Wen Shuaibo, Wu Yukun, Xie Xiaozhong, Jin Wanqing. Active components of flemingia in regulating the signaling pathways related to knee osteoarthritis[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(36): 5889-5896.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
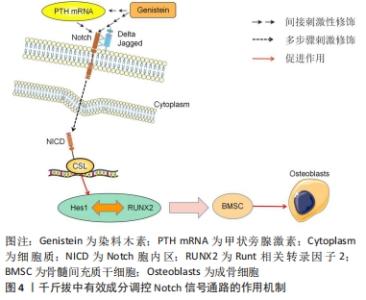
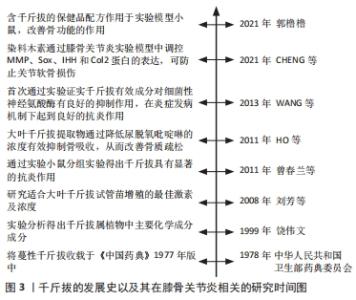
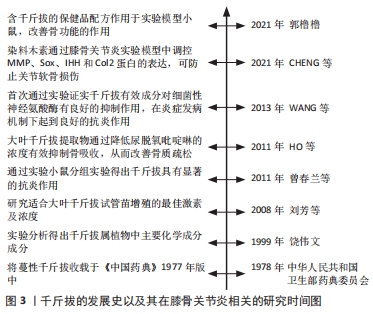
2.2 千斤拔有效成分调控膝骨关节炎发病机制相关因子与骨组织工程关系 文章此前已提到膝骨关节炎的发病机制主要为炎症、成骨细胞分化以及软骨细胞凋亡,其机制下相关的因子主要有骨髓间充质干细胞、Runt相关转录因子2(runt related transcription factor 2,RUNX2)、基质金属蛋白酶、解聚蛋白多糖酶、白细胞介素1β、白细胞介素6及肿瘤坏死因子α等。有文献表明通过调控上述细胞因子,能对膝骨关节炎的炎症及软骨破坏起到良好的改善以及修复作用[16-18]。同时千斤拔中有效成分能通过相关信号通路调控上述因子,在炎症、软骨细胞凋亡以及成骨细胞增殖分化的机制下发挥作用。近年来,随着骨组织工程的快速发展,学者们对骨科疾病的认知及后续诊疗都有了新的见解,例如对细胞外基质在骨科领域的研究使得研究者们从细胞层面上更加深入地了解其机制[19]。总之,千斤拔能在与骨组织工程关系密切的机制下减轻炎症、对软骨损伤起到修复作用,进而改善膝骨关节炎病情进展,但现阶段尚未发现有关千斤拔与相关骨组织材料共同治疗膝骨关节炎的详细研究。 2.3 千斤拔有效成分调控相关信号通路对膝骨关节炎的影响 2.3.1 Notch信号通路 此通路是由包括4个受体(Notch1,2,3,4)、5个配体(Deltal,3,4以及Jagged1,2)及CSL(CBF-1,suppressor of hairless,Lag的合称)蛋白组成的、具有进化高度保守的、广泛作用于无脊椎动物与有脊椎动物之间、并通过对该途径中受体与配体之间相互刺激,从而对软骨细胞表现型的维持、对基质降解及软骨细胞增殖与凋亡的调节来决定软骨细胞命运转归的一条信号通路[20]。目前研究证实,在膝骨关节炎发展过程中,当瞬间激活Notch信号通路时会促进其关节基质的代谢率,进而保护关节,对膝骨关节炎进程起到缓解作用,但该通路的持续作用则会降低膝骨关节炎的预后情况[21]。同时在此通路中,位于细胞表面的Notch受体和跨膜配体在细胞外区域相互刺激,在γ-分泌酶等作用下行3次剪切,最终令Notch胞内区(Notch intracellular domain,NICD)在细胞质中释放,随后将其转移至细胞核并和CSL蛋白结合,成为NICD/CSL复合体,再加入到目标基因转录当中,从而激活该信号传导通路下游如Hes/Hey家族中靶基因的表达,最终开展其一系列胞内事件[22]。 抑凋亡因子Bcl-2与促凋亡因子Bax是2个细胞凋亡存在密切关系的2个重要因子[23]。吴绍军等[24]通过相关实验得出,下调Notch信号表达可提高Bcl-2的表达,同时抑制Bax的表达水平,可显著加快骨组织早期发育及骨缺损修复的进程,促进骨和软骨的生成,从而对软骨细胞凋亡起到抑制作用,有效保护膝骨关节炎软骨。陈德胜等[25]通过对48例老年膝骨关节炎患者进行临床试验,得出观察组中Notch信号途径内的Notch1与Jagged1阳性细胞率的表达量显著高于对照组,且相对于正常人的关节软骨,膝骨关节炎患者的关节软骨中Notch信号通路被激活,使得Notch1及Jagged1与靶基因Hes5表达量增加,这表明Notch信号传导通路中Notch1与Jagged1跟膝骨关节炎软骨退行性改变存在一定程度的正相关性。薛太阳等[26]对造模大鼠膝关节注射γ-分泌酶抑制剂(DAPT)以干预Notch信号通路,并通过分析实验中各组软骨细胞中基质金属蛋白酶13及Ⅱ型胶原蛋白的表达水平后表明,膝骨关节炎的严重程度与基质金属蛋白酶13表达水平呈一定程度的正相关性,但与Ⅱ型胶原蛋白的表达水平呈一定程度的负相关性;对该通路进行抑制后,基质金属蛋白酶13的表达水平降低,而Ⅱ型胶原蛋白的破坏量减少,对膝骨关节炎软骨破坏起到缓解的作用。 来源于骨髓的间充质干细胞具有较强的增殖能力,在膝骨关节炎进程中起到成骨分化的重要作用[27]。王维东等[14]通过实验得出内源性甲状旁腺激素的缺失存在影响骨髓间充质干细胞往成骨细胞分化方向发展的可能性。宋晓庆等[28]表明染料木素可通过对甲状旁腺激素/甲状旁腺素受体1(parathyroid hormone/parathyroid hormone receptor 1,PTH/PTHR1)表达的提高,使位于Notch信号传导通路下游的Hes1蛋白和RUNX2之间的作用效果显著增强,从而对成骨细胞分化起到促进作用,进一步推测出染料木素通过对甲状腺激素 mRNA以及相关蛋白表达的调节,进而提高Notch信号通路内的Jagged1配体与Notch1受体表达水平,从而促进Hes1与RUNX2相互作用,最终达到推动骨髓间充质干细胞往成骨细胞分化发展的目的,见图4。 "
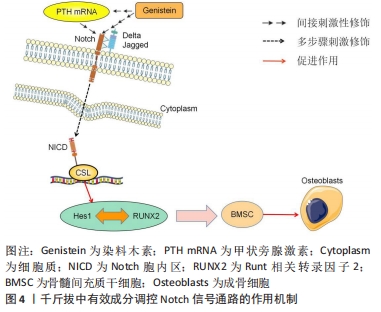
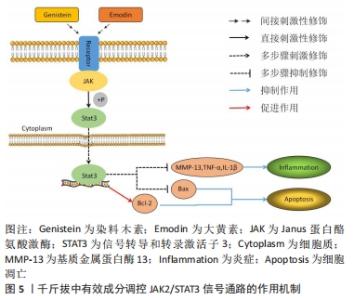
千斤拔中有效成分之一的染料木素,能通过与膝骨关节炎相关的Notch有效调控骨髓间充质干细胞,从而对膝骨关节炎中骨与软骨的损伤起到一定程度的修复作用,但千斤拔中有效成分通过相关信号通路在成骨增殖分化机制领域的研究仍存在较大的空缺,故千斤拔在此基础下阐述其通过药理作用以及与骨修复材料联合治疗膝骨关节炎的领域仍有较大的研究空间,同时日后也可以将其作为千斤拔单独或联合相关骨组织材料治疗膝骨关节炎的研究重点,通过传统中药提纯分析等手段分离出主要成分联合现代医学技术治疗疾病,能为世界医学水平发展起到积极作用。 2.3.2 JAK2/STAT3信号通路 JAK2/STAT3信号传导通路是由JAK、JAK相关受体及STAT共3个部分组成。作为STAT家族中的一名成员,STAT3在对炎症和免疫相关的蛋白中具有至关重要的地位[29]。现阶段研究表明,该通路与多条信号通路在膝骨关节炎炎性反应进程中均起到了重要作用,且其与膝骨关节炎软骨退行性变的病理过程关系紧密。LU等[30]发现,在骨性关节炎软骨细胞中JAK2/STAT3信号传输途径被异常激活。随着JAK2在刺激下被激活,STAT3的募集也随之启动;STAT3磷酸化后的复合物从细胞质到细胞核进行易位,从而激发骨性关节炎相关信号的转导。JAK2/STAT3信号通路经细胞因子激活后,主要将源于细胞外,且经过一系列反应的化学信号后转输到细胞核处,导致与细胞增殖分化、凋亡、炎症反应等诸多具有关键基因DNA的转录与生物学方面的表达,同时其在膝骨关节炎软骨细胞代谢、膝骨关节炎滑膜及血清中起到了降低炎症损伤的作用[4]。贺娟娟等[21]发现,通过激活JAK2/STAT3信号通路,可提升软骨细胞内线粒体的抗氧化能力,改善关节软骨退行性变,对膝骨关节炎病情进程起到减轻作用。房家康等[31]发现,作为调控白细胞介素1β、白细胞介素6及肿瘤坏死因子α等对软骨细胞造成损伤的促进炎症细胞因子的重要信号通路之一,激活该途径可加快软骨损伤进程,而阻断其可对软骨起到保护作用。李亮等[32]发现细胞因子信号抑制物可通过该信号传导通路对白细胞介素1及肿瘤坏死因子α起到抑制作用。 与吴绍军等[24]的实验结论相同,胡炯等[33]在膝骨关节炎大鼠模型中利用染料木素调控JAK2/STAT3信号通路,观察其对膝骨关节炎软骨代谢的作用,发现染料木素对膝骨关节炎关节软骨中Bcl-2表达起到了显著的提升作用,同时能有效下调Bax表达水平,对膝骨关节炎软骨细胞凋亡起到抑制作用。同时,染料木素还能通过该通路降低基质金属蛋白酶13与肿瘤坏死因子α的表达,对膝骨关节炎炎症反应起到了显著的抑制作用;以减缓关节软骨退行性变进程,从而有效控制膝骨关节炎病情进程。孟亮等[34]利用大黄素干预白细胞介素1β所诱导的血管平滑肌群中细胞的增殖,得出大黄素通过JAK2/STAT3信号途径干预后降低白细胞介素1β表达水平,这表明大黄素可能通过调控该通路使白细胞介素1β表达降低,在膝骨关节炎中可起到一定程度的抗炎作用,见图5。 "
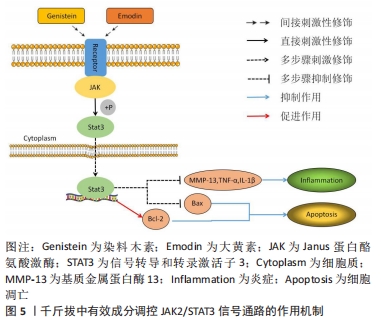
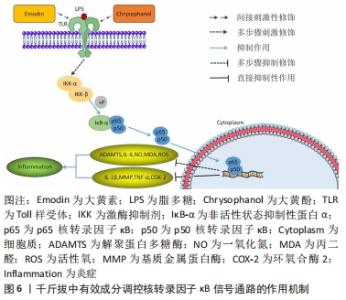
染料木素可以通过调控Bcl-2及Bax与细胞凋亡相关的因子以及基质金属蛋白酶13和肿瘤坏死因子α的相关表达,从而起到抑制细胞凋亡及抗炎的作用,这对关节内环境以及软骨细胞的破坏程度都有不错的改善作用。从中可得知,染料木素可通过调控Notch及JAK2/STAT3信号轴对Bcl-2、Bax两个与细胞凋亡较为亲密的因子产生同样的作用,其中是否存在同时作用或相互作用等可能性,则仍需后续进一步研究。而千斤拔中另一有效成分——大黄素则可通过JAK2/STAT3信号传导通路调控白细胞介素1β,对膝骨关节炎炎症的改善有一定作用。染料木素与大黄素是千斤拔有效成分中实验药理方面研究较多的两种成分,其对炎性因子调控的研究也较为完善,继续深入研究,探究出其与外部材料联合治疗的最佳兼容性,有利于通过药物与体外材料联合治疗相关疾病在临床中进行推广。 2.3.3 核转录因子κB信号通路 核转录因子κB家族成员包括核转录因子κB1(p50)、核转录因子κB2(p52)、RelA(p65)、RelB及c-Rel,其对基因表达及多种细胞起到调控作用[35]。现阶段核转录因子κB信号通路是膝骨关节炎在软骨生理病理学当中诸多炎症机制的常见最终信号传导通路,起到调控软骨细胞增殖分化、凋亡及保持软骨细胞稳定形态的作用[36-38]。核转录因子κB信号途径激活后,可上调促炎基因的表达,增加如肿瘤坏死因子、白细胞介素1β等促炎物质的生成,使炎性反应增加,最终发生软骨的降解以及关节软骨的损伤[39]。同时,核转录因子κB以非活性状态抑制性蛋白-α(IκB-α)这类抑制性亚基相关并存于细胞质中,激酶抑制剂-β(IKK-β)能对其进行严格监控,在促炎细胞因子诱导下,激活该信号传导通路,使IKK-β激活,从而核转录因子κB通过IκB-α磷酸化能从细胞质运输到细胞核,继而刺激炎症等相关基因表达,其中包括白细胞介素6、肿瘤坏死因子α、环氧合酶2、基质金属蛋白酶及解聚蛋白多糖酶等[40]。LIU等[41]发现,随着膝骨关节炎病理的不断加重,核转录因子κB、基质金属蛋白酶13、Toll样受体2(Toll-like receptors-2,TLR-2)等炎性因子的表达亦会随之上升。核转录因子κB通路通过对低氧诱导因子2α的诱导,从而上调软骨细胞中基质金属蛋白酶13的表达,其中基质金属蛋白酶13表达的升高对膝骨关节炎病情进程起到重要作用。总而言之,核转录因子κB信号通路对软骨基质的重塑、软骨细胞的凋亡、滑膜炎症等均产生影响,而且能起到刺激末端软骨细胞生成分化的下游调控因子等间接作用[42],这对膝骨关节炎的炎症反应以及疾病的发生发展均产生重要作用。 贺娟娟等[21]发现,通过使用活血化瘀类中药能对核转录因子κB信号通路表达起到良好的抑制作用,并在该通路与炎性因子的协同作用下,能进一步降低膝骨关节炎患肢关节腔内的白细胞介素1β、白细胞介素6及肿瘤坏死因子α等炎性因子的生成,从而对患肢的疼痛及病情起到缓解作用。WEN等[43]证明了大黄酚可有效下调核转录因子κB的转录和磷酸化,降低白细胞介素1β及肿瘤坏死因子α等促炎细胞因子,由此减轻由脂多糖诱导的炎症,说明大黄酚对炎性因子的表达起到了良好的抑制作用,其抗炎效果较佳。SU等[44]发现大黄酚对磷酸化核转录因子κB p65、白细胞介素1β、白细胞介素6及肿瘤坏死因子α等的超表达具有显著的抑制作用,同时通过调控白细胞介素6、肿瘤坏死因子α、环氧合酶2等对脂多糖诱导的核转录因子κB的活化起到抑制作用,从而显著下降炎症递质的表达和减轻临床症状。HWANG等[45]已经证明,大黄素能通过抑制核转录因子κB活性,进而抑制如白细胞介素1β和肿瘤坏死因子α等相关炎性因子,起到抗炎作用,这可能是通过核转录因子κB信号传导途径实现这一作用。DING等[46]通过实验得出,大黄素通过抑制IKK-β,下调IκB-α的降解,对p65的激活起到减弱作用。因此可以推测出大黄素能通过抑制核转录因子κB信号通路,下调基质金属蛋白酶及解聚蛋白多糖酶的表达水平,表明大黄素在膝骨关节炎抗炎方面起到一定的作用。孙攀兴等[47]通过实验证实,大黄素通过对TLR4/核转录因子κB信号途径的抑制,能够使p65的表达水平及白细胞介素6、肿瘤坏死因子α等炎性因子的释放水平有所降低,同时下调一氧化氮、丙二醛以及活性氧在血管内皮细胞中的表达,最终起到抗炎等作用。YUAN等[48]证实染料木素能在炎性疾病中通过下调抑制白细胞介素1β、肿瘤坏死因子α所介导的核转录因子κB信号传导途径,降低p65及炎性因子的表达水平,从而对软骨损伤起到良好的修复作用,且这一作用呈正向的剂量依赖性关系。LIU等[49]发现染料木素能下调环氧合酶2的表达,而部分环氧合酶2的合成来自于核转录因子κB信号途径,故可能染料木素对环氧合酶2的抑制作用有部分是通过核转录因子κB通路实现,从而达到抗炎的目的。同样,HU等[50]证实染料木素的衍生物——染料木素27通过显著下调由脂多糖诱导的RAW264.7细胞中的核转录因子κB通路,最终起到良好的抗炎作用,见图6。 "
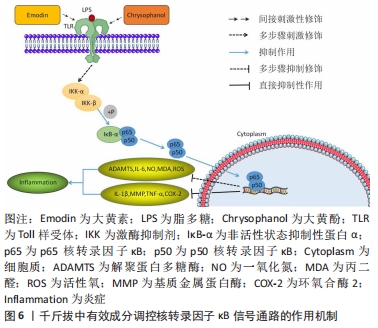
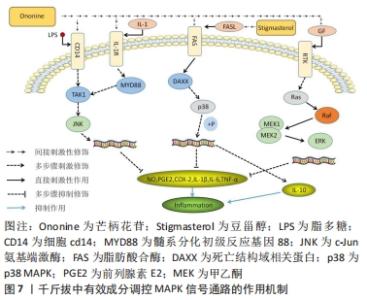
作为与膝骨关节炎相关、在炎症机制方面最为密切的信号途径之一,核转录因子κB发挥着举足轻重的作用。同时核转录因子κB也是千斤拔有效成分调控上述4条通路中作用最为广泛的通路,千斤拔在此通路的研究相对于其他几条通路而言较为成熟,其在炎症及软骨修复方面的研究较为透彻,但由于其治疗膝骨关节炎在抗炎及促软骨修复的具体作用过程涉及因子众多,且存在阶梯性复杂作用可能性,故作者在此只作初步阐述。日后可侧重在其对成骨细胞分化以及软骨细胞凋亡领域的研究,有利于骨组织工程在膝骨关节炎方面的深入研究起到推动作用。 2.3.4 MAPK信号通路 MAPK是一类能被炎性细胞因子、生长细胞因子等各种细胞外刺激,并通过激活上述因子而大量存在于机体内的丝氨酸蛋白激酶/苏氨酸蛋白激酶[51]。 MAPK信号通路为调控骨关节炎软骨损伤中最为重要的信号转导系统,其主要通过白细胞介素1和肿瘤坏死因子α等炎症因子、关节感染的特异性、生长因子及激活细胞内部MAPKs信号途径,从而调控基质金属蛋白酶1,3,13等基质金属蛋白酶的表达、软骨细胞凋亡以及软骨破坏等一系列相关反应[52]。MAPKs信号通路家族成员众多,包括p38 MAPK、c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)及ERK5等,其中与膝骨关节炎存在密切关系的主要为p38MAPK与JNK信号传导通路[53]。p38 MAPK信号途径在调控炎症及应激反应方面有密切联系。在膝骨关节炎发病过程中,p38 MAPK信号途径可以通过刺激膝骨关节炎中软骨细胞的应激与炎性反应,进而加重降解与破坏软骨细胞,同时其被激活与白细胞介素1、肿瘤坏死因子α、基质金属蛋白酶等炎性因子的表达有着紧密的联系[54]。同时白细胞介素1可通过MAPK信号途径诱导软骨细胞分泌一氧化氮、前列腺素E2及基质金属蛋白酶家族等,有利于促进关节炎症的进展[55]。 MENG等[56]发现芒柄花苷可以通过阻断MAPK信号传导通路,下调白细胞介素1β与白细胞介素6等促炎细胞因子及上调细胞凋亡能力,从而改善关节内环境。LUO等[57]利用芒柄花苷调控脂多糖诱导的斑马鱼模型中MAPK信号通路在抗炎方面的作用中发现,MYD88,JNK1及ERK1均能被芒柄花苷显著抑制,因此得出芒柄花苷主要通过对TRIF MAPK/ERK及MAPK/JNK信号通路或MYD88的抑制作用来下调脂多糖诱导的炎症。DONG等[58]通过用脂多糖和不同浓度的芒柄花苷作用于小鼠RAW264.7细胞中18 h后,采用MTT法、qRT-PCR法、Western blot法、Griess及ELISA检测分析相关参数指标,最后得出芒柄花苷组内MAPK信号途径的相关蛋白(JNK,ERK和p38)的总体表达水平与正常无异。然而,在脂多糖诱导的细胞中,其磷酸化JNK、ERK以及p38 MAPK的表达均得到显著提升,但在高浓度芒柄花苷的干预下,这些增高的蛋白可被逆转,具有一定程度的浓度依赖性。同时芒柄花苷能抑制一氧化氮、前列腺素E2、环氧合酶2的表达,降低白细胞介素1β、白细胞介素6及肿瘤坏死因子α的表达水平,从而说明了芒柄花苷通过调控核转录因子κB和MAPK信号通路中相关蛋白的表达,对由脂多糖诱导的炎症反应起到良好的抗炎作用。MAHMOOD等[59]通过实验表明,豆甾醇通过调控p38MAPK信号通路使胶原诱导型关节炎大鼠中显著升高的相关炎症递质水平(包括白细胞介素1β、白细胞介素6、肿瘤坏死因子α及环氧合酶2等)均得到显著抑制,同时,在胶原诱导型关节炎大鼠中表达降低的白细胞介素10,在豆甾醇的干预下表达显著提升,对炎症发生起到减缓作用,见图7。 "
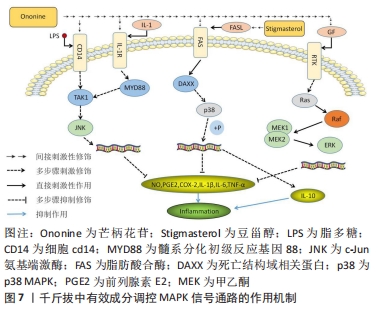

作为调节骨关节炎及膝骨关节炎中软骨损伤最为关键的信号传导通路,MAPK通过对相关细胞因子等的调控,能有效改善膝骨关节炎炎症及关节内骨与软骨修复工作。千斤拔中有效成分——芒柄花苷和豆甾醇,均能通过MAPK信号传导途径的一系列多步骤作用,对白细胞介素1β、白细胞介素6以及肿瘤坏死因子α等炎性因子起到有效的调控作用,有效降低炎症、修复软骨损伤,改善关节内环境,进而有效治疗膝骨关节炎。 2.4 千斤拔有效成分作用下相关信号通路间关联点的研究 信号通路之间存在着许多复杂的联系,其之间的连接因子更数不胜数。千斤拔通过与膝骨关节炎相关的信号通路调控膝骨关节炎并不仅是单独对一条通路进行调控,以文章所举4条信号通路中的核转录因子κB与MAPK信号轴为例,LUO等[57]证实,芒柄花苷通过抑制核转录因子κB及MAPK信号通路的表达来下调炎症反应,其具体相关因子之间的反应并未进行详细说明。同样,MAHMOOD等[59]发现,豆甾醇通过下调MAPKs和核转录因子kBp65信号轴,从而阻断p38MAPK、核转录因子kBp65和IκB的磷酸化,达到抗炎目的,其原因可能为豆甾醇联合抑制上述两条信号通路所致。作为MAPKKK家族中的一份子,TAK1可激活MAPK信号轴的下段,其中就包括p38MAPK以及JNK通路。同时,作为核转录因子κB信号轴中位于上游的关键因子,TAK1可通过刺激活化IKK复合物,加速IκB-α磷酸化及降解的进程,从而促进白细胞介素1等一系列炎性因子的表达[60]。但也有研究表明,肿瘤坏死因子α可通过提高p-p38、p-JNK、p-ERK-1/ERK2/p-核转录因子κB等的表达来刺激活化MAPK及核转录因子κB信号传导通路[56]。 作为2条相关信号轴连接的重要因子,TAK1确实存在引导MAPK和核转录因子κB信号途径进行作用的可能性,但由于相关信号通路间作用的影响因子众多,目前此区间的研究尚不全面,是否存在同步性或者阶段作用性,均未有相关文献证实,或是存在文献记载不足现象,故上述提及的相关方面的深入研究可以作为日后千斤拔治疗膝骨关节炎在生物信息学领域的研究重点。 随着对膝骨关节炎发病机制及治疗方法的不断深入研究,千斤拔作为治疗膝骨关节炎的有效中药之一,越来越引起学者的关注。从现代医学角度出发,在生物信息学等领域对千斤拔中有效成分通过相关信号通路治疗膝骨关节炎的研究也越发增多,笔者通过检索相关文献,初步总结出千斤拔中的有效成分(染料木素、大黄素及大黄酚)分别在Notch、JAK2/STAT3、核转录因子κB、MAPK信号通路下,通过调控Hes1、RUNX2、白细胞介素1β、白细胞介素6及肿瘤坏死因子α等相关炎性细胞因子、环氧合酶2、解聚蛋白多糖酶等相关细胞因子,在炎症、促进成骨分化等机制下,对改善膝骨关节炎炎症反应、促进膝骨关节炎内骨组织修复,进而改善关节内环境起到重要作用,见表1。 "


近年来有关千斤拔有效成分通过调控相关信号轴治疗膝骨关节炎的动物实验有所增长,其实验数据不断积累,也为千斤拔在炎症、成骨分化及软骨细胞凋亡机制上治疗膝骨关节炎的阐述提供了有效的数据佐证。近年来在该领域的实验模型动物主要以大鼠为主,建模方式可分为手术直接建模以及药物直接注射造模,其检测方法以Masson染色、苏木精-伊红染色以及PCR检测为主。通过相关动物模型实验得出,千斤拔中有效成分(如染料木素、豆甾醇及芒柄花苷)通过调控JAK2/STAT3、核转录因子κB以及MAPK信号通路调控Bcl-2、Bax、基质金属蛋白酶13以及白细胞介素1β、肿瘤坏死因子α等相关炎性因子,在上述机制中,发挥着抑制膝骨关节炎软骨细胞凋亡、促进软骨损伤修复及抗炎的作用,见表2。 "

| [1] ZOU Y, LIU Q, GUO P, et al. Anti chondrocyte apoptosis effect of genistein in treating inflammation induced osteoarthritis. Mol Med Rep. 2020;22(3):2032-2042. [2] 刘朝晖,马剑雄,张顺,等.膝骨关节炎的现状及治疗方法的研究进展[J].中华骨与关节外科杂志,2020,13(8):688-693. [3] ZHENG Y, LIU C, NI L, et al. Cell type-specific effects of Notch signaling activation on intervertebral discs: implications for intervertebral disc degeneration. J Cell Physiol. 2018;233(7):5431-5440. [4] 宋国瑞,张晨,刘子歌,等.JAK2-STAT3信号通路介导骨关节炎发病机制的研究进展[J].医学综述,2020,26(7):1278-1282. [5] JI B, Guo W, Ma H, et al. Isoliquiritigenin suppresses IL-1β induced apoptosis and inflammation in chondrocyte-like ATDC5 cells by inhibiting NF-κB and exerts chondroprotective effects on a mouse model of anterior cruciate ligament transection. Int J Mol Med. 2017;40(6):1709-1718. [6] WANG J, CHEN H, CAO P, et al. Inflammatory cytokines induce caveolin-1/β-catenin signalling in rat nucleus pulposus cell apoptosis through the p38 MAPK pathway. Cell Prolif. 2016;49(3):362-372. [7] 曹海丽,梅全喜,曾聪彦.千斤拔的本草考证[J].现代中药研究与实践,2019 ,33(6):73-77. [8] 任朝琴,戴先芝,袁玮,等.大叶千斤拔、宽叶千斤拔、腺毛千斤拔生药学鉴别[J].广州中医药大学学报,2020,37(9):1781-1787. [9] 杜沛霖,周雨晴,黄贵华,等.千斤拔属植物的化学成分·药理作用·临床应用研究进展[J].安徽农业科学,2017,45(6):109-111. [10] KO YJ, LU TC, KITANAKA S, et al. Analgesic and anti-inflammatory activities of the aqueous extracts from three Flemingia species. Am J Chin Med. 2010;38(3):625-638. [11] HO HY, WU JB, LIN WC. Flemingia macrophylla extract ameliorates experimental osteoporosis in ovariectomized rats. Evid Based Complement Alternat Med. 2011; 2011:752302. [12] HEIEH PC, HO YL, HUANG GJ, et al. Hepatoprotective effect of the aqueous extract of Flemingia macrophylla on carbon tetrachloride-induced acute hepatotoxicity in rats through anti-oxidative activities. Am J Chin Med. 2011;39(2):349-365. [13] LIU M, WANG G, XU R, et al. Soy Isoflavones Inhibit Both GPIb-IX Signaling and αIIbβ3 Outside-In Signaling via 14-3-3ζ in Platelet. Molecules. 2021;26(16):4911. [14] 王维东,万博文,周灵杰,等.PTH通过Notch信号通路促进骨髓间充质干细胞向成骨细胞分化[J].南京医科大学学报(自然科学版),2015,35(11):1517-1521. [15] LIANG Z, REN C. Emodin attenuates apoptosis and inflammation induced by LPS through up-regulating lncRNA TUG1 in murine chondrogenic ATDC5 cells. Biomed Pharmacother. 2018;103:897-902. [16] MOHIT K, JOHANNE MP, DANIEL L, et al. Role of proinflammatory cytokines in the pathophysiology of osteoarthritis. Nat Rev Rheumatol. 2011;7(1):33-42. [17] WOJDASIEWICZ P, PONIATOWSKI ŁA, SZUKIEWICZ D. The role of inflammatory and anti-inflammatory cytokines in the pathogenesis of osteoarthritis. Mediators Inflamm. 2014;2014:561459. [18] 牛彦强,颜春鲁,安方玉,等.膝骨关节炎基因表达及中医药干预机制的研究进展[J].中国骨质疏松杂志,2020,26(4):585-589. [19] LI M, CHEN X, YAN J, et al. Inhibition of osteoclastogenesis by stem cell-derived extracellular matrix through modulation of intracellular reactive oxygen species. Acta Biomater. 2018;71:118-131. [20] 赵金龙,曾令烽,梁桂洪,等.基于信号通路的中药有效成分治疗骨质疏松机制研究进展[J].中草药,2020,51(23):6084-6094. [21] 贺娟娟,颜春鲁,安方玉,等.炎症因子与炎症因子相关信号通路在膝骨关节炎中的调控机制研究进展[J].中国临床药理学杂志,2019,35(12):1308-1311. [22] 张虎林,喻琳,王亮,等.膝骨性关节炎关键信号通路的研究进展[J].中国中医骨伤科杂志,2021,29(10):84-88. [23] 孟庆良,孟婉婷,卞华,等.大黄素对TNF-α诱导的类风湿性关节炎成纤维样滑膜细胞增殖的影响[J].中成药,2021,43(2):480-484. [24] 吴绍军,刘俊才,左银龙,等.Notch信号通路在膝骨关节炎软骨细胞凋亡中的作用研究[J].华西医学,2018,33(9):1162-1167. [25] 陈德胜,张学森,郭凤英,等.Notch信号转导通路在老年膝骨关节炎软骨中的表达及意义[J].宁夏医学杂志,2020,42(8):681-684, 672. [26] 薛太阳,曾娟,刘士嘉,等.抑制Notch信号通路减少大鼠膝骨关节炎关节软骨内MMP-13的上调和Col Ⅱ的降低[J].中国组织化学与细胞化学杂志, 2018,27(3):214-220. [27] 康晓军,李燕.染料木素对大鼠骨髓间充质干细胞增殖能力的影响[J].实验与检验医学,2019,37(5):819-821, 900. [28] 宋效庆,刘秀菊,牛德利,等.染料木素对骨代谢网络调控相关机制的研究进展[J].现代口腔医学杂志,2016,30(4):243-246, 242. [29] YU T, LI Z, XU L, et al. Anti-inflammation effect of Qingchang suppository in ulcerative colitis through JAK2/STAT3 signaling pathway in vitro and in vivo. J Ethnopharmacol. 2021;266:113442. [30] LU W, DING Z, LIU F, et al. Dopamine delays articular cartilage degradation in osteoarthritis by negative regulation of the NF-κB and JAK2/STAT3 signaling pathways. Biomed Pharmacother. 2019;119:109419. [31] 房家康,邵李涛,田发明,等.JAK/STAT3信号通路与骨关节炎研究进展[J].中国运动医学杂志,2020,39(3):247-252. [32] 李亮,周正新,周章武,等.膝骨关节炎软骨细胞凋亡及软骨下骨重建与信号转导通路关系研究[J].中医药临床杂志,2017,29(1):16-19. [33] 胡炯,王伟东,王昌兴,等.染料木素调控JAK2/STAT3信号通路改善骨性关节炎大鼠软骨代谢的作用研究[J].中国临床药理学与治疗学,2018,23(4):383-388. [34] 孟亮,邢昌明,杨帆,等.大黄素对IL-1β诱导血管平滑肌细胞增殖的影响及机制研究[J].医学临床研究,2013,30(3):426-430. [35] 郑晓慧,董博,袁普卫,等.NF-κB信号通路在骨性关节炎软骨破坏中的研究进展[J].中国疼痛医学杂志,2021,27(7):540-544. [36] 王新军,袁银鹏,王越,等.软骨细胞凋亡引发骨关节炎的机制研究进展[J].山东医药,2020,60(2):109-112. [37] TENG Y, NI G, ZHANG W, et al. TRIM59 attenuates IL-1β-driven cartilage matrix degradation in osteoarthritis via direct suppression of NF-κB and JAK2/STAT3 signaling pathway. Biochem Biophys Res Commun. 2020;529(1):28-34. [38] SUEISHI T, AKASAKI Y, GOTO N, et al. GRK5 inhibition attenuates cartilage degradation via decreased NF-κB signaling. Arthritis Rheumatol. 2020;72(4):620-631. [39] 柳博,李宁,谢兴文,等.基于NF-κB信号通路的中医药治疗骨性关节炎的研究进展[J].中医药学报,2021,49(7):120-125. [40] MARCU KB, OTERO M, Olivotto E, et al. NF-kappaB signaling: multiple angles to target OA. Current drug targets. 2010;11(5):599-613. [41] LIU Y, WANG G, WANG X, et al. Effects of TLR-2/NF-κB signaling pathway on the occurrence of degenerative knee osteoarthritis:an in vivo and in vitro study. Oncotarget. 2017;8(24):38602-38617. [42] LEPETSOS P, PAPAVASSILIOU KA, PAPAVASSILIOU AG. Redox and NF-kappaB signaling in osteoarthritis. Free Radical Biol Med. 2019;132:90-100. [43] WEN Q, MEI L, YE S, et al. Chrysophanol demonstrates anti-inflammatory properties in LPS-primed RAW 264.7 macrophages through activating PPAR-γ. Int Immunopharmacol. 2018;56:90-97. [44] SU S, WU J, GAO Y, et al. The pharmacological properties of chrysophanol,the recent advances. Biomed Pharmacother. 2020;125:110002. [45] HWANG JK, NOH EM, MOON SJ, et al. Emodin suppresses inflammatory responses and joint destruction in collagen-induced arthritic mice. Rheumatology. 2013;52(9):1583-1591. [46] DING Q, YE C, CHEN E, et al. Emodin ameliorates cartilage degradation in osteoarthritis by inhibiting NF-κB and Wnt/β-catenin signaling in-vitro and in-vivo. Int Immunopharmacol. 2018;61:222-230. [47] 孙攀兴,邱春光.大黄素通过调控TLR4/NF-κB通路对脂多糖诱导血管内皮细胞氧化损伤的保护作用研究[J].药物评价研究,2020,43(6):1040-1045. [48] YUAN J, DING W, WU N, et al. Protective effect of genistein on condylar cartilage through downregulating nf-κb expression in experimentally created osteoarthritis rats. Biomed Res Int. 2019;2019:2629791. [49] LIU F, WANG C, LU J, et al. Chondroprotective effects of genistein against osteoarthritis induced joint inflammation. Nutrients. 2019;11(5):1180. [50] HU M, LI X, ZHANG J, et al. GEN-27 exhibits anti-inflammatory effects by suppressing the activation of NLRP3 inflammasome and NF-κB pathway. Cell Biol Int. 2019;43(10):1184-1192. [51] 王迷娜,刘璐,赵洛鹏,等.膝骨关节炎炎性因子及信号通路的研究进展[J].中国骨伤,2020,33(4):388-392. [52] CHU X, Yu T, HUANG XJ, et al. Tomatidine suppresses inflammation in primary articular chondrocytes and attenuates cartilage degradation in osteoarthritic rats. Aging (Albany NY). 2020;12(13):12799-12811. [53] 赵常红,李世昌,李沛鸿,等.调节破骨细胞功能的相关信号分子的研究进展[J].中国骨质疏松杂志,2021,27(9):1361-1365. [54] 谢文鹏,徐龙进,王象鹏,等.p38 MAPK信号通路在膝关节骨性关节炎中医药诊疗中的作用[J].中国实验方剂学杂志,2019,25(8):219-225. [55] 潘其勇.关节软骨和软骨下骨在骨关节炎中相互作用机制的初步研究[D].武汉:华中科技大学,2018. [56] MENG Y, JI J, XIAO X, et al. Ononin induces cell apoptosis and reduces inflammation in rheumatoid arthritis fibroblast-like synoviocytes by alleviating MAPK and NF-κB signaling pathways. Acta Biochim Pol. 2021;68(2):239-245. [57] LUO L, ZHOU J, ZHAO H, et al. The anti-inflammatory effects of formononetin and ononin on lipopolysaccharide-induced zebrafish models based on lipidomics and targeted transcriptomics. Metabolomics. 2019;15(12):1-11. [58] DONG L, YIN L, ZHANG Y, et al. Anti-inflammatory effects of ononin on lipopolysaccharide-stimulated RAW 264.7 cells. Mol Immunol. 2017;83:46-51. [59] MAHMOOD AK, SARWAR AHMG, RANI R, et al. Stigmasterol protects rats from collagen induced arthritis by inhibiting proinflammatory cytokines. Int Immunopharmacol. 2020;85:106642. [60] WANG H, CHE J, CUI K, et al. Schisantherin A ameliorates liver fibrosis through TGF-β1mediated activation of TAK1/MAPK and NF-κB pathways in vitro and in vivo. Phytomedicine. 2021;88:153609. |
| [1] | Zhang Lichen, Chen Liang, Gu Yong. Inorganic ion bionic periosteum regulates immune microenvironment to promote bone repair [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(3): 346-353. |
| [2] | LIU Danni, SUN Guanghua, ZHOU Guijuan, LIU Hongya, ZHOU Jun, TAN Jinqu, HUANG Xiarong, PENG Ting, FENG Wei-bin, LUO Fu. Effect of electroacupuncture on apoptosis of neurons in cerebral cortex of rats with cerebral ischemia-reperfusion injury at "Shuigou" and "Baihui" points [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(在线): 1-6. |
| [3] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [4] | Jin Tao, Liu Lin, Zhu Xiaoyan, Shi Yucong, Niu Jianxiong, Zhang Tongtong, Wu Shujin, Yang Qingshan. Osteoarthritis and mitochondrial abnormalities [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1452-1458. |
| [5] | Zhang Lichuang, Xu Hao, Ma Yinghui, Xiong Mengting, Han Haihui, Bao Jiamin, Zhai Weitao, Liang Qianqian. Mechanism and prospects of regulating lymphatic reflux function in the treatment of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1459-1466. |
| [6] | Yao Xiaoling, Peng Jiancheng, Xu Yuerong, Yang Zhidong, Zhang Shuncong. Variable-angle zero-notch anterior interbody fusion system in the treatment of cervical spondylotic myelopathy: 30-month follow-up [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1377-1382. |
| [7] | Wang Baojuan, Zheng Shuguang, Zhang Qi, Li Tianyang. Miao medicine fumigation can delay extracellular matrix destruction in a rabbit model of knee osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1180-1186. |
| [8] | Xiang Xinjian, Liu Fang, Wu Liangliang, Jia Daping, Tao Yue, Zhao Zhengnan, Zhao Yu. High-dose vitamin C promotes the survival of autologous fat transplantation in rats [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1242-1246. |
| [9] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1260-1265. |
| [10] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1272-1277. |
| [11] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [12] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1119-1124. |
| [13] | Hui Xiaoshan, Bai Jing, Zhou Siyuan, Wang Jie, Zhang Jinsheng, He Qingyong, Meng Peipei. Theoretical mechanism of traditional Chinese medicine theory on stem cell induced differentiation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1125-1129. |
| [14] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [15] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1137-1142. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||