Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (29): 4729-4734.doi: 10.12307/2022.841
Previous Articles Next Articles
Mechanism and application of sterol regulatory element binding protein in wound healing
Zhu Boheng, Peng Ying, Wang Hong
- Department of Burns, the Second Affiliated Hospital of Kunming Medical University, Kunming 650101, Yunnan Province, China
-
Received:2021-09-10Accepted:2021-11-11Online:2022-10-18Published:2022-03-28 -
Contact:Wang Hong, Master, Chief physician, Department of Burns, the Second Affiliated Hospital of Kunming Medical University, Kunming 650101, Yunnan Province, China -
About author:Zhu Boheng, Master candidate, Department of Burns, the Second Affiliated Hospital of Kunming Medical University, Kunming 650101, Yunnan Province, China -
Supported by:the Regional Science Foundation of National Natural Science Foundation of China, No. 81660321 (to WH)
CLC Number:
Cite this article
Zhu Boheng, Peng Ying, Wang Hong. Mechanism and application of sterol regulatory element binding protein in wound healing[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(29): 4729-4734.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
2.1 SREBPS的生物学特性和传统功能 机体内细胞脂类代谢和平衡都是由一个共同的转录因子家族所控制,这个转录因子家族被称为SREBP。SREBP是一种碱性helix-loop-helix-leucine zipper (bHLHLZ)转录因子,合成为1 150个与内质网膜结合的非活性前体氨基酸。每个SREBP前体被组织成3个结构域:①约480个前体氨基酸的nh2端结构域,包含反活化结构域、富含丝氨酸和脯氨酸的结构域以及用于DNA结合和二聚的bHLHLZ结构域;②2个疏水跨膜段,由一个约30个前体氨基酸的短环打断,进入内质网腔内;③590个前体氨基酸COOH-terminal segment调控域[6]。SREBP通过短环连接的2个疏水跨膜区段与内质网膜结合。在内质网膜上合成后,SREBP立即与甾醇调节原件结合蛋白裂解激活蛋白(sterol regulatory element binding proteins cleavage-activating protein,SCAP)结合,SCAP是一种含有固醇感应结构域的多胞质膜蛋白。在甾醇耗尽的细胞中,SCAP将SREBP护送至高尔基体,其中SREBPS由两种膜结合蛋白酶(位点-1蛋白酶和位点-2蛋白酶)处理,将SREBP的活性部分释放到胞质溶胶中,使得它们可以进入核。在甾醇过载的细胞中,SCAP通过其膜固醇感应区域发生构象变化,SCAP保留在内质网膜中,废除SREBP处理并降低脂质合成[7]。SREBP转录激活内源性胆固醇、脂肪酸、磷脂和三酰甘油合成所需要的一系列酶。 2.2 SREBP在创面修复中的作用及其机制 有研究表明SREBP通过胆固醇通路甾醇代谢物发挥作用,参与调控创面的巨噬细胞数量及表型、T细胞增殖和细胞效应、激活黑色素瘤2和 NOD样受体1炎性小体等,从而调控创面修复中的炎症反应。"

2.2.1 调控创面的炎症反应 炎症反应是机体响应有害刺激的一种自卫机制,当机体遭受损害或病原体侵入后,良好的调节炎性反应是创面愈合的基本保障。巨噬细胞作为炎症后期的一部分,是伤口愈合的关键,巨噬细胞刺激血管生成和纤维组织形成的作用已明确。巨噬细胞有两种表型,以肿瘤坏死因子α、白细胞介素1和白细胞介素6的产生为特征的M1样细胞在修复的早期阶段很常见,主要表现为促进炎症反应、吞噬病原体和受损细胞,这些炎症对宿主防御很重要,但具有组织破坏性;而M2样细胞则具有较少的促炎细胞因子和升高的细胞因子,主要表现为抗炎反应、促进组织重塑和血管生成[8]。炎性体是在暴露于多种病原体衍生的刺激物后在细胞溶质内形成的多蛋白复合物,炎性体激活需要通过传感器蛋白识别配体,然后募集衔接蛋白,因其控制蛋白水解酶半胱氨酸天冬氨酸酶1活化的能力而闻名。半胱氨酸天冬氨酸酶1反过来调节白细胞介素1β和白细胞介素18的蛋白水解成熟,以及称为炎症坏死的快速、有害、炎症形式的细胞死亡,从而参与机体的炎症反应[9]。由CD8+T淋巴细胞介导的适应性免疫和免疫记忆是针对细胞内病原体如病毒和细胞内细菌的保护性应答的关键部分,同样也是创面修复中炎症反应的重要淋巴细胞。在甾醇体内平衡的遗传和药理学的变化,通过肝X受体的转录轴的作用,也影响T淋巴细胞的细胞周期进展,存活和效应功能[10]。 近年来研究发现,SREBP2除了激活其典型胆固醇靶基因外,还与多种炎症和干扰素反应基因结合,促进肿瘤坏死因子诱导的炎症极化(促进巨噬细胞表型M1型极化),促进炎症反应,影响创面愈合[11],因此抑制SREBP2的活性可以抑制炎症反应,从而促进创面愈合。SREBP除了与多种炎症和干扰素反应基因结合,还与炎性体的激活有着紧密的联系。SREBP调节炎症反应的研究时间轴,见图3。"

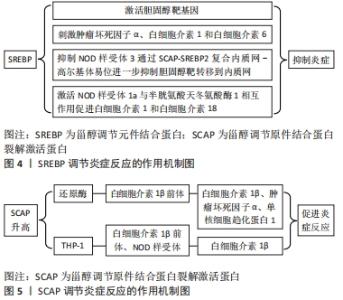
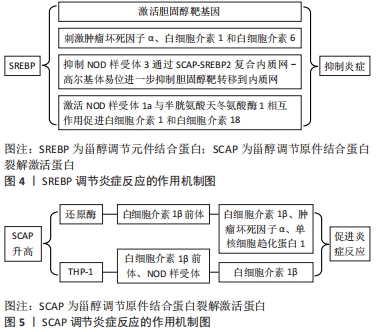
GUO等[17]通过研究发现SCAP-SREBP2除控制胆固醇生物合成外,还可作为整合胆固醇代谢与巨噬细胞炎症的信号传导途径,SCAP-SREBP2复合内质网-高尔基体易位是体外和体内NOD样受体3炎性体最佳活化所必需的。NOD样受体3是核苷酸结合域-(NOD)样受体家族的成员,可以在大量免疫和非免疫细胞中发现。激活后,NOD样受体家族3、凋亡相关的斑点样蛋白和前半胱氨酸天冬氨酸酶1将组装成多聚体蛋白,称为NOD样受体3炎性体,然后导致胱天蛋白酶1介导的白细胞介素1β细胞因子家族的蛋白水解活化,并诱导炎症,细胞凋亡性细胞死亡[18],DE LA ROCHE等[19]同样也指出NOD样受体3炎性体激活需要将胆固醇运输到内质网,此过程最重要的就是SCAP-SREBP2复合内质网-高尔基体易位,即说明SREBP2可以通过SCAP-SREBP2复合内质网-高尔基体易位来调控炎性体的激活从而来调控创面的炎性反应。有研究表明增加巨噬细胞胆固醇含量可以促进炎性体的激活,线粒体胆固醇含量增加可以导致细胞溶质mtDNA积累和炎性体激活,最近的一些研究表明mtDNA的细胞溶质释放可以激活cGAS/STING DNA感应途径,从而触发Ⅰ型干扰素的产生,然而胆固醇依赖性白细胞介素1β释放需要黑色素瘤2炎性体[14],所以胆固醇含量的增加可以促进炎症反应的发生和持续,即SREBP可以通过促进胆固醇的合成来激活炎性体,从而促进炎症反应的发生和持续。除了上述激活炎性体的方式,目前有研究表明SREBP1a还可以直接激活炎性体基因来激活炎性体。IM等[12]通过对巨噬细胞中SREBP的研究发现SREBP-1a直接激活NOD样受体1a基因,脂多糖通过SREBP-1a依赖性机制刺激脂肪生成。NOD样受体1a是一种NLR家族蛋白,含有NACHT和富含亮氨酸的重复序列。NOD样受体作为炎性体的一部分与半胱氨酸天冬氨酸酶1的活化相互作用并协调其活化在分泌前切割促炎细胞因子白细胞介素1和白细胞介素18,白细胞介素1和白细胞介素18从巨噬细胞释放,作为通过Toll样受体4信号传导对细菌结合的促炎反应的一部分[20]。由此可以得出SREBP-1a可以通过激活NOD样受体1a基因来激活NOD样受体炎性体从而调控炎症反应,进而调控创面修复。综上所述,SREBP可以通过激活炎性体从而促进炎症反应的发生和持续,因此,可以通过调控SREBP来调控炎性体的激活从而调控炎症反应的发生,进而促进创面愈合。 SREBP除了通过上述两种方式调控炎症反应,还可以通过调控T细胞参与的炎症反应来调控创面修复。KIDANI等[13]通过研究发现活化T淋巴细胞的脂质生物合成程序是SREBP依赖性的并且对PI3K-mTOR途径敏感,SREBP信号传导特异性调节脂质合成代谢和T细胞生长所必需的基因程序,但不会严重影响T细胞活化,CD8+T细胞中SREBP功能丧失使其无法有效爆炸,导致体外增殖能力下降,并在病毒感染期间减弱克隆扩增。另一项研究指出:内源性脂肪酸合成酶维持活化T细胞的扩增是必要的,通过SCAP和乙酰辅酶甲羧化酶的遗传缺失后观察到的受损的增殖和效应应答所证明[21]。因此,当CD8+T细胞中SREBP活性部分降低时,导致体外增殖能力下降,并在病毒感染期间减弱克隆扩增,从而抑制机体在创面修复中T细胞参与的炎症反应。综上所述,SREBP通过调控T细胞的代谢来调控T细胞的增殖和细胞效应,从而调控创面修复过程中T细胞参与的炎症反应。 SCAP是SREBP切割激活蛋白,是一种含有固醇感应结构域的多胞质膜蛋白,在甾醇耗尽的细胞中,SREBP即与SCAP在内质网膜上结合,SCAP将SREBP护送至高尔基体。在甾醇过载的细胞中,SCAP通过其膜固醇感应区域发生构象变化,SCAP保留在内质网膜中,废除SREBP处理并降低脂质合成。除了SREBP的活性程度可以介导炎症反应从而调控创面修复,调控SCAP的活性程度同样也可以介导炎症反应从而调控创面修复。Ouyang等[16]通过调查SCAP功能障碍对THP-1巨噬细胞中炎性细胞因子和脂质代谢表达的影响,得出SCAP功能障碍通过激活核因子κB信号通路刺激炎症反应,SCAP的过表达显著增加还原酶,白细胞介素1β前体在细胞质中的表达,以及上清液中成熟的白细胞介素1β、肿瘤坏死因子α、单核细胞趋化蛋白1,而敲低SCAP则显著降低了表达,并且SCAP的促炎作用不依赖于其在调节胆固醇体内平衡中的常规作用。伍莎莎等[15]又通过对胆固醇敏感器SCAP的研究得出胆固醇敏感器SCAP的过表达能够促进THP-1源性巨噬细胞内白细胞介素1β前体表达并同时激活NOD样受体3炎症小体(主要通过上调细胞表面P2X7R表达),最终促进白细胞介素1β前体成熟及其向细胞外分泌。由此可以得出SCAP过表达可以促进炎症反应;抑制SCAP表达可以降低创面过度的炎性反应,促进创面修复。KUSNADI等[11]对Scapfl/LysM-Cre创面进行研究,发现SCAP缺乏会导致伤口巨噬细胞数量增加,并且SCAP缺乏导致编码蛋白的基因表达增加,这些蛋白可以通过作用于内皮细胞和肌成纤维细胞来促进组织修复。已有研究表明,巨噬细胞的大量积累和M2样修复表型的表达与组织修复的加速和优势有关[22]。因此SCAP缺乏可以通过抑制炎症反应,抑制SREBP从而增加伤口巨噬细胞并促进巨噬细胞表型从M1型向M2型转变,还可以通过编码某些促进组织修复的蛋白基因表达增加来促进创面修复。 SCAP-SREBP不仅可以通过激活炎性体来调控炎症反应,还可以通过一些其他的机制来调控炎症反应。DANG等[14]通过研究发现胆固醇-25-羟化酶是巨噬细胞中的干扰素诱导基因,胆固醇-25-羟化酶通过凋亡相关的斑点样蛋白依赖性炎症小体控制白细胞介素1释放和细胞内细菌生长,然而胆固醇-25-羟化酶缺乏对白细胞介素1β前体加工的影响可以通过胰岛素诱导基因1抗体的过表达或SCAP的缺失来挽救,表明SREBP途径的贡献,但这种贡献的性质尚未确定[23]。SREBP、SCAP调节炎症反应的作用机制,见图4,5。"
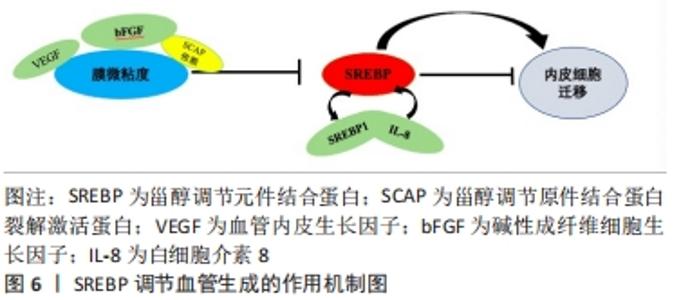
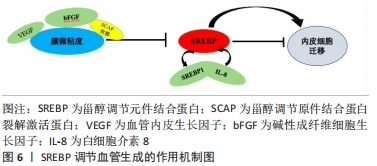
2.2.2 调控创面的血管生成 血管生成是从预先存在的血管网络形成新血管,通过刺激内皮细胞迁移和增殖,血管内皮生长因子在生理和病理条件下的血管生成中都起着核心作用,血管生成也是创面修复过程中必不可少的一部分。已有研究表明,血管生成因子包括血管内皮生长因子和碱性成纤维细胞生长因子等,可以通过调节膜微黏度来调节内皮细胞迁移,而膜胆固醇或脂肪酸含量的变化也会改变质膜的微黏度,因此膜脂的变化可能与血管内皮生长因子调节的膜微粘度有关,进而可以调节内皮细胞迁移[24-25]。ZHOU等[26]通过对SREBP与血管生成的研究发现,血管内皮生长因子以SCAP依赖的方式激活内皮细胞中的SREBP,而激活的SREBP又介导血管内皮生长因子诱导的内皮细胞迁移和增殖,并且在兔皮肤伤口愈合模型中发现SREBP1在愈合皮肤的新血管系统中增加,由此可以得出SREBP(特别是SREBP1)在功能上参与了血管内皮生长因子诱导的血管生成过程,特别是在内皮细胞的迁移和增殖中。除了一些血管生成因子在血管生成中起着重要作用,某些炎症因子同样也有,例如白细胞介素8最初被确定为白细胞的激活剂和化学引诱剂,特别是中性粒细胞,但目前有研究表示,白细胞介素8在血管生成的过程中也起着重要作用[27]。YAO等[28]通过对SREBP在白细胞介素8诱导的血管生成过程中的研究发现,白细胞介素8可以刺激SREBP1c和这些转录因子下游基因的表达,并且通过受体依赖的方式刺激内皮细胞中SREBP的激活,对血管生成至关重要;SREBP介导白细胞介素8诱导的人微血管内皮细胞通透性、增殖和迁移,SREBP并且能够调节鸟苷三磷酸酶的激活,通过SREBP、3-羟基-3-甲基戊二酰辅酶A还原酶、鸟苷三磷酸酶的信号传导对白细胞介素8诱导的血管生成至关重要。并且他们的研究也指出SREBP激活后导致鸟苷三磷酸酶激活对于几种不同类型的血管生成因子刺激的血管生成反应很重要,这与ZHOU等[26]的研究结果有了相似的结论,由此可以得出SREBP在白细胞介素8诱导的血管生成中起关键作用,特别是SREBP1的作用尤为明显。而YEH等[29]的研究发现SREBP在磷脂氧化产物激活内皮细胞中的作用主要通过增加内皮细胞的迁移率来完成,这又进一步证明了SREBP可以促进内皮细胞的迁移,与上述几位学者的观点相呼应。综合上述几位学者的研究发现SREBP可以通过介导血管内皮生长因子或白细胞介素8的血管生成过程从而参与创面修复中的血管生成,为将来的研究提供了进一步的研究方向。SREBP调节血管生成的作用机制,见图6。"

2.2.3 调控创面的表皮细胞增殖和分化 在创面修复的过程中,表皮细胞的增殖也是起着至关重要的作用。近期研究表明,在细胞的有丝分裂过程中,细胞周期蛋白激酶可使SREBP1磷酸化,形成稳定的nSREBP1,而nSREBP1又可诱导细胞周期蛋白激酶抑制剂2P1的基因表达,从而在细胞的增生和分化过程中发挥一定作用[30-32]。这几位学者的研究为探索SREBP在创面修复中的作用提供了一个新的方向。庞晓文等[33]在寻常型银屑病表皮中SREBP1表达模式的研究中发现,正常人表皮SEEBPl阳性表达主要位于细胞核,未见细胞核外表达,表明SREBP1在表皮角质形成细胞正常增生分化及屏障功能的形成中可能发挥一定的调控作用。庞晓文等的研究进一步证明SREBP1在表皮细胞的增生及分化过程中可能存在一定的调控作用,为以后的研究奠定了一定的基础。而KUSNADI等[11]通过对小鼠皮肤伤口模型测试了髓样Scap缺失对组织修复的影响研究发现髓样区室中SREBP功能的丧失导致表皮和真皮中的皮肤修复程序加速,这进一步说明SREBP可能在表皮和真皮的增生及分化的过程中起了一定的调控作用,但具体如何调控仍需进一步研究。SREBP调节表皮细胞分化及生长的研究时间轴,见图7。"

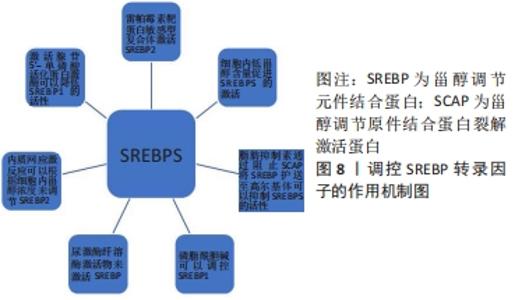
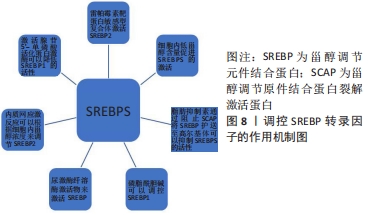
2.3 调控SREBP转录因子 SREBP的活性对创面修复的影响十分重要,所以对于影响SREBP活性的因素需要深入了解才可以更好地阐明SREBP在创面修复中的作用。 虽然SREBP可以调控创面的炎症反应,但是SREBP-胆固醇途径的激活还是受到肿瘤坏死因子晚期诱导影响。有研究显示,在肿瘤坏死因子刺激巨噬细胞的晚期使胆固醇生物合成通路中的基因显著激活,即SREBP-胆固醇合成途径是由肿瘤坏死因子刺激巨噬细胞晚期诱导所发生的[34]。SEO等[35]通过ChIP-seq分析得到肝SREBP-2优先结合两个不同的基因近端基序,而KUSNADI等[11]通过ChIP-qPCR和ChIP-seq分析得到SREBP2在大噬菌体中的基因结合位点占用情况与上述一致,由此可以得出肿瘤坏死因子可以诱导激活SREBP,并使活化的SREBP广泛结合于肿瘤坏死因子晚期反应基因的调控元件,使肿瘤坏死因子表达增加,进而促进炎症反应。SREBP-胆固醇途径的激活和抑制除了受到肿瘤坏死因子晚期诱导影响,还可以通过调控细胞甾醇含量来控制SREBP的激活或抑制。BROWN等[36]研究表明,在高甾醇浓度的存在下,SREBP-SCAP复合物被保留在内质网膜中;当甾醇含量降低时,SREBP-SCAP复合物向发生裂解的高尔基体移动。此外,ADAMS等[37]发现胆固醇通过诱导SCAP与胰岛素敏感蛋白结合而直接与SCAP相互作用,阻止SCAP将SREBP护送至高尔基体(其中SREBP被加工成其活性形式)而在内质网膜中发挥此作用,而25-羟基胆固醇通过引发SCAP与胰岛素敏感蛋白结合而对25-羟基胆固醇传感蛋白起间接作用,从而抑制SREBP的活化。KAMISUKI等[38]通过研究表明脂肪抑制素通过与甾醇结构域不同的位点结合保护蛋白SCAP来抑制SREBP的内质网膜-高尔基体易位,从而抑制SREBP的活化,SHAO等[39]同样也证明了上述观点。由此可以得出通过阻止SCAP将SREBP护送至高尔基体可以抑制SREBP的活化,从而可以抑制炎性反应过度。除了上述方法可以调控SREBP的活性,还有某些药物和病毒同样也可以起一定的作用。有研究表明丙型肝炎病毒诱导的NOD样受体3炎性体激活SREBP并调节脂质代谢[40],还有研究表明抗抑郁药物可以激活SREBP并上调人神经胶质细胞中的胆固醇和脂肪酸生物合成[41]。由此可以得出某些药物和病毒也可以对SREBP进行调节从而调控创面修复的炎性反应。 除了上述的多种因素可以调控SREBP,还有一些可以调控SREBP2的因素。COLGAN等[42]通过研究发现内质网应激反应(内质网内错误折叠蛋白的积累)可以诱导SREBP-2激活,并且指出内质网应激反应诱导的SREBP-2 激活通常根据细胞内甾醇浓度来调节。LEE等[43]发现毒胡萝卜素是内质网应激反应的激活剂,能抑制蛋白质合成并激活SREBP2。由此得出可以通过下调内质网膜应激反应来降低SREBP2的活性从而抑制炎症反应并促进组织修复。另外,有研究发现SREBP2在体内和体外有一些磷酸化位点例如ser432和ser455,这些磷酸化位点可以增强SREBP2的反活化能力,但不与DNA结合[44]。还有研究表明雷帕霉素靶蛋白敏感型复合体通过抑制胆固醇运输到哺乳动物细胞中的溶酶体来激活SREBP2[45]。不仅有多种因素可以调控SREBP2,还有许多因素可以调控SREBP1,从而影响炎症反应,进而对创面修复做出一定的影响。FUHRMAN等[46]通过研究发现尿激酶纤溶酶原激活物可以刺激巨噬细胞中的胆固醇生物合成,主要通过以PI3-激酶和丝裂原活化蛋白激酶依赖性方式激活SREBP1来实现的,从而可以促进炎性体的激活,促进炎性反应。有研究发现阻断甲基供体S-腺苷甲硫氨酸或甲基化是磷脂酰胆碱合成会导致SREBP-1依赖性转录和脂滴积聚升高,即可以激活SREBP1,其中SREBP1转录活性的成熟受磷脂酰胆碱水平控制[47]。还有研究表明腺苷5’-单磷酸活化蛋白激酶可以抑制SREBP-1的转录并且由于其活化时间延长可以导致大鼠肝细胞脂肪酸合成酶表达下降,葛根素同样也具有激活腺苷5’-单磷酸活化蛋白激酶的能力,并减少SREBP1和脂肪酸合成酶的表达,从而抑制肝脏脂肪生成和增加肝脏抗氧化活性[48]。由此可以得出激活腺苷5’-单磷酸活化蛋白激酶可以降低SREBP1的活性。综上所述,可以通过多种方法调控SREBP的活性,从而介导创面修复中的炎症反应、血管生成及细胞的增生和分化来促进创面愈合。调控SREBP转录因子的作用机制,见图8。"
| [1] 付小兵.构建一个创面治疗学科体系:中国特色创面治疗中心建设20年的回顾与展望[J]. 中华烧伤杂志,2018,34(12):859-863. [2] MAIONE AG, SMITH A, KASHPUR O, et al. Altered ECM deposition by diabetic foot ulcer-derived fibroblasts implicates fibronectin in chronic wound repair. Wound Repair Regen. 2016;24(4):630-643. [3] CATRINA SB, ZHENG X. Disturbed hypoxic responses as a pathogenic mechanism of diabetic foot ulcers. Diabetes Metab Res Rev. 2016;32 Suppl 1:179-185. [4] GEIGER A, WALKER A, NISSEN E. Human fibrocyte-derived exosomes accelerate wound healing in genetically diabetic mice. Biochem Biophys Res Commun. 2015; 467(2):303-309. [5] 盘艳君,王燕,徐健强,等.固醇调节元件结合蛋白与炎症的关系研究进展[J].生物化学与生物物理进展,2016,43(12):1146-1153. [6] MOON YA. The SCAP/SREBP Pathway: A Mediator of Hepatic Steatosis. Endocrinol Metab (Seoul). 2017;32(1):6-10. [7] 张强,许璨,唐朝克,等.细胞内胆固醇水平调节研究进展[J].生物化学与生物物理进展,2022,49(2):1-12. [8] 周琦,孙慧娟,于栋华,等.巨噬细胞M1/M2型极化在不同疾病中的作用机制[J].中国药理学通报,2020,36(11):1502-1506. [9] RATHINAM VA, FITZGERALD KA. Inflammasome Complexes: Emerging Mechanisms and Effector Functions. Cell. 2016;165(4):792-800. [10] GEYEREGGER R, SHEHATA M, ZEYDA M, et al. Liver X receptors interfere with cytokine-induced proliferation and cell survival in normal and leukemic lymphocytes. J Leukoc Biol. 2009;86(5):1039-1048. [11] KUSNADI A, PARK SH, YUAN R, et al. The Cytokine TNF Promotes Transcription Factor SREBP Activity and Binding to Inflammatory Genes to Activate Macrophages and Limit Tissue Repair. Immunity. 2019;51(2):241-257.e9. [12] IM SS, YOUSEF L, BLASCHITZ C, et al. Linking lipid metabolism to the innate immune response in macrophages through sterol regulatory element binding protein-1a. Cell Metab. 2011;13(5):540-549. [13] KIDANI Y, ELSAESSER H, HOCK MB, et al. Sterol regulatory element-binding proteins are essential for the metabolic programming of effector T cells and adaptive immunity. Nat Immunol. 2013;14(5):489-499. [14] DANG EV, MCDONALD JG, RUSSELL DW, et al. Oxysterol Restraint of Cholesterol Synthesis Prevents AIM2 Inflammasome Activation. Cell. 2017;171(5):1057-1071.e11. [15] 伍莎莎,欧阳南,何泉,等.胆固醇敏感器SCAP功能失调通过上调P2X7受体表达促进THP-1源性巨噬细胞炎症小体活化[J].第三军医大学学报,2017, 39(13):1327-1332. [16] OUYANG N, GAN H, HE Q, et al. Dysfunction of cholesterol sensor SCAP promotes inflammation activation in THP-1 macrophages. Exp Cell Res. 2018;367(2):162-169. [17] GUO C, CHI Z, JIANG D, et al. Cholesterol Homeostatic Regulator SCAP-SREBP2 Integrates NLRP3 Inflammasome Activation and Cholesterol Biosynthetic Signaling in Macrophages. Immunity. 2018;49(5):842-856.e7. [18] SHEN HH, YANG YX, MENG X, et al. NLRP3: A promising therapeutic target for autoimmune diseases. Autoimmun Rev. 2018;17(7):694-702. [19] DE LA ROCHE M, HAMILTON C, MORTENSEN R, et al. Trafficking of cholesterol to the ER is required for NLRP3 inflammasome activation. J Cell Biol. 2018;217(10):3560-3576. [20] FRANCHI L, EIGENBROD T, MUÑOZ-PLANILLO R, et al. The inflammasome: a caspase-1-activation platform that regulates immune responses and disease pathogenesis. Nat Immunol. 2009;10(3):241-247. [21] RAUD B, MCGUIRE PJ, JONES RG, et al. Fatty acid metabolism in CD8+ T cell memory: Challenging current concepts. Immunol Rev. 2018;283(1):213-231. [22] HU MS, WALMSLEY GG, BARNES LA, et al. Delivery of monocyte lineage cells in a biomimetic scaffold enhances tissue repair. JCI Insight. 2017;2(19):e96260. [23] Reboldi A, Dang EV, McDonald JG, et al. Inflammation. 25-Hydroxycholesterol suppresses interleukin-1-driven inflammation downstream of type I interferon. Science. 2014;345(6197):679-684. [24] VASANJI A, GHOSH PK, GRAHAM LM, et al. Polarization of plasma membrane microviscosity during endothelial cell migration. Dev Cell. 2004;6(1):29-41. [25] GHOSH PK, VASANJI A, MURUGESAN G, et al. Membrane microviscosity regulates endothelial cell motility. Nat Cell Biol. 2002;4(11):894-900. [26] ZHOU RH, YAO M, LEE TS, et al. Vascular endothelial growth factor activation of sterol regulatory element binding protein: a potential role in angiogenesis. Circ Res. 2004;95(5):471-478. [27] LI A, DUBEY S, VARNEY ML, et al. IL-8 directly enhanced endothelial cell survival, proliferation, and matrix metalloproteinases production and regulated angiogenesis. J Immunol. 2003;170(6):3369-3376. [28] YAO M, ZHOU RH, PETREACA M, et al. Activation of sterol regulatory element-binding proteins (SREBPs) is critical in IL-8-induced angiogenesis. J Leukoc Biol. 2006;80(3):608-620. [29] YEH M, COLE AL, CHOI J, et al. Role for sterol regulatory element-binding protein in activation of endothelial cells by phospholipid oxidation products. Circ Res. 2004;95(8):780-788. [30] BENGOECHEA-ALONSO MT, PUNGA T, ERICSSON J. Hyperphosphorylation regulates the activity of SREBP1 during mitosis. Proc Natl Acad Sci U S A. 2005; 102(33):11681-11686. [31] BENGOECHEA-ALONSO MT, Ericsson J. Cdk1/cyclin B-mediated phosphorylation stabilizes SREBP1 during mitosis. Cell Cycle. 2006;5(15):1708-1718. [32] INOUE N, SHIMANO H, NAKAKUKI M, et al. Lipid synthetic transcription factor SREBP-1a activates p21WAF1/CIP1, a universal cyclin-dependent kinase inhibitor. Mol Cell Biol. 2005;25(20):8938-8947. [33] 庞晓文,张萍,刘雯,等.寻常型银屑病表皮中固醇调节元件结合蛋白-1表达模式的研究[J].中国麻风皮肤病杂志,2011,27(3):161-163. [34] PARK SH, KANG K, GIANNOPOULOU E, et al. Type I interferons and the cytokine TNF cooperatively reprogram the macrophage epigenome to promote inflammatory activation. Nat Immunol. 2017;18(10):1104-1116. [35] SEO YK, JEON TI, CHONG HK, et al. Genome-wide localization of SREBP-2 in hepatic chromatin predicts a role in autophagy. Cell Metab. 2011;13(4):367-375. [36] BROWN MS, RADHAKRISHNAN A, GOLDSTEIN JL. Retrospective on Cholesterol Homeostasis: The Central Role of Scap. Annu Rev Biochem. 2018;87:783-807. [37] ADAMS CM, REITZ J, DE BRABANDER JK, et al. Cholesterol and 25-hydroxycholesterol inhibit activation of SREBPs by different mechanisms, both involving SCAP and Insigs. J Biol Chem. 2004;279(50):52772-52780. [38] KAMISUKI S, MAO Q, ABU-ELHEIGA L, et al. A small molecule that blocks fat synthesis by inhibiting the activation of SREBP. Chem Biol. 2009;16(8):882-892. [39] SHAO W, MACHAMER CE, ESPENSHADE PJ. Fatostatin blocks ER exit of SCAP but inhibits cell growth in a SCAP-independent manner. J Lipid Res. 2016;57(8):1564-1573. [40] MCRAE S, IQBAL J, SARKAR-DUTTA M, et al. Withdrawal: The hepatitis C virus-induced NLRP3 inflammasome activates the sterol regulatory element-binding protein (SREBP) and regulates lipid metabolism. J Biol Chem. 2018;293(52):20011. [41] RAEDER MB, FERNØ J, GLAMBEK M, et al. Antidepressant drugs activate SREBP and up-regulate cholesterol and fatty acid biosynthesis in human glial cells. Neurosci Lett. 2006;395(3):185-190. [42] COLGAN SM, TANG D, WERSTUCK GH, et al. Endoplasmic reticulum stress causes the activation of sterol regulatory element binding protein-2. Int J Biochem Cell Biol. 2007;39(10):1843-1851. [43] LEE JN, YE J. Proteolytic activation of sterol regulatory element-binding protein induced by cellular stress through depletion of Insig-1. J Biol Chem. 2004;279(43):45257-45265. [44] KOTZKA J, LEHR S, ROTH G, et al. Insulin-activated Erk-mitogen-activated protein kinases phosphorylate sterol regulatory element-binding Protein-2 at serine residues 432 and 455 in vivo. J Biol Chem. 2004;279(21):22404-22411. [45] EID W, DAUNER K, COURTNEY KC, et al. mTORC1 activates SREBP-2 by suppressing cholesterol trafficking to lysosomes in mammalian cells. Proc Natl Acad Sci U S A. 2017;114(30):7999-8004. [46] FUHRMAN B, NITZAN O, KARRY R, et al. Urokinase plasminogen activator (uPA) stimulates cholesterol biosynthesis in macrophages through activation of SREBP-1 in a PI3-kinase and MEK-dependent manner. Atherosclerosis. 2007;195(2):e108-e116. [47] WALKER AK, JACOBS RL, WATTS JL, et al. A conserved SREBP-1/phosphatidylcholine feedback circuit regulates lipogenesis in metazoans. Cell. 2011;147(4):840-852. [48] KANG OH, KIM SB, MUN SH, et al. Puerarin ameliorates hepatic steatosis by activating the PPARα and AMPK signaling pathways in hepatocytes. Int J Mol Med. 2015;35(3):803-809. |
| [1] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [2] | Jin Tao, Liu Lin, Zhu Xiaoyan, Shi Yucong, Niu Jianxiong, Zhang Tongtong, Wu Shujin, Yang Qingshan. Osteoarthritis and mitochondrial abnormalities [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1452-1458. |
| [3] | Zhang Lichuang, Xu Hao, Ma Yinghui, Xiong Mengting, Han Haihui, Bao Jiamin, Zhai Weitao, Liang Qianqian. Mechanism and prospects of regulating lymphatic reflux function in the treatment of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1459-1466. |
| [4] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1260-1265. |
| [5] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1272-1277. |
| [6] | Tang Wenjing, Wu Siyuan, Yang Chen, Tao Xi. Inflammatory responses in post-stroke depression [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1278-1285. |
| [7] | Guo Jia, Ding Qionghua, Liu Ze, Lü Siyi, Zhou Quancheng, Gao Yuhua, Bai Chunyu. Biological characteristics and immunoregulation of exosomes derived from mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1093-1101. |
| [8] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1102-1106. |
| [9] | Zhou Hongqin, Wu Dandan, Yang Kun, Liu Qi. Exosomes that deliver specific miRNAs can regulate osteogenesis and promote angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1107-1112. |
| [10] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [11] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1119-1124. |
| [12] | Hui Xiaoshan, Bai Jing, Zhou Siyuan, Wang Jie, Zhang Jinsheng, He Qingyong, Meng Peipei. Theoretical mechanism of traditional Chinese medicine theory on stem cell induced differentiation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1125-1129. |
| [13] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [14] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1137-1142. |
| [15] | Hou Jingying, Guo Tianzhu, Yu Menglei, Long Huibao, Wu Hao. Hypoxia preconditioning targets and downregulates miR-195 and promotes bone marrow mesenchymal stem cell survival and pro-angiogenic potential by activating MALAT1 [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1005-1011. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||