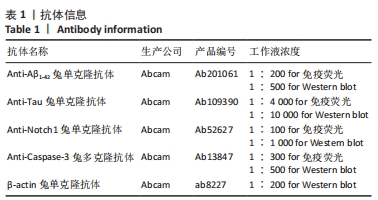
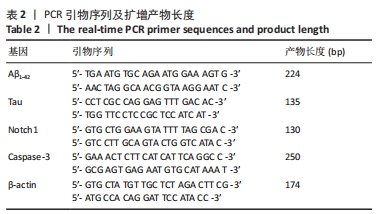
2.1 实验动物数量分析 实验选用小鼠80只,分为4组,实验过程中,AD运动组有1只小鼠死亡,最终进入结果分析72只(每组最终各选取18只小鼠进行取材)。
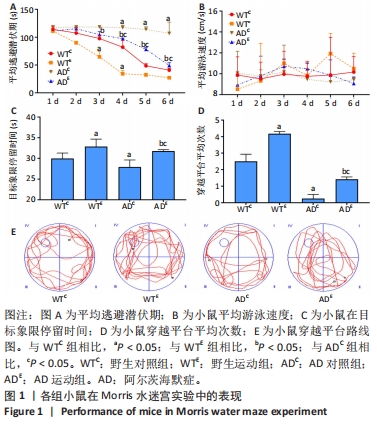
2.2 小鼠空间学习记忆能力检测结果 在Morris水迷宫定位航行训练实验过程中,伴随训练实验天数的增加,野生对照组、野生运动组与AD运动组小鼠的平均逃避潜伏期出现逐渐减小的趋势,而AD对照组小鼠的平均逃避潜伏期并未出现显著减小的趋势。通过重复方差分析逃避潜伏期结果表明:干预方式、基因型与时间的交互作用显著。以基因型和时间为主效应量,分析干预方式对小鼠潜伏期的影响:在野生型小鼠中,野生运动组从第2天开始,每天的逃避潜伏期均显著低于野生对照组(P < 0.05);在AD小鼠中,AD运动组从第1天开始,每天的逃避潜伏期均显著低于AD对照组(P < 0.05)。以干预方式和时间为主效应量,分析基因型对小鼠潜伏期的影响:在对照组中,AD对照组小鼠逃避潜伏期从第3天开始显著高于野生对照组(P < 0.05);在运动组中,AD运动组小鼠逃避潜伏期从第3天开始显著高于野生运动组(P < 0.05)。以干预方式和基因型为主效应量,分析时间对小鼠潜伏期的影响:只有AD对照组小鼠各时间点的逃避潜伏期均无显著差异(P > 0.05),见图1A。以上的数据能够说明AD对照组小鼠具有较低的空间参考学习能力,而其余各组小鼠则具有一定的空间参考学习能力,并且随着训练实验次数和天数的增加,能够通过参照水迷宫内壁的标记物建立寻找水下隐藏平台位置的记忆。
通过重复方差分析泳速结果表明:干预方式与基因型的交互作用显著。以基因型为主效应量,分析干预方式对小鼠泳速的影响:无论是野生型小鼠,还是AD小鼠,运动都没有显著影响小鼠的泳速(P > 0.05);以干预方式为主效应量,分析基因型对小鼠泳速的影响:无论是对照组小鼠,还是运动组小鼠,基因型都没有显著影响小鼠的泳速(P > 0.05),见图1B。这表明各组小鼠并无游泳运动障碍,且在Morris水迷宫定位航行训练实验中的逃避潜伏期差异并非由运动障碍所造成。
在60 s的空间探索实验中,通过两因素被试间方差分析小鼠在目标象限中所用时间:野生运动组在目标象限中停留的时间显著高于野生对照组(P=0.037),AD运动组在目标象限中停留的时间显著高于AD对照组(P=0.010);AD对照组在目标象限中停留的时间显著低于野生对照组(P=0.025),AD运动组在目标象限中停留的时间显著低于野生运动组(P=0.043),见图1C。通过两因素被试间方差分析小鼠穿越平台次数:野生运动组穿越原有平台区域的次数显著高于野生对照组(P < 0.005),AD运动组穿越原有平台区域的次数显著高于AD对照组(P=0.001);AD对照组穿越原有平台区域的次数显著低于野生对照组(P < 0.005),AD运动组穿越原有平台区域的次数显著低于野生运动组(P < 0.005),见图1D。小鼠穿越平台路线图,见图1E。
2.3 小鼠海马Aβ的表达 图2A为小鼠海马Aβ1-42 mRNA表达。通过两因素被试间方差分析小鼠海马Aβ1-42 mRNA表达结果:野生运动组Aβ1-42 mRNA表达与野生对照组相比没有显著差异,AD运动组Aβ1-42 mRNA表达显著低于AD对照组(P=0.032);AD对照组Aβ1-42 mRNA表达显著高于野生对照组,AD运动组Aβ1-42 mRNA表达与野生运动组相比没有显著差异(P=0.129)。图2B为小鼠海马Aβ1-42 蛋白表达。通过两因素被试间方差分析小鼠海马Aβ1-42蛋白表达结果:野生运动组Aβ1-42蛋白表达与野生对照组相比没有显著差异,AD运动组Aβ1-42蛋白表达显著低于AD对照组(P < 0.000 5);AD对照组Aβ1-42 蛋白表达显著高于野生对照组,AD运动组Aβ1-42蛋白表达显著高于野生运动组(P < 0.000 5)。

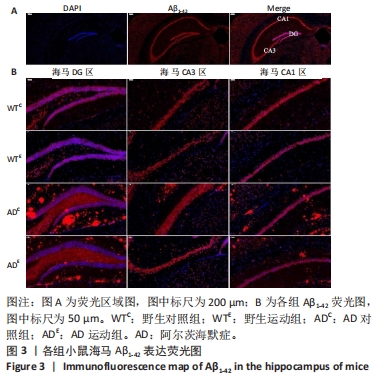
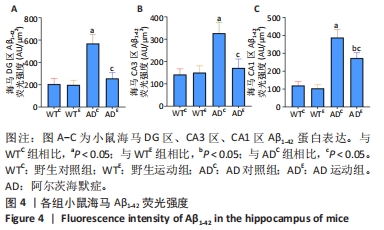
利用荧光显微镜对免疫荧光切片进行扫描成像,并利用CaseViewer软件选取所需区域图片。图3中蓝色代表DAPI标记的细胞核,红色代表Aβ1-42免疫阳性产物表达。采用Image-Pro Plus 6.0软件测定荧光强度。通过两因素被试间方差分析小鼠海马DG区的Aβ1-42免疫阳性产物荧光强度:野生运动组Aβ1-42免疫阳性产物荧光强度与野生对照组相比没有显著差异,AD运动组Aβ1-42免疫阳性产物荧光强度显著低于AD对照组(P < 0.000 5);AD对照组Aβ1-42免疫阳性产物荧光强度显著高于野生对照组,AD运动组Aβ1-42免疫阳性产物荧光强度与野生运动组相比无显著差异(P=0.104),见图4A。通过两因素被试间方差分析小鼠海马CA3区的Aβ1-42免疫阳性产物荧光强度:野生运动组Aβ1-42免疫阳性产物荧光强度与野生对照组相比没有显著差异,AD运动组Aβ1-42免疫阳性产物荧光强度显著低于AD对照组(P < 0.000 5);AD对照组Aβ1-42免疫阳性产物荧光强度显著高于野生对照组,AD运动组Aβ1-42免疫阳性产物荧光强度与野生运动组相比无显著差异(P=0.353),见图4B。通过两因素被试间方差分析小鼠海马CA1区的Aβ1-42免疫阳性产物荧光强度:野生运动组Aβ1-42免疫阳性产物荧光强度与野生对照组相比没有显著差异,AD运动组Aβ1-42免疫阳性产物荧光强度显著低于AD对照组(P < 0.000 5);AD对照组Aβ1-42免疫阳性产物荧光强度显著高于野生对照组(P < 0.000 5),AD运动组Aβ1-42免疫阳性产物荧光强度显著高于野生运动组(P < 0.000 5),见图4C。这表明AD转基因小鼠海马组织中出现了大量的Aβ1-42沉积,而长期有氧运动似乎可以减少其海马组织中Aβ1-42的沉积。
2.4 小鼠海马Tau的表达 图5A为小鼠海马Tau mRNA表达。通过两因素被试间方差分析小鼠海马Tau mRNA表达结果:野生运动组Tau mRNA表达显著低于野生对照组,AD运动组Tau mRNA表达显著低于AD对照组(P < 0.000 5);AD对照组Tau mRNA表达显著高于野生对照组,AD运动组Tau mRNA表达显著高于野生运动组(P=0.002)。图5B为小鼠海马Tau蛋白表达。通过两因素被试间方差分析小鼠海马Tau蛋白表达结果:野生运动组Tau蛋白表达与野生对照组相比没有显著差异,AD运动组Tau蛋白表达显著低于AD对照组(P < 0.000 5);AD对照组Tau蛋白表达显著高于野生对照组,AD运动组Tau蛋白表达与野生运动组相比没有显著差异(P=0.125)。
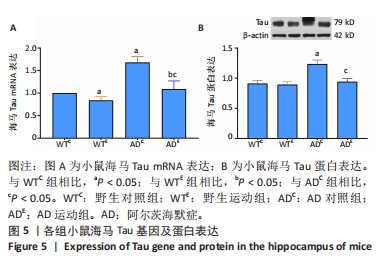
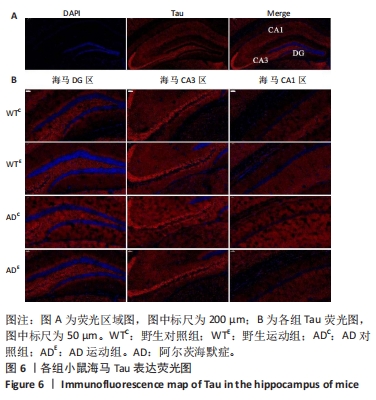
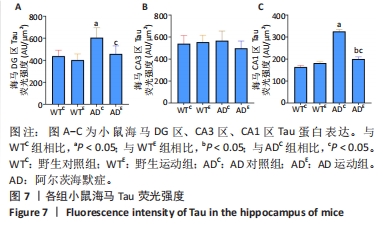
图6中蓝色代表DAPI标记的细胞核,红色代表Tau免疫阳性产物表达。通过两因素被试间方差分析小鼠海马DG区的Tau免疫阳性产物荧光强度:野生运动组Tau免疫阳性产物荧光强度与野生对照组相比没有显著差异,AD运动组Tau免疫阳性产物荧光强度显著低于AD对照组(P=0.002);AD对照组Tau免疫阳性产物荧光强度显著高于野生对照组,AD运动组Tau免疫阳性产物荧光强度与野生运动组相比无显著差异(P=0.188),见图7A。通过两因素被试间方差分析小鼠海马CA3区的Tau免疫阳性产物荧光强度:各组之间免疫阳性产物荧光强度相比无显著差异,见图7B。通过两因素被试间方差分析小鼠海马CA1区的Tau免疫阳性产物荧光强度:野生运动组Tau免疫阳性产物荧光强度与野生对照组相比无显著差异,AD运动组Tau免疫阳性产物荧光强度显著低于AD对照组(P=0.002);AD对照组Tau免疫阳性产物荧光强度显著高于野生对照组,AD运动组Tau免疫阳性产物荧光强度显著高于野生运动组(P=0.001),见图7C。这表明AD转基因小鼠海马,尤其是DG区、CA1区组织中出现了大量的Tau蛋白,而长期有氧运动似乎可以减少Tau蛋白的表达。
2.5 小鼠海马Notch1的表达 图8A为小鼠海马Notch1 mRNA表达。野生运动组海马Notch1 mRNA表达与野生对照组相比没有显著差异(P > 0.05);AD对照组海马Notch1 mRNA表达显著高于野生对照组 (P < 0.05);而AD运动组海马Notch1 mRNA表达显著低于AD对照组(P < 0.05),但AD运动组海马Notch1 mRNA表达与野生运动组相比没有显著差异(P > 0.05)。图8B为小鼠海马Notch1蛋白表达。野生运动组Notch1蛋白表达与野生对照组相比没有显著差异(P > 0.05);AD对照组Notch1蛋白表达显著高于野生对照组 (P < 0.05);而AD运动组Notch1蛋白表达显著低于AD对照组(P < 0.05),且AD运动组Notch1蛋白表达显著高于野生运动组 (P < 0.05)。
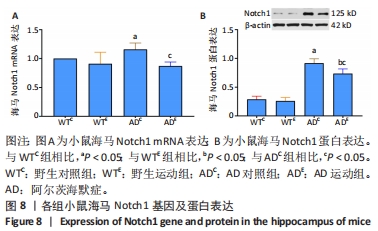
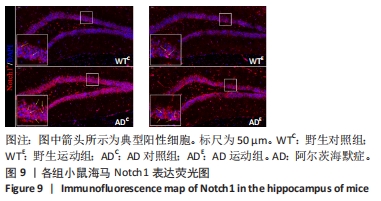
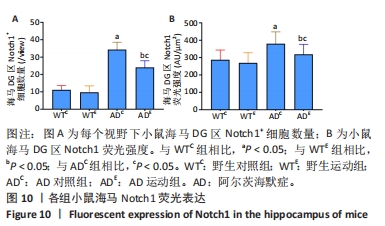
图9中蓝色代表DAPI标记的细胞核,红色代表Notch1免疫阳性产物表达。图10A为每个视野下海马DG区Notch1阳性细胞数量,野生运动组海马DG区Notch1阳性细胞数量与野生对照组相比没有显著差异(P > 0.05);AD对照组海马DG区的Notch1阳性细胞数量显著高于野生对照组(P < 0.05);AD运动组海马DG区Notch1阳性细胞数量显著低于AD对照组(P < 0.05),但AD运动组海马DG区Notch1阳性细胞数量显著高于野生运动组(P < 0.05)。图10B为小鼠海马DG区Notch1荧光强度:野生运动组海马DG区Notch1免疫阳性产物荧光强度与野生对照组相比没有显著差异(P > 0.05);AD对照组海马DG区Notch1免疫阳性产物荧光强度显著高于野生对照组(P < 0.05);AD运动组海马DG区Notch1免疫阳性产物荧光强度显著低于AD对照组 (P < 0.05),但AD运动组海马DG区的Notch1免疫阳性产物荧光强度显著高于野生运动组(P < 0.05)。这表明野生型小鼠海马DG区Notch1的表达并未受到运动的影响,而AD转基因小鼠海马Notch1的表达相较于野生型小鼠显著升高,且长期有氧运动能够显著减少其海马Notch1的表达,这可能预示着运动会通过影响AD转基因小鼠Notch信号通路,从而调节其成年海马神经发生。
2.6 小鼠海马Caspase-3的表达 图11A为小鼠海马Caspase-3 mRNA表达。野生运动组海马Caspase-3 mRNA表达与野生对照组相比没有显著差异(P > 0.05);AD对照组海马Caspase-3 mRNA表达显著高于野生对照组(P < 0.05);而AD运动组海马Caspase-3 mRNA表达显著低于AD对照组(P < 0.05),且AD运动组海马Caspase-3 mRNA表达显著高于野生运动组(P < 0.05)。图11B为小鼠海马Caspase-3蛋白表达。野生运动组海马Caspase-3蛋白表达显著低于野生对照组(P < 0.05);AD对照组海马Caspase-3蛋白表达显著高于野生对照组(P < 0.05);而AD运动组海马Caspase-3蛋白表达显著低于AD对照组(P < 0.05),且AD运动组海马Caspase-3蛋白表达显著高于野生运动组 (P < 0.05)。
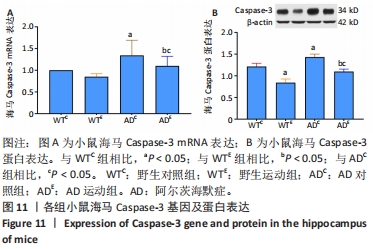
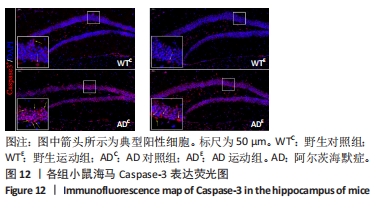
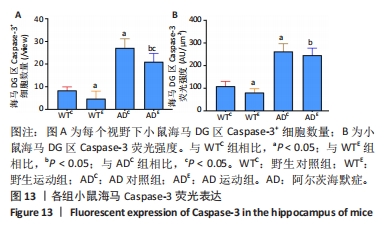
图12中蓝色代表DAPI标记的细胞核,红色代表Caspase-3免疫阳性产物表达。图13A为每个视野下小鼠海马DG区Caspase-3阳性细胞数量,野生运动组海马DG区Caspase-3阳性细胞数量显著低于野生对照组 (P < 0.05);AD对照组海马DG区的Caspase-3阳性细胞数量显著高于野生对照组(P < 0.05);AD运动组海马DG区Caspase-3阳性细胞数量显著低于AD对照组(P < 0.05),但AD运动组海马DG区Caspase-3阳性细胞数量显著高于野生运动组(P < 0.05)。图13B为小鼠海马DG区Caspase-3荧光强度:野生运动组海马DG区Caspase-3免疫阳性产物荧光强度显著低于野生对照组(P < 0.05);AD对照组海马DG区Caspase-3免疫阳性产物荧光强度显著高于野生对照组(P < 0.05);AD运动组海马DG区Caspase-3免疫阳性产物荧光强度与AD对照组相比没有显著差异(P > 0.05),但AD运动组海马DG区的Caspase-3免疫阳性产物荧光强度显著高于野生运动组(P < 0.05)。这表明长期有氧运动可以显著降低野生型小鼠海马DG区Caspase-3的表达,AD转基因小鼠海马Caspase-3的表达相较于野生型小鼠显著升高,而长期有氧运动能够显著减少其海马Caspase-3阳性细胞的数量。