中国组织工程研究 ›› 2017, Vol. 21 ›› Issue (4): 603-608.doi: 10.3969/j.issn.2095-4344.2017.04.019
• 组织构建细胞学实验 cytology experiments in tissue construction • 上一篇 下一篇
十子代平方影响小鼠MIN6细胞凋亡及MEK1/2、ERK1/2的表达
程瑞婷,董玉山,李继安,喇孝瑾,田春雨,高秀娟,周雪梅,付茜茹,吴 博,董思圻
- 华北理工大学中医学院,河北省唐山市 063000
Effects of Shizidaiping formula on MIN6 cell apoptosis and expressions of MEK1/2 and ERK1/2
Cheng Rui-ting, Dong Yu-shan, Li Ji-an, La Xiao-jin, Tian Chun-yu, Gao Xiu-juan, Zhou Xue-mei, Fu Qian-ru,Wu Bo, Dong Si-qi
- Institute of Traditional Chinese Medicine of North China University of Science and Technology, Tangshan 063000, Hebei Province, China
摘要:
文章快速阅读:
.jpg) 文题释义:
十子代平方:由菟丝子、女贞子、莱菔子、苏子、车前子、茺蔚子、枸杞子、决明子、白芥子、五味子10味临床常用中药组成,研究表明该方可以有效抑制3T3-L1 脂肪细胞增殖,改善其胰岛素抵抗。
MIN6细胞:MIN6小鼠胰岛β细胞株是肉瘤病毒40(SV40)通过T细胞转染非肥胖糖尿病小鼠(NOD鼠)得到的胰岛细胞瘤株,在高糖浓度时胰岛素的分泌明显增加,其胰岛素分泌量和S型反应曲线类似于培养的正常胰岛细胞 。
ERK1/2:细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)分为ERK1 和ERK2,统称为ERK1 /2,主要被各种生长因子、离子射线、过氧化氢等磷酸化而激活,进入细胞核作用于E1k-1,c-myc,c-fos,c-jun,ATF,NF-kB和AP-1等转录因子,促进某些基因的转录与表达,和细胞的增殖与分化密切相关。
文题释义:
十子代平方:由菟丝子、女贞子、莱菔子、苏子、车前子、茺蔚子、枸杞子、决明子、白芥子、五味子10味临床常用中药组成,研究表明该方可以有效抑制3T3-L1 脂肪细胞增殖,改善其胰岛素抵抗。
MIN6细胞:MIN6小鼠胰岛β细胞株是肉瘤病毒40(SV40)通过T细胞转染非肥胖糖尿病小鼠(NOD鼠)得到的胰岛细胞瘤株,在高糖浓度时胰岛素的分泌明显增加,其胰岛素分泌量和S型反应曲线类似于培养的正常胰岛细胞 。
ERK1/2:细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)分为ERK1 和ERK2,统称为ERK1 /2,主要被各种生长因子、离子射线、过氧化氢等磷酸化而激活,进入细胞核作用于E1k-1,c-myc,c-fos,c-jun,ATF,NF-kB和AP-1等转录因子,促进某些基因的转录与表达,和细胞的增殖与分化密切相关。
.jpg) 文题释义:
十子代平方:由菟丝子、女贞子、莱菔子、苏子、车前子、茺蔚子、枸杞子、决明子、白芥子、五味子10味临床常用中药组成,研究表明该方可以有效抑制3T3-L1 脂肪细胞增殖,改善其胰岛素抵抗。
MIN6细胞:MIN6小鼠胰岛β细胞株是肉瘤病毒40(SV40)通过T细胞转染非肥胖糖尿病小鼠(NOD鼠)得到的胰岛细胞瘤株,在高糖浓度时胰岛素的分泌明显增加,其胰岛素分泌量和S型反应曲线类似于培养的正常胰岛细胞 。
ERK1/2:细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)分为ERK1 和ERK2,统称为ERK1 /2,主要被各种生长因子、离子射线、过氧化氢等磷酸化而激活,进入细胞核作用于E1k-1,c-myc,c-fos,c-jun,ATF,NF-kB和AP-1等转录因子,促进某些基因的转录与表达,和细胞的增殖与分化密切相关。
文题释义:
十子代平方:由菟丝子、女贞子、莱菔子、苏子、车前子、茺蔚子、枸杞子、决明子、白芥子、五味子10味临床常用中药组成,研究表明该方可以有效抑制3T3-L1 脂肪细胞增殖,改善其胰岛素抵抗。
MIN6细胞:MIN6小鼠胰岛β细胞株是肉瘤病毒40(SV40)通过T细胞转染非肥胖糖尿病小鼠(NOD鼠)得到的胰岛细胞瘤株,在高糖浓度时胰岛素的分泌明显增加,其胰岛素分泌量和S型反应曲线类似于培养的正常胰岛细胞 。
ERK1/2:细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)分为ERK1 和ERK2,统称为ERK1 /2,主要被各种生长因子、离子射线、过氧化氢等磷酸化而激活,进入细胞核作用于E1k-1,c-myc,c-fos,c-jun,ATF,NF-kB和AP-1等转录因子,促进某些基因的转录与表达,和细胞的增殖与分化密切相关。摘要
背景:胰岛细胞渐进凋亡与长期高糖高脂损伤密切相关。
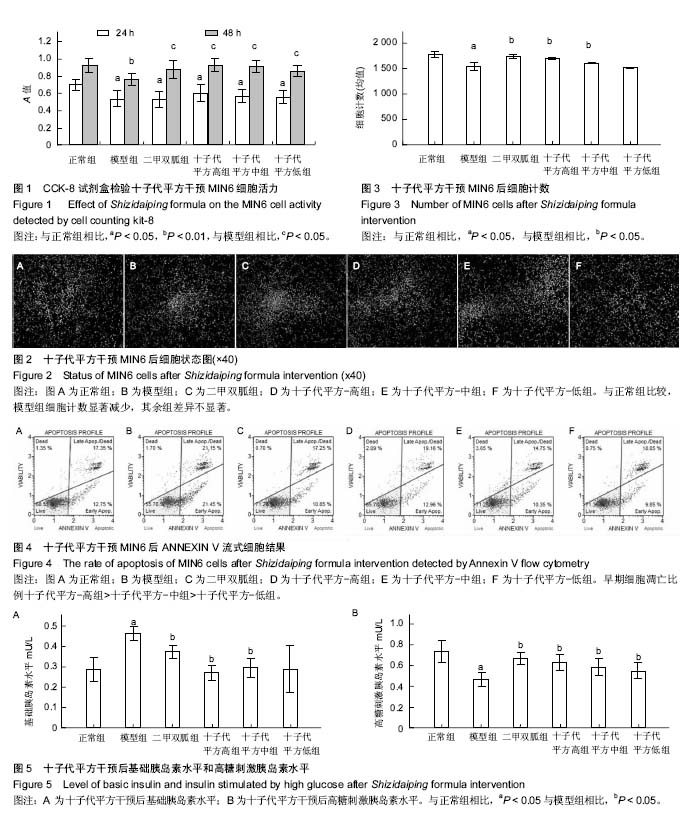
目的:观察十子代平方对高糖高脂损伤的MIN6细胞凋亡和胰岛素分泌的作用,分析十子代平方对MIN6细胞的保护作用和凋亡相关机制。
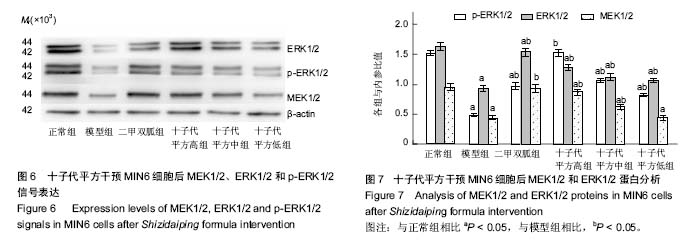
方法:细胞实验以MIN6细胞株作为实验对象,设正常组、模型组、二甲双胍组、十子代平方-高、十子代平方-中、十子代平方-低。CCK-8试剂盒检测十子代平方对MIN6细胞活性的影响;ELISA法检测其对胰岛素分泌的影响;Annexin V-FITC&PI 双染法检测其对凋亡的影响,Western Blotting法检测MEK1/2、ERK1/2和p-ERK1/2的表达水平。
结果与结论:①十子代平方能显著改善MIN6细胞在高糖高脂损伤下的细胞活力(P < 0.05),减少细胞早期凋亡,增加高糖刺激后上清液中的胰岛素水平(P < 0.05),提高MEK1/2、ERK1/2和p-ERK1/2表达水平(P < 0.05);②结果说明,十子代平方能够提高高糖高脂损伤的胰岛MIN6细胞活力、减轻胰岛素分泌负荷、抑制MIN6细胞凋亡,从而保护MIN6细胞。
中国组织工程研究杂志出版内容重点:组织构建;骨细胞;软骨细胞;细胞培养;成纤维细胞;血管内皮细胞;骨质疏松;组织工程
ORCID: 0000-0002-8577-9070(程瑞婷)
中图分类号:
.jpg) 文题释义:
十子代平方:由菟丝子、女贞子、莱菔子、苏子、车前子、茺蔚子、枸杞子、决明子、白芥子、五味子10味临床常用中药组成,研究表明该方可以有效抑制3T3-L1 脂肪细胞增殖,改善其胰岛素抵抗。
MIN6细胞:MIN6小鼠胰岛β细胞株是肉瘤病毒40(SV40)通过T细胞转染非肥胖糖尿病小鼠(NOD鼠)得到的胰岛细胞瘤株,在高糖浓度时胰岛素的分泌明显增加,其胰岛素分泌量和S型反应曲线类似于培养的正常胰岛细胞 。
ERK1/2:细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)分为ERK1 和ERK2,统称为ERK1 /2,主要被各种生长因子、离子射线、过氧化氢等磷酸化而激活,进入细胞核作用于E1k-1,c-myc,c-fos,c-jun,ATF,NF-kB和AP-1等转录因子,促进某些基因的转录与表达,和细胞的增殖与分化密切相关。
文题释义:
十子代平方:由菟丝子、女贞子、莱菔子、苏子、车前子、茺蔚子、枸杞子、决明子、白芥子、五味子10味临床常用中药组成,研究表明该方可以有效抑制3T3-L1 脂肪细胞增殖,改善其胰岛素抵抗。
MIN6细胞:MIN6小鼠胰岛β细胞株是肉瘤病毒40(SV40)通过T细胞转染非肥胖糖尿病小鼠(NOD鼠)得到的胰岛细胞瘤株,在高糖浓度时胰岛素的分泌明显增加,其胰岛素分泌量和S型反应曲线类似于培养的正常胰岛细胞 。
ERK1/2:细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)分为ERK1 和ERK2,统称为ERK1 /2,主要被各种生长因子、离子射线、过氧化氢等磷酸化而激活,进入细胞核作用于E1k-1,c-myc,c-fos,c-jun,ATF,NF-kB和AP-1等转录因子,促进某些基因的转录与表达,和细胞的增殖与分化密切相关。