1.1 设计 网络药理学分析结合细胞生物学实验结果验证,单因素方差分析。
1.2 时间及地点 于2022年3-5月在新疆医科大学第一附属医院临床研究院分子生物学实验室完成。
1.3 材料
1.3.1 组织样本来源 皮肤瘢痕组织标本取自来新疆医科大学第一附属医院整形美容外科就诊并接受手术的3例增生性瘢痕患者,平均年龄31.2岁,女1例,男2例。
纳入标准:经术前临床诊断及术后病理检查确诊为增生性瘢痕,无全身系统性疾病,术前未接受过任何抑制增生性瘢痕治疗的患者。
排除标准:术前接受过增生性瘢痕的相关治疗的患者。
组织标本经去除表皮和皮下脂肪层步骤后用于原代培养增生性瘢痕成纤维细胞。该研究经新疆医科大学第一附属医院伦理委员会批准,批准号:20170214-71,批准时间:2017年2月,并在取样前得到了患者及家属知情同意。
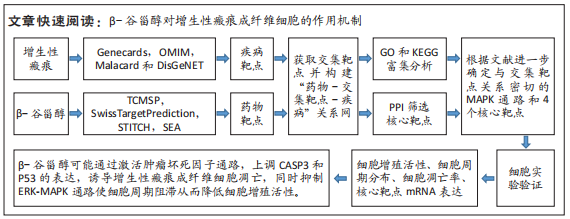
1.3.2 网络药理学资料 文章所采用的数据库及软件信息,见图1。

1.4 方法
1.4.1 药物的潜在靶点筛选 基于中药系统药理学分析平台(Traditional Chinese Medicine Database and Analysis Platform,TCMSP)、小分子药物靶点预测在线平台(SwissTargetPrediction)、化学物质和蛋白质相互作用关系数据库(STITCH)和相似度集成算法数据库(Similarity Ensemble Approach,SEA)对“β-Sitosterol”进行检索,收集各数据库的潜在靶点并去重及合并。
1.4.2 增生性瘢痕的疾病靶点筛选 使用关键词“Hypertrophic scar”在常用疾病靶点数据库(Genecards、OMIM、Malacard和DisGeNET)上检索增生性瘢痕相关的已知基因;对检索结果进行去重、合并。
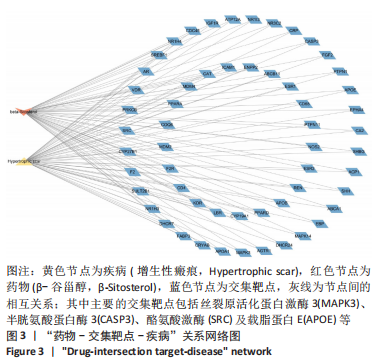
1.4.3 药物与疾病共同靶点确定 将上述β-谷甾醇的潜在靶点通过 Uniprot数据库转换为标准基因名称,然后将药物的潜在靶点基因与增生性瘢痕相关已知基因用Venn(http://bioinformatics. psb.ugent.be/webtools/Venn/)取交集,获得共同靶点。
1.4.4 药物-靶点-疾病关系网络构建 利用Cytoscape软件将药物和疾病的交集靶点构建成“药物-靶点-疾病”网络。网络节点和边分别表示属性类型和相互关系。
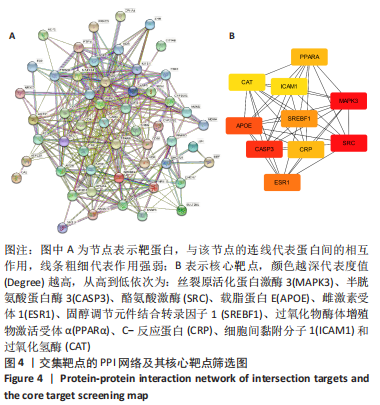
1.4.5 蛋白质的相互作用(protein-protein interaction,PPI)网络构建和核心靶点的筛选 在STRING在线软件中输入上述交集靶点,参数设置:限定物种为Homo sapiens,最低要求互动分数0.700,隐藏不互动的单一靶点,其他参数为默认设置。将生成的TSV文件导入Cytoscape软件,利用Cytohubba插件筛选PPI网络中Degree值前10的关键靶点。
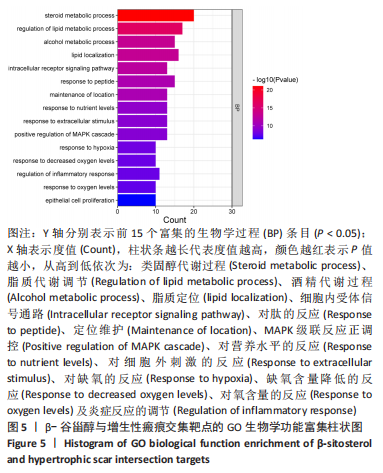
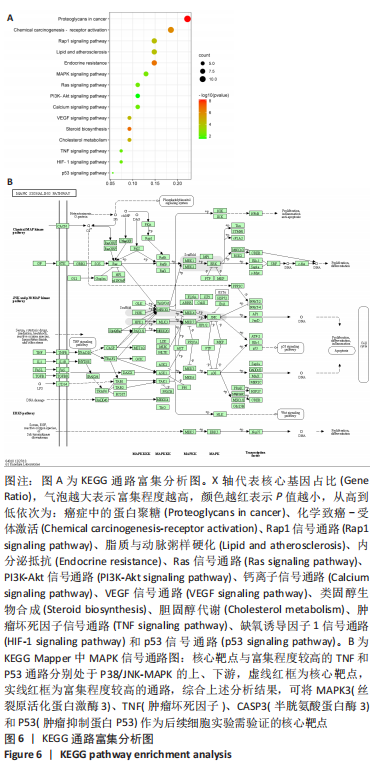
1.4.6 GO生物学功能与KEGG通路富集分析 将上述交集靶点基因输入DAVID数据库进行GO生物学功能和KEGG通路富集分析,限定物种为Homo sapiens,P < 0.05为有显著性差异。将富集程度前15位的部分结果进行可视化分析。根据文献报道和信号通路的富集程度,进一步筛选核心靶点。
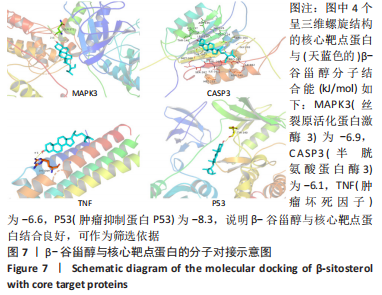
1.4.7 分子对接 从PDB数据库搜索核心靶点并下载蛋白质3D结构(pdb格式)。应用AutoDock软件对靶蛋白进行加水、去氢、分离配体和受体等,并将β-谷甾醇(配体)及核心靶点蛋白转换为pdbqt格式。计算靶点与配体之间的对接活性,结合能<−5.0分(kJ/mol)说明两者之间对接良好,<−7.0分(kJ/mol)有强烈的亲和力。然后选择亲和性靠前的生成构象作为核心靶点并在Pymol中可视化。
1.4.8 细胞实验验证
增生性瘢痕成纤维细胞分离及培养:将0.5 cm×0.4 cm×0.4 cm大小的组织块以一定密度在培养皿中贴壁孵育4 h后,加用体积分数10%胎牛血清(美国Gibco公司,42F7180K)的DMEM(美国Gibco公司,C1199500BT)约8 mL,每隔4 d换1次液,约2周后可见成纤维细胞呈涡旋状围绕组织块底部爬出,细胞融合度达80%时按1∶2传代,取第3-6代细胞用于后续实验。
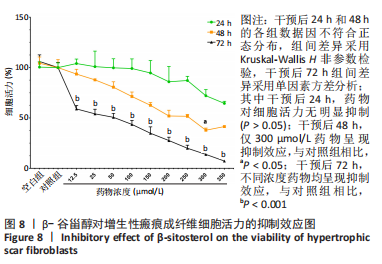
β-谷甾醇对增生性瘢痕成纤维细胞增殖活力的影响:将100 μL细胞悬液种到96孔板中,细胞度为2 500个/孔,待细胞稳定后进行药物处理,药物组每孔依次加入含12.5,25,50,100,150,200,250,300,350 μmol/L β-谷甾醇(美国Sigma公司,药物编号:S1270)的培养基,对照组加入不含药的等体积培养基(仅含DMSO),空白组(无细胞)只加入等体积培养基,每组设5个复孔,分别于处理24,48,72 h后,记录细胞形态,每孔加10 μL的CCK8溶液(中国碧云天公司,药物编号C0038),在37 ℃、体积分数5% CO2培养箱中培养1-4 h;吸弃孔内上清液。选择450 nm波长,在酶标仪(美国BioTek公司,ELx800)上测定各孔光吸收度(A)值,计算细胞活力=(A药物组-A空白组)/(A对照组-A空白组) ×100%。
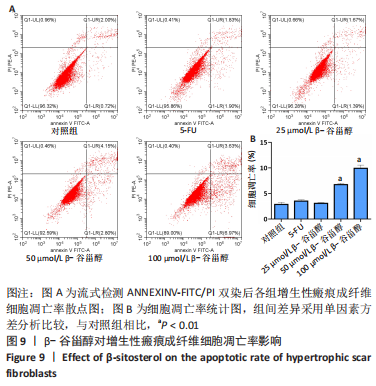
药物干预及分组:将增生性瘢痕成纤维细胞分为对照组、低浓度药物组、中浓度药物组、高浓度药物组和五氟尿嘧啶(5-FU)组。对照组使用不含药培养基干预,低、中、高浓度药物组分别用含25,50,100 μmol/L β-谷甾醇的培养基干预72 h,5-FU组使用质量浓度0.25 g/L的5-FU(中国麦克林公司,药物编号:F809394)的培养基干预72 h。
β-谷甾醇对增生性瘢痕成纤维细胞凋亡的影响:按2×105个/皿的密度将增生性瘢痕成纤维细胞接种于60 mm培养皿,37 ℃、体积分数5% CO2培养箱(美国Thermo Fisher公司,药物编号:3111)中过夜,细胞融合度达50%-60%时进行上述分组干预。72 h后收集细胞,用4 ℃预冷PBS洗涤2次,然后用500 μL结合缓冲液重悬细胞,调节其浓度为1010 L-1;取100 μL细胞悬浮于5 mL的流式管中,加入5 μL Annexin V-FITC(美国Biolegend,药物编号:640914)混匀后,再加入5 μL Propidium Iodide混匀,于室温避光孵育15 min;加样于流式细胞仪(美国BECKMAN公司,CytoFLEX)检测细胞凋亡率。计算凋亡率=UR+LR,其中UR为右上现象的晚期凋亡和死亡细胞,LR为右下象限的早期凋亡细胞。
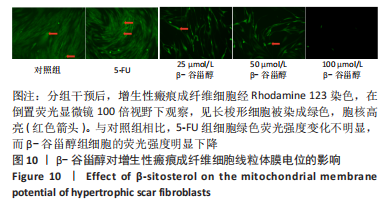
β-谷甾醇对增生性瘢痕成纤维细胞线粒体膜电位的影响:按照2×104个/孔的密度将增生性瘢痕成纤维细胞接种到24孔板中,待细胞贴壁后进行上述分组干预,72 h后用Rhodamine 123染色:①按照每1 µL的Rhodamine 123 (中国碧云天公司,药物编号:C2008S,1 000×)加入1 mL检测缓冲液的比例配制染色工作液;②吸除培养液,加入1 mL染色工作液,培养箱中37 ℃孵育30 min;③吸除上清,洗涤2次;④加入2 mL预热的培养液;⑤倒置荧光显微镜(日本尼康公司,DS-Fi3)下观察绿色荧光并拍照(每组3个视野)。
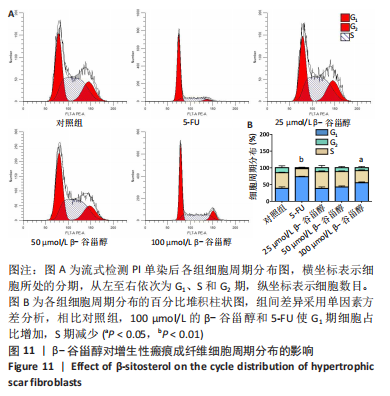
β-谷甾醇对增生性瘢痕成纤维细胞周期分布的影响:分组干预后收集细胞,1 500 r/min离心5 min,去上清,洗涤2次;调整细胞浓度为1×109 L-1,取1 mL单细胞悬液再次离心后去除上清,加入体积分数70%的冷乙醇500 μL吹打均匀固定,4 ℃过夜;PBS洗去固定液后,每样加入500 μL PI/RNA(体积比9∶1)染色工作液(细胞周期检测试剂盒购自中国凯基生物公司,药物编号:KGA512),室温避光孵育30 min后于流式细胞仪,激发波长488 nm检测细胞中PI标记的DNA含量。PI可以与DNA结合,其荧光强度直接反映了细胞内DNA含量。因此,通过流式细胞仪PI染色法对细胞内DNA含量进行检测时,可以将细胞周期各时相区分为G1期,S期和G2期,获得的流式直方图对应的各细胞周期可通过软件计算各时相的细胞百分率。
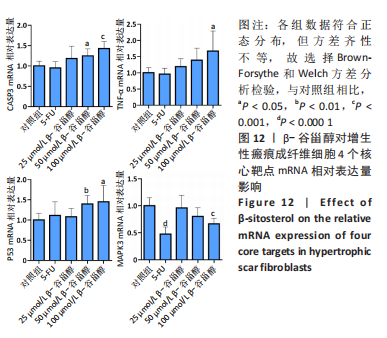
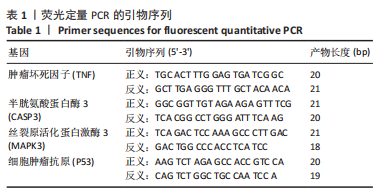
β-谷甾醇对增生性瘢痕成纤维细胞核心靶点mRNA表达的影响:利用Primer Premier 5.0软件设计靶点基因的特异性引物对,见表1,由广州擎科生物工程有限公司合成。分组干预后收集细胞,使用TRIzol RNA提取试剂盒(美国Invitrogen公司,药物编号:15596-026)提取细胞样本总RNA,以人内源性β-actin为内参基因,用SYBR GREEN II qPCR法进行PCR扩增(反转录试剂盒为日本TaKaRa公司,RR047A;荧光定量检测仪为美国Bio-Rad公司,CFX96),条件为:95 ℃,10 min预变性;随后95 ℃,15 s,60 ℃,30 s,共40次循环。每份重复样品各设3个qPCR反应并取平均值,以阴性对照组结果为参照,采用2-ΔΔCt法计算目的基因相对表达水平[17]。
1.5 主要观察指标 构建“药物-靶点-疾病”网络和蛋白质互作网络(PPI),同时筛选出PPI中核心作用靶点。采用体外细胞实验验证β-谷甾醇对人增生性瘢痕成纤维细胞增殖、凋亡、细胞周期分布和核心靶点基因mRNA表达的影响。
1.6 统计学分析 采用Graphpad Prism 9软件进行数据分析并绘制图片。计量数据以x±s表示,组间数据符合正态分布且方差齐性相等,多组间差异采用单因素方差分析检验;若方差不齐,采用Brown-Forsythe和Welch 方差分析检验组间数据差异;若不符合正态分布且方差不齐,则采用Kruskal-Wallis H非参数检验组间数据差异。P < 0.05表示差异有显著性意义。