Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (13): 2075-2080.doi: 10.12307/2022.336
Previous Articles Next Articles
Effects of various methods on improving bone marrow mesenchymal stem cell transplantation for spinal cord injury
Sun Jianwei1, Yang Xinming2, An Xiaogang3
- 1Graduate School of Hebei North University, Zhangjiakou 075000, Hebei Province, China; 2First Affiliated Hospital of Hebei North University, Zhangjiakou 075000, Hebei Province, China; 3Handan Branch of Jizhong Energy Fengfeng Group General Hospital, Handan 056000, Hebei Province, China
-
Received:2020-11-30Revised:2020-12-05Accepted:2021-01-16Online:2022-05-08Published:2021-12-20 -
Contact:Yang Xinming, Professor, First Affiliated Hospital of Hebei North University, Zhangjiakou 075000, Hebei Province, China -
About author:Sun Jianwei, Master candidate, Graduate School of Hebei North University, Zhangjiakou 075000, Hebei Province, China -
Supported by:Hebei Provincial Health Department’s 2011 Medical Science Research Key Project Plan, No. 20110176 (to YXM); 2013 Hebei North University Innovative Talent Cultivation Fund Project, No. CXRC1322 (to YXM)
CLC Number:
Cite this article
Sun Jianwei, Yang Xinming, An Xiaogang. Effects of various methods on improving bone marrow mesenchymal stem cell transplantation for spinal cord injury[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(13): 2075-2080.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
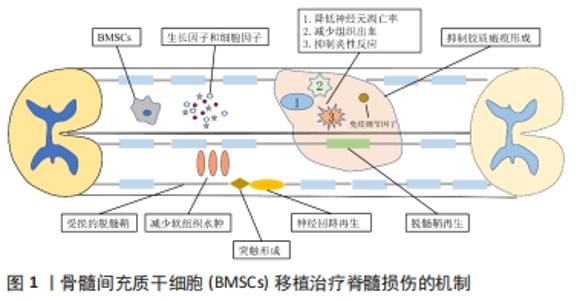
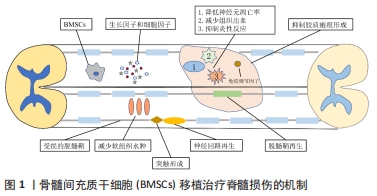
2.1 骨髓间充质干细胞的生物学特性 FRIEDENSTEIN等[4]最早发现骨髓间充质干细胞是一种能够贴附在培养板表面进行生长的成纤维样细胞群,由于能够分化为间充质组织细胞,故称为间充质干细胞。骨髓间充质干细胞可以沿着不同间充质谱系进行分化,在特定的条件下能够诱导分化成多种不同细胞,例如神经细胞、心肌细胞、骨细胞、脂肪细胞和软骨细胞等。骨髓间充质干细胞移植修复组织损伤的生物学特点包括:①增殖能力:骨髓间充质干细胞体外培养时显示出很强的增殖分化能力,ASSINCK等[5]研究发现,大约有20%骨髓间充质干细胞处在细胞周期的G0期,但可以满足细胞增殖分化所需的细胞供给,在适宜条件下,10 mL的标本经过3代6周的培养可扩增2×109倍;②多向分化潜能:在适当的诱导条件下,骨髓间充质干细胞能够分化为其他间充质细胞系,如骨骼肌细胞和腱细胞等,同时也能分化为非实质细胞谱系,如神经元等[6];③可塑性:当骨髓间充质干细胞处于不同环境中时,将显著影响转录因子的表达水平,不仅能够分化为中胚层的间质组织,还能分化为内、外胚层组织,包括神经细胞、肝脏、肺脏和血管等[7-8];④低免疫原性:骨髓间充质干细胞不表达组织相容性复合体Ⅱ类抗原及CD40、CD80、CD86等因子而获得低免疫原性,从而逃逸免疫监视[9],移植时即使不应用免疫抑制剂,也未产生不良反应,使异体基因组织移植修复成为可能;⑤迁移性:骨髓间充质干细胞能够表现出迁移至损伤处的趋势,发挥组织修复的作用[10]。因此,骨髓间充质干细胞在实验中表现出良好的可操作性和安全性,是细胞移植治疗脊髓损伤的理想选择之一。 2.2 骨髓间充质干细胞移植治疗脊髓损伤的机制 在动物实验研究或临床治疗中,应用骨髓间充质干细胞治疗脊髓损伤,使神经元再生和神经功能恢复成为可能,这往往是多种因素通过不同机制共同作用的结果[11]。骨髓间充质干细胞移植治疗脊髓损伤的作用机制包括以下几个方面:①神经保护作用。骨髓间充质干细胞能够分泌许多神经营养因子,如脑源性神经营养因子、胶质细胞源性神经营养因子、神经生长因子和碱性成纤维细胞生长因子等[12],从而发挥神经保护作用,包括减少神经变性和凋亡,支持神经发生、轴突生长、髓鞘再生和细胞代谢等。当骨髓间充质干细胞分泌神经营养因子功能受损时,对脊髓损伤后的神经保护作用降低[13]。②免疫调节:骨髓间充质干细胞独特的低免疫原性特性有助于轻松逃避免疫监视[14]。骨髓间充质干细胞移植后7 d时,通过提高抗炎因子水平和降低促炎因子水平来改变脊髓损伤后的免疫反应[15]。③促进轴突再生:脊髓损伤后导致运动功能障碍的主要原因是中枢神经系统功能连接中断,脊髓受损部位中央形成囊性空腔,周围被瘢痕组织包绕,骨髓间充质干细胞移植后有利于神经再生轴突的延伸和突触之间的连接,促进脊髓损伤后功能的恢复[16-17]。④抑制胶质瘢痕形成:脊髓损伤常伴有星形胶质细胞功能失调(如释放抑制神经再生的物质),胶质细胞形成的瘢痕还会成为神经元轴突生长的物理屏障。研究表明,骨髓间充质干细胞可通过减少脊髓损伤区域反应性星形胶质细胞的数量,有利于损伤后运动功能的改善[18-19]。⑤促进髓鞘再生:在啮齿类动物、非人灵长类动物和人类脊髓损伤后的数周内,少突胶质细胞发生凋亡,脊髓发生脱髓鞘进而影响神经传导[20]。将骨髓间充质干细胞移植到小鼠脊髓损伤模型后,能够产生少突胶质细胞,但不能形成致密的髓鞘,不能促进功能的改善,这意味着骨髓间充质干细胞移植必须产生致密的髓鞘来促进功能的改善[21]。⑥骨髓间充质干细胞增殖分化修复损伤组织:骨髓间充质干细胞具有良好的可塑性,在适宜的条件下能够诱导为成软骨细胞、成骨细胞、脂肪细胞、神经细胞等。见图1。"

BORKOWSKA等[22]认为骨髓间充质干细胞可以向神经元样细胞进行分化,且在不同药物的作用下能够提高骨髓间充质干细胞向神经元样细胞的分化程度。骨髓间充质干细胞同样能够分化为少突胶质样谱系细胞,分化后可以表达成熟少突胶质细胞的标志物髓鞘碱性蛋白,但在形态学和功能上,与真正的少突胶质细胞相比还不够成熟。严珺等[23]通过实验研究证明,适宜浓度的锌有利于骨髓间充质干细胞增殖和分化,但过高的锌浓度反而会降低增殖和分化能力, 同时对骨髓间充质干细胞向神经元细胞分化起到抑制作用。由于骨髓间充质干细胞移植治疗脊髓损伤具有多方面的机制,针对不同的靶点,联合其他治疗方法可以促进脊髓功能的恢复。 2.3 多种治疗方式联合骨髓间充质干细胞移植治疗脊髓损伤的基础实验研究 "


在脊髓损伤模型研究中发现单纯骨髓间充质干细胞移植的治疗效果并不理想,其可能的原因如下:①骨髓间充质干细胞活性不佳:研究表明单纯进行骨髓间充质干细胞移植的细胞增殖能力、迁移率均受到不同程度影响;②损伤局部微环境对骨髓间充质干细胞的抑制作用:YANG等[24]将白花丹素联合骨髓间充质干细胞移植到大鼠脊髓损伤区域,发现大鼠的运动功能显著改善,其机制可能为白花丹素具有强大的抗炎和抗氧化作用,从而改善局部微环境,有利于骨髓间充质干细胞的存活;③骨髓间充质干细胞移植后无法早期定植在损伤局部持续发挥作用:LIU等[25]将骨髓间充质干细胞移植到多通道生物支架上,发现运动功能明显改善,植入的骨髓间充质干细胞分化为神经元样细胞和再生神经纤维,同时髓鞘蛋白表达呈阳性。因此,骨髓间充质干细胞移植与生物组织工程、药物、神经营养因子、相关细胞、康复疗法等多种方法联合治疗的方案逐渐成为了重要的研究方向,对脊髓损伤修复具有不同程度的积极作用。 2.3.1 生物支架材料联合骨髓间充质干细胞移植 一般来说,理想的支架材料应具备以下生物学特性:良好的生物相容性和生物降解性、材料能加工成三维结构、材料孔隙率有利于营养物质和代谢废物的循环,更重要的是支架材料应具有模仿中枢神经系统组织细胞外基质的能力,为细胞存活、生长、迁移和分化提供良好的环境[26-27]。 骨髓间充质干细胞移植治疗脊髓损伤的最大问题是细胞进入体内不能有效附着在病变区域,而是随着脑脊液的循环迁移到其他部位,这种异位迁移现象不仅显著降低了治疗效果,而且还可能对其他组织造成损害。因此,如何准确地将骨髓间充质干细胞移植到受损部位并防止其迁移到其他部位是需要解决的一个难题。生物组织工程支架是解决这一问题的最直接、最有效的方法。生物组织工程支架联合骨髓间充质干细胞移植可以明显促进脊髓损伤后的功能恢复,植入的组织工程支架可以起到桥接损伤缺损、阻止胶质瘢痕形成并为损伤处到远端组织的轴突再生提供接触性引导的作用,而且还充当传递干细胞和生物分子的载体,以有利地改变损伤部位的微环境。在脊髓损伤研究中最常用的3类生物组织工程支架材料为:①胶原蛋白支架:胶原蛋白是人体结构蛋白的主要组成部分,具有低抗原型、低免疫原性和可降解特性,广泛应用于干细胞移植载体研究。在3D胶原蛋白支架中培养的骨髓间充质干细胞能够显著增强神经营养因子的分泌和减少体外脂多糖的活化,在治疗8周后,轴突再生显著增强,并促进运动功能的恢复[28]。②水凝胶:水凝胶有利于骨髓间充质干细胞的植入,半流体的形态使细胞充分填充受损脊髓,减少脊髓空洞的形成,利于骨髓间充质干细胞的增殖分化并持续分泌神经营养因子。LI等[29]通过将载有骨髓间充质干细胞的水凝胶支架植入到脊髓受损部位,水凝胶为细胞黏附提供了有利条件,促进了细胞的增殖,治疗2周后,大鼠后肢运动功能评分显著升高,促进了神经运动功能的恢复。CARON等[30]研究表明骨髓间充质干细胞结合仿生水凝胶能够调节脊髓损伤小鼠模型的炎性反应,同时提出了三维细胞外基质沉积的能力,以增加骨髓间充质干细胞的黏附性和生存能力。LI等[19]使用骨髓间充质干细胞联合多功能凝胶可显著促进脊髓横断损伤大鼠的运动功能,并诱导骨髓间充质干细胞向神经样细胞分化,从而使中枢脊髓神经高效再生。③聚乳酸支架:聚乳酸支架具有良好的生物相容性和降解性,其组成结构有助于骨髓间充质干细胞贴壁分化和诱导神经纤维再生,对受损部位能够起到支持和桥接作用。RAYNALD等[31]应用聚乳酸纳米纤维支架联合骨髓间充质干细胞植入大鼠脊髓损伤节段,研究结果表明两者联合使用能够通过抑制瘢痕组织形成、促进轴突再生和弥合间隙病变,具有恢复电传导和促进脊髓功能恢复的巨大潜力。因而,生物组织工程支架能够为骨髓间充质干细胞的黏附和定植提供条件,同时这些支架也可以装载生物活性因子或药物,以促进骨髓间充质干细胞的增殖和分化,为修复脊髓损伤提供了有效的治疗方法。 2.3.2 基因修饰骨髓间充质干细胞移植 基因工程是在体外将外源基因进行切割并与一定的载体连接,构成重组DNA分子并导入相应受体细胞,使外源基因在受体细胞中进行复制、表达。目前可用作基因治疗的基因载体包括:①重组腺病毒载体:腺病毒载体具有良好的安全性,能够有效插入大片段的外源基因及促进外源基因高水平表达等优点,在转染骨髓间充质干细胞的实验中研究应用最多。HA等[32]在脊髓损伤大鼠肌肉内注射HIF-1腺病毒感染的骨髓间充质干细胞,能修复脊髓组织内受损神经元。HAN等[33]将重组腺病毒联合骨髓间充质干细胞植入到大鼠脊髓损伤节段,能够检测到绿色荧光蛋白标记的骨髓间充质干细胞数量明显增多,且能够显著改善脊髓损伤大鼠的运动功能。②慢病毒载体:目前应用的慢病毒载体多是经改造的HIV-1慢病毒载体,能有效地感染并整合到分裂和非分裂期细胞基因组中,并且能够介导基因转移并有效、持久地在骨髓间充质干细胞中表达。VIDAL等[34]用慢病毒介导miR-124基因修饰的骨髓间充质干细胞移植治疗大鼠脊髓损伤,通过激活miR-124下游信号通路,促进骨髓间充质干细胞向神经细胞分化,有利于脊髓组织的修复。WANG等[35]应用慢病毒介导miR-200a基因修饰的骨髓间充质干细胞移植到脊髓损伤大鼠体内中,发现过表达miR-200a的骨髓间充质干细胞能够显著促进大鼠运动功能恢复,同时降低丙二醛水平,其机制可能与调节抗氧化信号通路有关。骨髓间充质干细胞经基因修饰后,其分泌的蛋白质增多,有利于脊髓损伤的修复,促进神经元的存活和再生。 2.3.3 药物联合骨髓间充质干细胞移植 脊髓损伤后大量炎症因子和抑制轴突再生因子的释放、神经胶质瘢痕的形成以及免疫细胞的过度活化是阻碍神经再生修复的主要障碍。对于无脊髓组织缺损的脊髓损伤,在脊髓损伤早期使用相关药物抑制有害因子的释放,维护脊髓组织正常形态,建立一个有利于骨髓间充质干细胞增殖和分化的微环境,能够发挥出最大的治疗效果。 (1)化学药物:使用新型药物抑制脊髓损伤局部的炎性反应、氧化应激、缺血再灌注损伤等,然后再进行骨髓间充质干细胞移植,有助于提高脊髓损伤的治疗效果。OKUDA等[36]实验证实,抗坏血酸诱导的骨髓间充质干细胞移植对大鼠脊髓损伤模型具有良好效果,并且无需支架即可进行自体移植,胶质纤维酸性蛋白阳性神经胶质瘢痕的面积明显减少。ZHANG等[37]实验证实,丹参酮ⅡA可能通过促进神经元特异性核蛋白和神经丝蛋白200的表达,促进骨髓间充质干细胞向神经元样细胞分化而增强脊髓损伤的治疗作用。TORRES-ESPíN等[38]实验结果表明粒细胞集落刺激因子联合骨髓间充质干细胞移植可以促进细胞迁移到损伤组织,更加高效地发挥脊髓组织修复作用。杨新明等[39]应用丙戊酸钠联合骨髓间充质干细胞移植有助于大鼠脊髓损伤修复,尤其能够抑制脊髓空洞形成,降低Caspase-3的表达水平,抑制神经元凋亡,二者促进大鼠脊髓神经功能恢复具有协同或叠加作用。兰静等[40]实验表明肉苁蓉联合骨髓间充质干细胞移植能够显著改善脊髓损伤大鼠的神经运动功能和神经电生理,且能够有效提高骨髓间充质干细胞在宿主内的存活率。HU等[41]研究了法舒地尔注射液对骨髓间充质干细胞向神经元样细胞分化的影响,用10 μg/L碱性成纤维细胞生长因子预诱导骨髓间充质干细胞24 h,然后应用法舒地尔进行诱导,结果显示法舒地尔能够诱导骨髓间充质干细胞向神经元样细胞进行分化。 (2)中药及其中药提取物:许多中药及其提取物在抑制脊髓继发性损伤中发挥作用。YANG等[42]发现补阳还五汤药物联合骨髓间充质干细胞移植对大鼠脊髓损伤后红核神经元的神经保护具有协同作用,机制可能与上调cAMP水平、激活cAMP/CREB/RhoA信号通路和促进神经生长因子表达有关。詹吉恒等[43]实验研究表明虎杖苷能够促进骨髓间充质干细胞向神经元样细胞分化,有助于轴突修复,显著促进脊髓损伤小鼠后肢运动功能恢复。这些研究结果表明,骨髓间充质干细胞联合相关药物治疗脊髓损伤,能够获得更好的疗效,为骨髓间充质干细胞移植治疗脊髓损伤开辟了新的途径。 (3)生物制剂:神经营养因子在神经细胞的生长、发育和分化中发挥重要作用,主要包括神经生长因子、脑源性神经营养因子、肝细胞生长因子和神经调节蛋白1以及神经营养因子5等,均能够促进神经细胞和轴突的生成。GRANSEE等[44]应用脑源性神经营养因子联合骨髓间充质干细胞移植治疗大鼠脊髓损伤,可增强单侧脊髓半切断后的功能恢复,二者联合在调节神经可塑性和促进脊髓损伤恢复具有重要意义。YI等[45]实验结果显示神经调节蛋白1能够促进骨髓间充质干细胞的迁移,从而有助于脊髓损伤的功能恢复。LV等[46]建立大鼠脊髓损伤模型,然后分别进行单纯骨髓间充质干细胞移植以及肝细胞生长因子联合骨髓间充质干细胞移植,结果显示联合组通过抑制BMP/Smad信号通路以及减少脊髓继发性损伤,显著促进了神经运动功能恢复。文远超等[47]实验证实骨髓间充质干细胞移植联合硫酸软骨素酶ABC对大鼠脊髓损伤神经修复具有促进作用,脊髓损伤后各时间点BBB运动功能评分、苏木精-伊红组织染色结果均显著优于单纯骨髓间充质干细胞移植组,其机制可能与抑制胶质纤维酸性蛋白、生长相关蛋白43表达及增加脑源性神经营养因子表达水平有关。虽然骨髓间充质干细胞自身具有分泌许多神经营养因子的功能,移植后受到存在大量有害因子微环境的影响,分泌功能受损,及时补充神经营养因子能够促进脊髓神经运动功能的恢复,有利于骨髓间充质干细胞移植发挥更好的疗效。 2.3.4 其他细胞联合骨髓间充质干细胞移植 嗅鞘细胞是周围神经系统和中枢神经系统中都存在的一种神经胶质细胞,它们在嗅球中建立突触连接,通过将嗅神经纤维束包裹在鼻黏膜和嗅球之间来确保嗅觉的准确传递,同时它们通过分泌多种细胞因子来滋养神经纤维并促进突触形成。 TORRES-ESPíN等[48]发现在2 mm T9/T10完全横断大鼠脊髓损伤模型中将嗅鞘细胞植入聚乳酸-羟基乙酸支架联合骨髓间充质干细胞移植提高了大鼠的运动功能,这与保护轴突生长和星形胶质细胞减少有关,反映其潜在的神经保护机制。WU等[49]将骨髓间充质干细胞联合嗅鞘细胞移植到脊髓损伤大鼠体内,其后肢神经功能恢复等方面明显优于单纯骨髓间充质干细胞移植组,同时联合组神经元凋亡率显著低于单纯骨髓间充质干细胞移植组。许旺细胞是周围神经系统的神经胶质细胞,在许旺细胞存在的情况下,受损的神经纤维和细胞可以再生形成新的轴突。大量研究发现,许旺细胞具有神经保护作用,并促进轴突和髓鞘的形成,从而在脊髓运动功能恢复中发挥重要作用。XIAO等[50]使用许旺细胞联合骨髓间充质干细胞移植治疗大鼠脊髓损伤,结果显示,联合移植组的皮质脊髓束再生轴突更多,具有相对完整的髓鞘和细胞器,可促进大鼠后肢功能恢复,抑制神经胶质瘢痕的形成,并使髓鞘再生。 2.3.5 康复疗法联合骨髓间充质干细胞移植 康复疗法是综合利用传统中医针灸、运动和物理等方法促进脊髓神经运动功能恢复的治疗方法,并且无药物治疗的不良反应,同时治疗费用相对较低,目前已有一些实验研究进行报道。杨新利等[51]实验研究证实,电针联合骨髓间充质干细胞移植能够抑制大鼠脊髓损伤后炎性因子表达水平,增强神经营养因子、神经生长因子表达水平,促进大鼠运动功能的恢复。李云等[52]应用步行训练联合骨髓间充质干细胞移植有利于大鼠脊髓损伤后的神经功能、运动功能的恢复,其机制可能与增加神经细胞因子的表达有关。曾园山等[53]应用电针督脉经穴联合骨髓间充质干细胞移植,发现此方式能够提升全横断脊髓损伤移植区域及其邻近组织的神经营养因子3水平,促进骨髓间充质干细胞存活及其向神经元样细胞的增殖和分化,抑制硫酸软骨素蛋白多糖、胶质纤维酸性蛋白等神经再生抑制因子表达水平,同时上调层粘连蛋白等神经再生促进因子表达水平,改善运动诱发电位以及肢体的运动功能。GENG等[54]研究骨髓间充质干细胞移植联合高压氧对大鼠脊髓损伤的治疗作用,结果发现联合治疗组脊髓局部的肿瘤坏死因子α、白细胞介素1β、白细胞介素6水平明显下降,显著促进脊髓损伤后大鼠后肢的功能恢复。YIN等[55]实验研究发现骨髓间充质干细胞移植与低剂量超短波辐射联合使用比单独使用任何一种方法能更有效地促进脊髓损伤后的运动功能恢复。脊髓损伤治疗是一个长期的过程,长期的康复训练有利于脊髓运动功能的恢复,骨髓间充质干细胞移植联合康复训练将是攻克脊髓损伤一个重要的研究方向。 2.4 骨髓间充质干细胞联合治疗在脊髓损伤中的临床应用 由于骨髓间充质干细胞移植治疗脊髓损伤涉及到一系列医学伦理问题和严格的审批制度,临床应用骨髓间充质干细胞移植治疗脊髓损伤的报道较少。当前国内外有关骨髓间充质干细胞移植治疗脊髓损伤患者的Ⅰ/Ⅱ期临床试验虽已开展,但由于参与骨髓间充质干细胞移植的患者数量较少、随访时间较短等原因,缺乏相关可靠的数据[56]。目前临床试验提示,单纯骨髓间充质干细胞移植在脊髓损伤患者中的治疗效果并不理想,联合使用其他治疗方法控制继发性损伤,能提高单一骨髓间充质干细胞移植的疗效[57]。因此,骨髓间充质干细胞移植联合其他细胞因子、组织工程支架等多种方法,逐渐成为了新的研究方向。 MENDON?A等[58]采用自体骨髓间充质干细胞移植治疗完全性脊髓损伤患者11例,其中5例患者神经运动功能显著恢复,根据美国脊柱损伤协会评分可达2级及以上,同时采用传统药物治疗22例脊髓损伤患者为对照组,仅有5例有相应程度恢复,但两者差异无显著性意义,他们认为单纯骨髓间充质干细胞移植治疗脊髓损伤的有效性还不能妄下定论。SATTI等[59]通过对9例脊髓损伤患者鞘内注射自体骨髓间充质干细胞来证实其有效性和安全性,根据受伤时间将脊髓损伤患者分为2组:慢性组(>6个月)和亚急性脊髓损伤组(< 6个月),通过密度梯度离心获得自体骨髓间充质干细胞,通过鞘内注射将骨髓间充质干细胞回输到患者体内,最终这项研究初步表明骨髓间充质干细胞移植用于脊髓损伤患者是安全、有效的,并且能够促进神经运动功能和体表感觉的改善。AMR 等[60]将壳聚糖-层粘连蛋白支架复合腓肠神经及骨髓间充质干细胞联合植入到14例慢性截瘫患者的受损脊髓节段中,经过治疗后患者的感觉和运动功能均有不同程度的恢复,其中12例患者的AISA评分由A级提高为C级,2例由A级提高到B级,表明骨髓间充质干细胞联合组织工程支架具有良好的治疗效果。虽然骨髓间充质干细胞移植治疗脊髓损伤的临床研究较少,但显示出来良好的治疗前景。 当前,骨髓间充质干细胞移植联合其他治疗方式促进脊髓神经功能恢复所获得的研究成果多限于动物模型,其作用机制尚不确切,最佳的移植途径以及获得明确治疗效果所需要的细胞数量等问题有待于进一步研究,在临床上采用骨髓间充质干细胞移植联合其他治疗方式治疗脊髓损伤仍处于起步阶段。"

| [1] MA YH, ZENG X, QIU XC, et al. Perineurium-like sheath derived from long-term surviving mesenchymal stem cells confers nerve protection to the injured spinal cord. Biomaterials. 2018;160:37-55. [2] JI W, JIANG W, LI M, et al. miR-21 deficiency contributes to the impaired protective effects of obese rat mesenchymal stem cell-derived exosomes against spinal cord injury. Biochimie. 2019;167:171-178. [3] RUZICKA J, URDZIKOVA LM, KLOUDOVA A, et al. Anti-inflammatory compound curcumin and mesenchymal stem cells in the treatment of spinal cord injury in rats. Acta Neurobiol Exp (Wars). 2018;78(4):358-374. [4] FRIEDENSTEIN AJ, CHAILAKHYAN RK, GERASIMOV UV. Bone marrow osteogenic stem cells: in vitro cultivation and transplantation in diffusion chambers. Cell Tissue Kinet. 1987;20(3):263-272. [5] ASSINCK P, DUNCAN GJ, HILTON BJ, et al. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 2017;20(5):637-647. [6] TAKAHASHI A, NAKAJIMA H, UCHIDA K,et al. Comparison of Mesenchymal Stromal Cells Isolated from Murine Adipose Tissue and Bone Marrow in the Treatment of Spinal Cord Injury. Cell Transplant. 2018;27(7):1126-1139. [7] 万然,史旭,刘京松,等.间充质干细胞分泌组治疗脊髓损伤的研究进展[J].中国组织工程研究,2021,25(7):1088-1095. [8] ZHOU T, ZHENG Y, SUN L, et al. Microvascular endothelial cells engulf myelin debris and promote macrophage recruitment and fibrosis after neural injury. Nat Neurosci. 2019;22(3):421-435. [9] LIU W, WANG Y, GONG F, et al. Exosomes Derived from Bone Mesenchymal Stem Cells Repair Traumatic Spinal Cord Injury by Suppressing the Activation of A1 Neurotoxic Reactive Astrocytes. J Neurotrauma. 2019;36(3):469-484. [10] YU T, ZHAO C, HOU S, et al. Exosomes secreted from miRNA-29b-modified mesenchymal stem cells repaired spinal cord injury in rats. Braz J Med Biol Res. 2019;52(12):e8735. [11] CIZKOVA D, MURGOCI AN, CUBINKOVA V, et al. Spinal Cord Injury: Animal Models, Imaging Tools and the Treatment Strategies. Neurochem Res. 2020; 45(1):134-143. [12] AN H, LI Q, WEN J. Bone marrow mesenchymal stem cells encapsulated thermal-responsive hydrogel network bridges combined photo-plasmonic nanoparticulate system for the treatment of urinary bladder dysfunction after spinal cord injury. J Photochem Photobiol B. 2020;203:111741. [13] RITFELD GJ, PATEL A, CHOU A, et al. The role of brain-derived neurotrophic factor in bone marrow stromal cell-mediated spinal cord repair. Cell Transplant. 2015;24(11):2209-2220. [14] ZHANG T, LIU C, CHI L. Suppression of miR-10a-5p in bone marrow mesenchymal stem cells enhances the therapeutic effect on spinal cord injury via BDNF. Neurosci Lett. 2020;714:134562. [15] NAKAJIMA H, UCHIDA K, GUERRERO AR, et al. Transplantation of mesenchymal stem cells promotes an alternative pathway of macrophage activation and functional recovery after spinal cord injury. J Neurotrauma. 2012;29(8):1614-1625. [16] GUO S, PERETS N, BETZER O, et al. Intranasal Delivery of Mesenchymal Stem Cell Derived Exosomes Loaded with Phosphatase and Tensin Homolog siRNA Repairs Complete Spinal Cord Injury. ACS Nano. 2019;13(9):10015-10028. [17] CHEN Y, LIAN XH, LIAO LY, et al. Transplantation of bone marrow mesenchymal stem cells alleviates spinal cord injury via inhibiting Notch signaling. Eur Rev Med Pharmacol Sci. 2019;23(3 Suppl):31-38. [18] KADOYA K, LU P, NGUYEN K, et al. Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat Med. 2016; 22(5):479-487. [19] LI L, XIAO B, MU J, et al. A MnO2 Nanoparticle-Dotted Hydrogel Promotes Spinal Cord Repair via Regulating Reactive Oxygen Species Microenvironment and Synergizing with Mesenchymal Stem Cells. ACS Nano. 2019;13(12):14283-14293. [20] JÄKEL S, AGIRRE E, MENDANHA FALCÃO A, et al. Altered human oligodendrocyte heterogeneity in multiple sclerosis. Nature. 2019;566(7745): 543-547. [21] HAWRYLUK GW, SPANO S, CHEW D, et al. An examination of the mechanisms by which neural precursors augment recovery following spinal cord injury: a key role for remyelination. Cell Transplant. 2014;23(3):365-380. [22] BORKOWSKA P, KOWALSKA J, FILA-DANILOW A, et al. Affect of antidepressants on the in vitro differentiation of rat bone marrow mesenchymal stem cells into neuronal cells. Eur J Pharm Sci. 2015;73:81-87. [23] 严珺,王永杰,孟春阳,等.锌对大鼠骨髓间充质干细胞增殖与向神经样细胞分化的影响[J].中国实验诊断学,2016,20(7):1045-1048. [24] YANG W, YANG Y, YANG JY, et al. Treatment with bone marrow mesenchymal stem cells combined with plumbagin alleviates spinal cord injury by affecting oxidative stress, inflammation, apoptotis and the activation of the Nrf2 pathway. Int J Mol Med. 2016;37(4):1075-1082. [25] LIU J, CHEN J, LIU B, et al. Acellular spinal cord scaffold seeded with mesenchymal stem cells promotes long-distance axon regeneration and functional recovery in spinal cord injured rats. J Neurol Sci. 2013;325(1-2):127-136. [26] ASSUNÇÃO-SILVA RC, GOMES ED, SOUSA N, et al. Hydrogels and Cell Based Therapies in Spinal Cord Injury Regeneration. Stem Cells Int. 2015;2015:948040. [27] LI C, JIAO G, WU W, et al. Exosomes from Bone Marrow Mesenchymal Stem Cells Inhibit Neuronal Apoptosis and Promote Motor Function Recovery via the Wnt/β-catenin Signaling Pathway. Cell Transplant. 2019;28(11):1373-1383. [28] HAN S, WANG B, LI X, et al. Bone marrow-derived mesenchymal stem cells in three-dimensional culture promote neuronal regeneration by neurotrophic protection and immunomodulation. J Biomed Mater Res A. 2016;104(7):1759-1769. [29] LI LM, HAN M, JIANG XC, et al. Peptide-Tethered Hydrogel Scaffold Promotes Recovery from Spinal Cord Transection via Synergism with Mesenchymal Stem Cells. ACS Appl Mater Interfaces. 2017;9(4):3330-3342. [30] CARON I, ROSSI F, PAPA S, et al. A new three dimensional biomimetic hydrogel to deliver factors secreted by human mesenchymal stem cells in spinal cord injury. Biomaterials. 2016;75:135-147. [31] RAYNALD, SHU B, LIU XB, et al. Polypyrrole/polylactic acid nanofibrous scaffold cotransplanted with bone marrow stromal cells promotes the functional recovery of spinal cord injury in rats. CNS Neurosci Ther. 2019; 25(9):951-964. [32] HA XQ, YANG B, HOU HJ, et al. Protective effect of rhodioloside and bone marrow mesenchymal stem cells infected with HIF-1-expressing adenovirus on acute spinal cord injury. Neural Regen Res. 2020;15(4):690-696. [33] HAN X, CHEN Y, LIU Y, et al. HIF-1α promotes bone marrow stromal cell migration to the injury site and enhances functional recovery after spinal cord injury in rats. J Gene Med. 2018;20(12):e3062. [34] VIDAL PM, ULNDREAJ A, BADNER A, et al. Methylprednisolone treatment enhances early recovery following surgical decompression for degenerative cervical myelopathy without compromise to the systemic immune system. J Neuroinflammation. 2018; 15(1):222. [35] WANG X, YE L, ZHANG K, et al. Upregulation of microRNA-200a in bone marrow mesenchymal stem cells enhances the repair of spinal cord injury in rats by reducing oxidative stress and regulating Keap1/Nrf2 pathway. Artif Organs. 2020; 44(7):744-752. [36] OKUDA A, HORII-HAYASHI N, SASAGAWA T, et al. Bone marrow stromal cell sheets may promote axonal regeneration and functional recovery with suppression of glial scar formation after spinal cord transection injury in rats. J Neurosurg Spine. 2017;26(3):388-395. [37] ZHANG XM, MA J, SUN Y, et al. Tanshinone IIA promotes the differentiation of bone marrow mesenchymal stem cells into neuronal-like cells in a spinal cord injury model. J Transl Med. 2018;16(1):193. [38] TORRES-ESPÍN A, REDONDO-CASTRO E, HERNANDEZ J, et al. Immunosuppression of allogenic mesenchymal stem cells transplantation after spinal cord injury improves graft survival and beneficial outcomes. J Neurotrauma. 2015;32(6):367-380. [39] 杨新明,杜雅坤,石蔚,等.丙戊酸联合骨髓间充质干细胞修复大鼠急性脊髓损伤可行性及其机制研究[J].中华解剖与临床杂志,2017,22(5): 407-415. [40] 兰静,闫金玉,夏润福,等.口服肉苁蓉联合骨髓间充质干细胞移植治疗大鼠脊髓损伤[J].中国组织工程研究,2014,18(41):6639-6644. [41] HU Y, LI X, HUANG G, et al. Fasudil may induce the differentiation of bone marrow mesenchymal stem cells into neuron‑like cells via the Wnt/β‑catenin pathway. Mol Med Rep. 2019;19(4):3095-3104. [42] YANG P, CHEN A, QIN Y, et al. Buyang huanwu decoction combined with BMSCs transplantation promotes recovery after spinal cord injury by rescuing axotomized red nucleus neurons. J Ethnopharmacol. 2019;228:123-131. [43] 詹吉恒,栾继耀,罗丹,等.虎杖苷促进骨髓间充质干细胞向神经元样细胞分化治疗脊髓损伤机制[J].中华中医药杂志,2020,35(5):2628-2633. [44] GRANSEE HM, ZHAN WZ, SIECK GC, et al. Localized delivery of brain-derived neurotrophic factor-expressing mesenchymal stem cells enhances functional recovery following cervical spinal cord injury. J Neurotrauma. 2015;32(3):185-193. [45] YI XM, CHEN Y, TU GJ. Neuregulin‑1 impacting bone marrow mesenchymal stem cell migration is conducive to functional recovery following spinal cord injury. Mol Med Rep. 2019;20(1):41-48. [46] LV C, ZHANG T, LI K, et al. Bone marrow mesenchymal stem cells improve spinal function of spinal cord injury in rats via TGF-β/Smads signaling pathway. Exp Ther Med. 2020;19(6):3657-3663. [47] 文远超,余云湖,王波,等.骨髓间充质干细胞与硫酸软骨素酶ABC联合移植对大鼠脊髓损伤的修复作用及其机制[J].山东医药,2018,58(11):13-17. [48] TORRES-ESPÍN A, REDONDO-CASTRO E, HERNÁNDEZ J, et al. Bone marrow mesenchymal stromal cells and olfactory ensheathing cells transplantation after spinal cord injury--a morphological and functional comparison in rats. Eur J Neurosci. 2014;39(10):1704-1717. [49] WU S, CUI G, SHAO H, et al. The Cotransplantation of Olfactory Ensheathing Cells with Bone Marrow Mesenchymal Stem Cells Exerts Antiapoptotic Effects in Adult Rats after Spinal Cord Injury. Stem Cells Int. 2015;2015:516215. [50] XIAO Z, TANG F, ZHAO Y, et al. Significant Improvement of Acute Complete Spinal Cord Injury Patients Diagnosed by a Combined Criteria Implanted with NeuroRegen Scaffolds and Mesenchymal Stem Cells. Cell Transplant. 2018;27(6):907-915. [51] 杨新利,栾春红,汪永华.电针联合BMSCs移植对脊髓损伤大鼠模型炎症反应和损伤组织神经营养因子表达水平的影响[J].四川中医,2018, 36(11):51-55. [52] 李云,陈波,吴咏德,等.步行训练联合BMSCs移植对脊髓损伤模型大鼠神经和运动功能修复的影响[J].临床和实验医学杂志,2018,17(24): 2587-2591. [53] 曾园山.电针督脉经穴联合成体干细胞移植策略在修复脊髓损伤中的研究进展[J].中山大学学报(医学科学版),2017,38(6): 801-807,847. [54] GENG CK, CAO HH, YING X, et al. Effect of mesenchymal stem cells transplantation combining with hyperbaric oxygen therapy on rehabilitation of rat spinal cord injury. Asian Pac J Trop Med. 2015;8(6):468-473. [55] YIN YM, LU Y, ZHANG LX, et al. Bone marrow stromal cells transplantation combined with ultrashortwave therapy promotes functional recovery on spinal cord injury in rats. Synapse. 2015;69(3):139-147. [56] COFANO F, BOIDO M, MONTICELLI M, et al. Mesenchymal Stem Cells for Spinal Cord Injury: Current Options, Limitations, and Future of Cell Therapy. Int J Mol Sci. 2019;20(11):2698. [57] SHAO A, TU S, LU J, et al. Crosstalk between stem cell and spinal cord injury: pathophysiology and treatment strategies. Stem Cell Res Ther. 2019;10(1):238. [58] MENDONÇA MV, LAROCCA TF, DE FREITAS SOUZA BS, et al. Safety and neurological assessments after autologous transplantation of bone marrow mesenchymal stem cells in subjects with chronic spinal cord injury. Stem Cell Res Ther. 2014;5(6):126. [59] SATTI HS, WAHEED A, AHMED P, et al. Autologous mesenchymal stromal cell transplantation for spinal cord injury: A Phase I pilot study. Cytotherapy. 2016;18(4): 518-522. [60] AMR SM, GOUDA A, KOPTAN WT, et al. Bridging defects in chronic spinal cord injury using peripheral nerve grafts combined with a chitosan-laminin scaffold and enhancing regeneration through them by co-transplantation with bone-marrow-derived mesenchymal stem cells: case series of 14 patients. J Spinal Cord Med. 2014;37(1):54-71. [61] HU XC, LU YB, YANG YN, et al. Progress in clinical trials of cell transplantation for the treatment of spinal cord injury: how many questions remain unanswered? Neural Regen Res. 2021;16(3):405-413. [62] LI X, ZHAN J, HOU Y, et al. Coenzyme Q10 Regulation of Apoptosis and Oxidative Stress in H2O2 Induced BMSC Death by Modulating the Nrf-2/NQO-1 Signaling Pathway and Its Application in a Model of Spinal Cord Injury. Oxid Med Cell Longev. 2019;2019:6493081. [63] 方楚玲,田京. BMSCs成软骨分化的影响因素[J].中国临床解剖学杂志, 2014, 32(3):371-374. [64] 钱晖,王兴忠,徐静,等.骨髓间质干细胞体内致瘤研究[C].杭州:第一届国际肿瘤干细胞学术会议论文集,2007:73. [65] TSUMURAYA T, OHTAKI H, SONG D, et al. Human mesenchymal stem/stromal cells suppress spinal inflammation in mice with contribution of pituitary adenylate cyclase-activating polypeptide (PACAP). J Neuroinflammation. 2015;12:35. [66] FARZANEH M, ANBIYAIEE A, KHOSHNAM SE. Human Pluripotent Stem Cells for Spinal Cord Injury. Curr Stem Cell Res Ther. 2020;15(2):135-143. |
| [1] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [2] | Jin Tao, Liu Lin, Zhu Xiaoyan, Shi Yucong, Niu Jianxiong, Zhang Tongtong, Wu Shujin, Yang Qingshan. Osteoarthritis and mitochondrial abnormalities [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1452-1458. |
| [3] | Zhang Lichuang, Xu Hao, Ma Yinghui, Xiong Mengting, Han Haihui, Bao Jiamin, Zhai Weitao, Liang Qianqian. Mechanism and prospects of regulating lymphatic reflux function in the treatment of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1459-1466. |
| [4] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1260-1265. |
| [5] | Xiao Hao, Liu Jing, Zhou Jun. Research progress of pulsed electromagnetic field in the treatment of postmenopausal osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1266-1271. |
| [6] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1272-1277. |
| [7] | Kan Houming, Fan Lijun, Chen Xuetai, Shen Wen. Application of platelet-rich plasma in neuropathic pain [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1286-1292. |
| [8] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1102-1106. |
| [9] | Zhou Hongqin, Wu Dandan, Yang Kun, Liu Qi. Exosomes that deliver specific miRNAs can regulate osteogenesis and promote angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1107-1112. |
| [10] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [11] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1119-1124. |
| [12] | Hui Xiaoshan, Bai Jing, Zhou Siyuan, Wang Jie, Zhang Jinsheng, He Qingyong, Meng Peipei. Theoretical mechanism of traditional Chinese medicine theory on stem cell induced differentiation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1125-1129. |
| [13] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [14] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1137-1142. |
| [15] | Hu Wei, Xie Xingqi, Tu Guanjun. Exosomes derived from bone marrow mesenchymal stem cells improve the integrity of the blood-spinal cord barrier after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 992-998. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||