Chinese Journal of Tissue Engineering Research ›› 2021, Vol. 25 ›› Issue (29): 4685-4690.doi: 10.12307/2021.169
Previous Articles Next Articles
Endoplasmic reticulum stress regulates autophagy and apoptosis in steroid-induced avascular necrosis of the femoral head
Zhao Qianzeng1, Zhao Zhenqun2, Liu Wanlin2
- 1Graduate School of Inner Mongolia Medical University, Hohhot 010000, Inner Mongolia Autonomous Region, China; 2The Second Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010030, Inner Mongolia Autonomous Region, China
-
Received:2020-11-05Revised:2020-11-06Accepted:2020-12-31Online:2021-10-18Published:2021-07-22 -
Contact:Liu Wanlin, Master, Chief physician, Doctoral/Master’s supervisor, The Second Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010030, Inner Mongolia Autonomous Region, China Zhao Zhenqun, MD, Chief physician, Master’s supervisor, The Second Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010030, Inner Mongolia Autonomous Region, China -
About author:Zhao Qianzeng, Master candidate, Graduate School of Inner Mongolia Medical University, Hohhot 010000, Inner Mongolia Autonomous Region, China -
Supported by:the National Natural Science Foundation of China, No. 81960397 (to LWL) and 81760391 (to ZZQ); Young Scientific and Technological Talents Support Program in Colleges and Universities of Inner Mongolia Autonomous Region, No. NJYT-20-B04 (to ZZQ)
CLC Number:
Cite this article
Zhao Qianzeng, Zhao Zhenqun, Liu Wanlin. Endoplasmic reticulum stress regulates autophagy and apoptosis in steroid-induced avascular necrosis of the femoral head[J]. Chinese Journal of Tissue Engineering Research, 2021, 25(29): 4685-4690.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
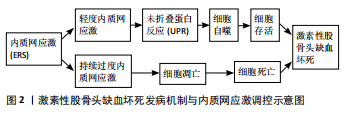
2.1 细胞自噬与凋亡通路研究现状 1957年,CLARK[16]在新生小鼠肾脏中观察到一种脂质包涵体结构,后续的研究表明这是一个具有重要生理和病理意义的基本细胞过程即自噬。日本细胞分子生物学家大隅良典(Yoshinori Ohsumi)因对细胞自噬机制方面的研究荣获2016年度诺贝尔生理学或医学奖[17]。自噬即是当细胞内发生营养饥饿等应激刺激时,为了维持细胞稳态,细胞中的溶酶体途径被激活,并由此清除异常的蛋白质与受损的细胞器[18]。 自噬的主要特征是形成双层囊泡状结构的自噬小体,它包裹部分错误折叠的蛋白与受损的细胞器,运送至溶酶体进行回收降解[19]。根据自噬过程中底物类型、转运机制的不同可将自噬分为巨自噬(Macroautophagy)、微自噬(Microautophagy)和分子伴侣介导的自噬(Chaperone-mediated autophagy)3种[20]。由于巨自噬的机制更具特征性且更为常见,因此在此文中将其称为自噬[21]。 细胞自噬现象广泛存在正常人体组织中。研究发现,自噬参与多种应激反应,如病毒感染、炎症反应等,也见于呼吸系统疾病、血液系统疾病、免疫系统疾病以及肿瘤疾病等病理机制中[22]。随着对细胞自噬调控机制研究的深入,相继发现存在PI3K/Akt/mTORC1(磷脂酰肌醇3激酶/蛋白激酶B /雷帕霉素敏感复合物)、Beclin-1(酵母ATG6同源物)、P53(人体抑癌基因)、MAP1LC3(微管相关蛋白1轻链3)等自噬相关信号通路[21],但其具体调控机制尚未完全明确。 细胞凋亡是哺乳动物真核细胞内的另一种程序性细胞死亡过程,与细胞坏死不同的是,细胞凋亡是在应激刺激条件下,细胞为了更好地适应生存环境而启动的一个在基因调控下的细胞主动性死亡模式。细胞凋亡的现象最早于1965年由澳大利亚学者发现,并且在1972年由Kerr等[23]人将该现象正式命名为细胞凋亡。 细胞凋亡的启动过程依赖于两类半胱氨酸-天冬氨酸蛋白酶(Caspases)的激活,一旦检测到细胞损伤,起始Caspases(如Caspases 2,8,9和10)从未激活的原天冬氨酸蛋白酶(Procaspases)中被激活,并继续激活效应Caspases(如Caspases 3,6和7),效应Caspases的激活启动了一系列后续反应,包括内切酶的激活、核蛋白和细胞骨架的破坏、蛋白质的交联、吞噬细胞配体的表达和凋亡小体的形成[24]。 细胞凋亡的机制较为复杂,按照起始Caspase的不同,可将细胞凋亡分为:由细胞表面的死亡受体(如:Fas)和肿瘤坏死因子受体家族介导的外源性信号通路;由细胞线粒体途径介导的内源性途径;由内质网应激所导致的caspase-12的活化,进而导致凋亡的内质网应激途径;以及非Caspase依赖的穿孔素/颗粒酶凋亡信号通路[25-27] 。 2.2 内质网应激对细胞自噬及凋亡的调控 内质网是真核细胞中最大的膜结构细胞器,承担细胞内至少1/3蛋白质的合成、折叠和运输,同时还参与调节蛋白质稳态,对所有进入细胞器和细胞外的蛋白质进行监测,还参与葡萄糖、脂类和胆固醇代谢等过程。当细胞内出现蛋白质合成水平增加、泛素化和蛋白酶体降解受损、营养过剩或不足、Ca2+水平失调及缺氧等应激刺激时,错误折叠或未折叠的蛋白质在内质网管腔内积聚,会触发细胞内的保护性机制即内质网应激,与此同时,细胞为减轻内质网应激会激活UPR[28]。UPR激活后可通过降低相关蛋白质合成速率,增加内质网中蛋白质折叠和运输,并促进内质网相关蛋白降解和激活自噬来缓解内质网应激[29],以恢复内质网稳态,促进细胞存活;当内质网应激刺激过强且持续存在时,会过度诱导自噬或激活凋亡途径使细胞死亡。 在哺乳动物真核细胞中已经发现了3条UPR信号通路:分别为蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)-真核翻译起始因子2α(eIF2α)、肌醇需要蛋白1α(IRE1α)-X盒结合蛋白1(XBP1)、激活转录因子(ATF)6α[30]。在生理条件下,这些跨膜蛋白与内质网管腔内的分子伴侣葡萄糖调节蛋白(GRP78/Bip)结合。当未折叠的蛋白质在内质网中积累时,GRP78/Bip从这些复合体中释放出来,参与积累的蛋白质折叠过程,后来PERK、IRE1α和ATF6激活了各自的转导系统[31]。 2.2.1 内质网应激调控细胞自噬的机制 内质网应激与自噬关系密切,在多个调控机制上存在交集。最新研究表明,内质网应激调控自噬的机制主要有通过PERK/eIF2α途径、通过IRE1-TRAF2-JNK途径以及调控细胞内Ca2+浓度介导内质网应激和自噬的相互作用[32]。 当内质网应激发生时,内质网应激感受蛋白(PERK)可以通过自身磷酸化形成寡聚体,促进其下游真核细胞翻译起始因子2α(eIF2α)的磷酸化,通过抑制相关蛋白质合成来延缓内质网应激的进展,从而使细胞存活[33]。 未折叠蛋白在内质网中的积聚可以促进IRE1酶寡聚化和胞质结构域的自身磷酸化,此时的IRE1可以与肿瘤坏死因子受体相关因子2(TRAF-2)结合形成复合物,使凋亡信号调节激酶1(apoptosis signal regulating kinase-1,ASK1) 磷酸化,磷酸化的ASK1进一步磷酸化c-jun氨基末端激酶(JNK),从而促进Bcl-2的激活,最终导致细胞自噬。也就是说,内质网应激可以通过IRE1-TRAF2-JNK途径介导激活细胞自 噬[34]。 内质网应激既可通过UPR直接激活细胞自噬,也可通过促进Ca2+由内质网释放入细胞质,进而诱导细胞自噬。内质网中含有大量的Ca2+ ,应激条件下,细胞内稳态受到影响,三磷酸肌醇(IP3)是三磷酸肌醇受体(IP3R)的内源性配体,三磷酸肌醇可以促进Ca2+由内质网大量释放到胞浆中,从而激活钙调素依赖的激酶β(CaMKK-β)与AMP激活的蛋白激酶,激活的AMP激活的蛋白激酶可以解除哺乳动物雷帕霉素靶蛋白对ULK1复合物的抑制,由于ULK1复合物再自噬的起始过程中有着重要的诱导作用,因此激活了细胞自噬[35]。 DEEGAN等[36]通过对经布雷菲尔丁A[Brefeldin A,简称BFA,是一种常用的蛋白转运抑制剂,特异性且可逆地阻断蛋白质从内质网转运到高尔基体(Golgi)]或衣霉素(Tunicamycin,是一种同源核苷抗生素的混合物,可引起细胞内质网中未折叠蛋白的积累并诱导内质网应激,并导致 DNA 合成受阻和 G1 期细胞周期停滞)处理的HCT116细胞(人结肠癌细胞)进行了微阵列分析,发现在HCT119细胞发生内质网应激过程中,IRE1和PERK通路作为自噬-凋亡的串扰通路发挥重要作用。一方面,通过该通路可以激活多种自噬受体基因的转录,如SQSTM1/p62、NBR1和BNIP3L/Nix等,且IRE1和PERK通路受到抑制后会明显的阻断自噬受体基因的上调;另一方面,自噬受体基因的上调表明,内质网应激所诱导的是一种选择性自噬。 2.2.2 内质网应激调控细胞凋亡的机制 当轻度内质网应激时,内质网通过激活 UPR可启动自噬,以恢复内质网稳态,促使细胞存活;当内质网应激严重程度或持续存在时,细胞无法通过UPR恢复内质网稳态,就会导致凋亡信号通路的激活。内质网应激调控细胞凋亡存在多种机制,主要有通过激活PERK/eIF2α途径中C/EBP同源蛋白(CHOP)、IRE1α-ASK1-JNK通路、IRE1α-XBP1-CHOP通路、激活Caspase-12通路[37]。 前文已述,内质网应激可以通过PERK/eIF2α途径来激活自噬使细胞存活,然而,过量或持续的内质网应激可以跳过eIF2mRNA的磷酸化步骤,直接激活PERK下游的转录因子4(ATF4)。激活的ATF4可提高CHOP的转录和表达水平,CHOP则通过诱导BCL-2家族抗凋亡蛋白的表达下调和多种促凋亡蛋白的转录上调激活凋亡途径使细胞死亡[33,38]。郑璐等[12]通过应用二硫苏糖醇(DTT)诱导人正常肝细胞LO2发生内质网应激的研究,证实了内质网应激可以通过PERK/eIF2α/CHOP途径诱导肝细胞发生凋亡;又采用了自噬诱导剂雷帕霉素预处理LO2细胞,发现经过雷帕霉素预处理的LO2细胞可以在一定程度上减轻内质网应激诱导的细胞凋亡,证实了细胞自噬可能是细胞的一种重要的代偿保护机制,但如果应激损伤过重或持续存在,细胞自身的代偿机制不足于对抗应激损伤时,会激活细胞凋亡。 内质网应激可激活IRE1 mRNA,IRE1 mRNA会激活其下游因子ASK1和JNK,引发ASK1-JNK级联反应,导致细胞凋亡[39]。发生内质网应激时,肌醇需要蛋白1(IRE1)可以通过氨基末端结构域感知非折叠蛋白或错误折叠蛋白的蓄积,并从分子伴侣葡萄糖调节蛋白(GRP78)上解离,经过二聚化、自身磷酸化而被激活[40]。活化的IRE1通过非常规的剪接形式,切除非剪接型XBP1 (uXBP1) 上26个核苷酸使之转化成剪接型XBP1 (sXBP1)。sXBP1是XBP1的活性形式,属于转录因子家族中的一员, 它可以进入细胞核内与UPR元件相结合,激活大量目的基因表达,以恢复内质网内部稳态[41]。如果未折叠蛋白或错误折叠蛋白的情况未能被UPR有效缓解,IRE1的持续激活会导致JNK信号通路的激活,最后诱导细胞凋亡。研究发现,内质网应激在骨关节炎软骨细胞分化过程中被诱导,并激活IRE1-XBP1通路,ATF6和IRE1α可协同调节软骨内源性XBP1基因ex35的表达;在调节雌激素受体应激介导的骨关节炎软骨细胞凋亡过程中,XBP1s通过影响Caspase 3-9-12、p-JNK1和CHOP通路,对骨关节炎中的细胞凋亡起负调控作用[42]。 Caspase-12是内质网应激过程中的特异性凋亡信号通路,作为细胞凋亡的3种途径之一。研究发现,Caspase-12定位于内质网,在正常生理状态下Caspase-12与肿瘤坏死因子受体相关因子2 (TRAF2) 结合为复合物;当内质网应激持续或过度,内质网内的Ca2+动态平衡被破坏时,内质网可激活 Caspase-12,Caspase-12与TRAF2分离,并促进Caspase-12的激活,活化的Caspase-12会激发细胞凋亡Caspase-12-9-3级联反应的发生,最终导致细胞死亡[43-44]。 2.3 内质网应激条件下自噬与细胞凋亡之间的相互作用 细胞自噬、细胞凋亡与内质网应激的关系密切,在内质网应激诱导的自噬和凋亡之间有共同的上游信号通路,包括PERK/ATF4、IRE1α、ATF6和Ca2+。内质网应激条件下自噬的激活可能具有细胞保护作用,自噬可以通过抑制凋亡相关通路caspase的激活来阻断细胞的凋亡诱导,从而减轻细胞损伤,并促进细胞存活[45]。ZHENG等[46]的研究发现,在软骨细胞中,由衣霉素诱导的内质网应激可以激活自噬,而雷帕霉素诱导的自噬可以抑制软骨细胞中的内质网应激,并且自噬相关蛋白ATG5或ATG7可以通过促进细胞自噬来抑制内质网应激过程,即ATG5、ATG7和ATG5+ATG可通过PERK信号途径调节自噬、内质网应激、细胞凋亡和细胞周期。此外,凋亡相关蛋白的激活还可以通过降解自噬相关蛋白,如Beclin-1、Atg4D、Atg3和ATG5来抑制自噬[18,47]。 一般来说,适度的自噬可以清除泛素化的未折叠/错折叠蛋白,从而缓解内质网应激。然而,内质网应激持续时间和应激程度的增加导致自噬过度激活,可导致细胞自我消化甚至凋亡,进一步加重细胞损伤。综上所述,内质网应激诱导的自噬对细胞存活的影响是不同的,它具有促生存和促死亡的双重作用,这可能取决于内质网应激的程度[31]。自噬和凋亡之间的相互作用和潜在机制以及自噬的二重性机制相当复杂,需要更多的研究来证实。 2.4 SANFH的相关发病机制研究进展 尽管近年来对于程序性细胞死亡的调控机制等方面取得了一些进展,但是关于自噬与SANFH关系的研究尚处于起始阶段。李云隆[48]通过实验证实在SANFH的发生过程中PI3K/Akt/mTOR信号通路为自噬抑制性通路,可以负向调控自噬;自噬对于SANFH具有双向作用,自噬虽可以在一定程度上缓解SANFH,但其负面作用会诱导SANFH并加速其恶化。孙亮等[6]通过实验证实自噬在SANFH发病过程中发挥作用,注射3-甲基腺嘌呤 (3-MA)可以抑制自噬。 细胞自噬和细胞凋亡通常发生在同一细胞中,大多数情况下自噬可早于凋亡而发生[18]。研究表明,二者之间也存在调控关系。ZHU等[49]通过实验发现,注射用重组人甲状旁腺激素1-34(rhPTH 1-34)可以通过增强细胞自噬来减轻地塞米松诱导的MLO-Y4骨细胞的凋亡过程,揭示了自噬的自我激活可能是SANFH过程中的一种保护机制。KIM等[50]通过敲除裸鼠(naked mole-rat,NMR)皮肤成纤维细胞中的ATG5(Autophagy-related gene 5)基因的方式,发现在该细胞中出现的高基础自噬活性有助于抑制p53/Rb诱导的细胞凋亡,从而有利于延长裸鼠皮肤成纤维细胞寿命,证实了在该细胞中由ATG5介导的自噬参与了细胞凋亡以及细胞内稳态的调控。 对于SANFH 发病机制过程中,骨细胞凋亡的增加与内质网应激有关(图2)。在HAMAMURA等[51]的研究中,使用毒胡萝卜内酯(Thapsigargin)和衣霉素(tunicamycin)作为内质网应激的诱导剂作用于MC3T3成骨细胞,发现毒胡萝卜内酯对MC3T3细胞eIF2α-p和ATF4蛋白起到诱导促进表达作用,同时发现,与持续暴露于毒胡萝卜内酯导致细胞凋亡不同,短期暴露于毒胡萝卜内酯不仅能增强ATF4表达,还能增强RANKL和转录调控因子(如Runx2和Osterix)的mRNA水平,RANKL是通过激活破骨细胞进行骨吸收所需的关键细胞因子,表明了在MC3T3成骨细胞中存在内质网应激的双重调节机制。 在最近的研究中,LIU等[52]通过构建地塞米松诱导的Mc3T3-E1成骨样细胞模型,证实了地塞米松通过内质网应激抑制MC3T3-E1细胞活力,并促进细胞凋亡;通过不同梯度浓度地塞米松作用于MC3T3-E1细胞发现,地塞米松对自噬通量有刺激作用,可能产生活性氧增加了自噬水平;且3-甲基腺嘌呤可逆转地塞米松对Mc3T3-E1细胞活力的抑制和对细胞凋亡的促进作用。 YANG等[53]得到了相似的结论,地塞米松和氢化可的松都能通过促进细胞凋亡进而抑制MC3T3-E1细胞的增殖,内质网应激可加重地塞米松介导的MC3T3-E1细胞凋亡。4-苯基丁酸(4?Phenyl butyric acid,4-PBA)可抑制地塞米松诱导的MC3T3-E1细胞凋亡进而缓解内质网应激和线粒体功能障碍。 综上所述,在SANFH发病机制中,内质网应激参与骨细胞和成骨细胞的自噬与凋亡相关通路的调控过程,了解UPR信号通路如何发挥作用以及细胞自噬和凋亡之间如何相互调控,是对SANFH发病机制进行研究的重要一步。"
| [1] ZHAO D, ZHANG F, WANG B, et al. Guidelines for clinical diagnosis and treatment of osteonecrosis of the femoral head in adults (2019 version) .J Orthop Translat. 2020;21:100-110. [2] CHIKVATIA L, AVAZASHVILI N, OBGAIDZE G, et al. STEROID-INDUCED OSTEONECROSES OF FEMORAL HEAD. Georgian Med News. 2020; 298(1):21-27. [3] YOON BH, JONES LC, CHEN CH, et al. Etiologic Classification Criteria of ARCO on Femoral Head Osteonecrosis Part 1: Glucocorticoid-Associated Osteonecrosis. J Arthroplasty. 2019;34(1):163-168.e161. [4] 王傲,王金成.激素性股骨头坏死发病机制的研究进展[J].中国骨与关节损伤杂志,2016,31(4):445-446. [5] WANG A, REN M, WANG J. The pathogenesis of steroid-induced osteonecrosis of the femoral head: A systematic review of the literature. Gene. 2018;671:103-109. [6] 孙亮,刘万林,娜日松,等. 3-甲基腺嘌呤调控自噬基因Beclin1可降低模型兔激素性股骨头缺血坏死的发生与发展[J].中国组织工程研究,2019,23(15):2391-2396. [7] 王文选,赵振群,刘万林,等. Beclin 1和MAP1-LC3在家兔激素性股骨头缺血坏死中表达的实验研究[J]. 实用骨科杂志,2017,23(9): 811-815. [8] 赵振群,张志峰,刘万林,等. 激素性股骨头坏死过程中低氧诱导因子1α与骨细胞凋亡[J].中国组织工程研究,2015,19(51):8201-8207. [9] 赵振群,刘万林,龚瑜林,等.骨髓造血细胞DNA氧化损伤与骨细胞凋亡在早期激素性股骨头坏死中的表现[J]. 中国组织工程研究, 2015,19(11):1652-1657. [10] UDDIN MS, TEWARI D, SHARMA G, et al. Molecular Mechanisms of ER Stress and UPR in the Pathogenesis of Alzheimer’s Disease. Mol Neurobiol. 2020;57(7):2902-2919. [11] ZHU Q. The ER stress-autophagy axis: implications for cognitive dysfunction in diabetes mellitus. Clin Sci (Lond). 2020;134(11):1255-1258. [12] 郑璐,韩冰,汤雷,等.内质网应激诱导的自噬对肝细胞凋亡的影响[J].中国病理生理杂志,2019,35(2):332-339. [13] ALMANZA A, CARLESSO A, CHINTHA C, et al. Endoplasmic reticulum stress signalling - from basic mechanisms to clinical applications. FEBS J. 2019;286(2):241-278. [14] SENFT D, RONAI ZEA. UPR, autophagy, and mitochondria crosstalk underlies the ER stress response. Trends Biochem Sci. 2015;40(3):141-148. [15] MEHRBOD P, ANDE SR, ALIZADEH J, et al. The roles of apoptosis, autophagy and unfolded protein response in arbovirus, influenza virus, and HIV infections. Virulence. 2019;10(1):376-413. [16] CLARK SL JR. Cellular differentiation in the kidneys of newborn mice studies with the electron microscope. J Biophys Biochem Cytol. 1957; 3(3):349-362. [17] VAN NOORDEN R, LEDFORD H. Medicine Nobel for research on how cells ‘eat themselves’ . Nature. 2016;538(7623):18-19. [18] MUKHOPADHYAY S, PANDA PK, SINHA N, et al. Autophagy and apoptosis: where do they meet? . Apoptosis. 2014;19(4):555-566. [19] WANG T, HE H, LIU S, et al. Autophagy: A Promising Target for Age-related Osteoporosis. Curr Drug Targets. 2019;20(3):354-365. [20] CODOGNO P, MEHRPOUR M, PROIKAS-CEZANNE T. Canonical and non-canonical autophagy: variations on a common theme of self-eating?. Nat Rev Mol Cell Biol. 2011;13(1):7-12. [21] 孟晨阳,刘万林,白锐,等.激素性股骨头缺血性坏死发病机制中的细胞自噬[J].中国组织工程研究,2017,21(8):1280-1287. [22] MOOSAVI MA, DJAVAHERI-MERGNY M. Autophagy: New Insights into Mechanisms of Action and Resistance of Treatment in Acute Promyelocytic leukemia. Int J Mol Sci. 2019;20(14):3559. [23] KERR JF, WYLLIE AH, CURRIE AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer. 1972;26(4):239-257. [24] 陆洋. Caspase-3、Caspase-9在哮喘大鼠模型嗜酸性粒细胞中的表达及糖皮质激素的影响[D].沈阳:中国医科大学,2005. [25] HäCKER G. ER-stress and apoptosis: molecular mechanisms and potential relevance in infection. Microbes Infect. 2014;16(10):805-810. [26] WONG RS. Apoptosis in cancer: from pathogenesis to treatment. J Exp Clin Cancer Res. 2011;30(1):87. [27] 李帅, 张炳东. 细胞凋亡途径的研究进展[J].山东医药,2017, 57(37):103-106. [28] WANG M, KAUFMAN RJ. Protein misfolding in the endoplasmic reticulum as a conduit to human disease. Nature. 2016;529(7586): 326-335. [29] SANO R, REED JC. ER stress-induced cell death mechanisms. Biochim Biophys Acta. 2013;1833(12):3460-3470. [30] ACOSTA-ALVEAR D, KARAGöZ GE, FRöHLICH F, et al. The unfolded protein response and endoplasmic reticulum protein targeting machineries converge on the stress sensor IRE1. Elife. 2018;7:e43036. [31] SONG S, TAN J, MIAO Y, et al. Crosstalk of autophagy and apoptosis: Involvement of the dual role of autophagy under ER stress. J Cell Physiol. 2017;232(11):2977-2984. [32] QI Z, CHEN L. Endoplasmic Reticulum Stress and Autophagy. Adv Exp Med Biol. 2019;1206(1):167-177. [33] LUHR M, TORGERSEN M L, SZALAI P, et al. The kinase PERK and the transcription factor ATF4 play distinct and essential roles in autophagy resulting from tunicamycin-induced ER stress. J Biol Chem. 2019;294(20):8197-8217. [34] YI S, CHEN K, ZHANG L, et al. Endoplasmic Reticulum Stress Is Involved in Stress-Induced Hypothalamic Neuronal Injury in Rats via the PERK-ATF4-CHOP and IRE1-ASK1-JNK Pathways. Front Cell Neurosci. 2019; 13(5):190. [35] BORODKINA AV, SHATROVA AN, DERYABIN PI, et al. Calcium alterations signal either to senescence or to autophagy induction in stem cells upon oxidative stress. Aging (Albany NY). 2016;8(12):3400-3418. [36] DEEGAN S, KORYGA I, GLYNN SA, et al. A close connection between the PERK and IRE arms of the UPR and the transcriptional regulation of autophagy. Biochem Biophys Res Commun. 2015;456(1):305-311. [37] WEI W, ZHANG F, CHEN H, et al. Toxoplasma gondii dense granule protein 15 induces apoptosis in choriocarcinoma JEG-3 cells through endoplasmic reticulum stress. Parasit Vectors. 2018;11(1):251. [38] WU F, QIU J, FAN Y, et al. Apelin-13 attenuates ER stress-mediated neuronal apoptosis by activating Gα/Gα-CK2 signaling in ischemic stroke. Exp Neurol. 2018;302:136-144. [39] XUE LX, LIU HY, CUI Y, et al. Neuroprotective effects of Activin A on endoplasmic reticulum stress-mediated apoptotic and autophagic PC12 cell death. Neural Regen Res. 2017;12(5):779-786. [40] 李婧,郭风劲.内质网应激反应时IRE1-依赖性XBP1剪接机制[J].生命的化学,2008,28(3):286-288. [41] 郑学忠,陈裕浩,王恩阳,等.沉默IRE1α-XBP1信号通路对HASMC增殖及CyclinD1表达的影响[J].西南国防医药,2019,29(1):1-5. [42] GUO FJ, XIONG Z, LU X, et al. ATF6 upregulates XBP1S and inhibits ER stress-mediated apoptosis in osteoarthritis cartilage. Cell Signal. 2014;26(2):332-342. [43] ZHANG Q, LIU J, CHEN S, et al. Caspase-12 is involved in stretch-induced apoptosis mediated endoplasmic reticulum stress. Apoptosis. 2016;21(4):432-442. [44] SONG J, ZHANG Q, WANG S, et al. Cleavage of caspase-12 at Asp94, mediated by endoplasmic reticulum stress (ERS), contributes to stretch-induced apoptosis of myoblasts. J Cell Physiol. 2018;233(12):9473-9487. [45] HAN X, ZHANG P, JIANG R, et al. Explore on the effect of ATF6 on cell growth and apoptosis in cartilage development. Histochem Cell Biol. 2014;142(5):497-509. [46] ZHENG W, XIE W, YIN D, et al. ATG5 and ATG7 induced autophagy interplays with UPR via PERK signaling. Cell Commun Signal. 2019;17(1):42. [47] YOUSEFI S, PEROZZO R, SCHMID I, et al. Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis. Nat Cell Biol. 2006;8(10):1124-1132. [48] 李云隆. PI3K/Akt/mTOR调控血管内皮细胞自噬在激素性股骨头坏死中的实验研究[D].呼和浩特:内蒙古医科大学,2019. [49] ZHU L, CHEN J, ZHANG J, et al. Parathyroid Hormone (PTH) Induces Autophagy to Protect Osteocyte Cell Survival from Dexamethasone Damage. Med Sci Monit. 2017;23:4034-4040. [50] KIM J, CHEE WY, YABUTA N, et al. Atg5-mediated autophagy controls apoptosis/anoikis via p53/Rb pathway in naked mole-rat fibroblasts . Biochem Biophys Res Commun. 2020;528(1):146-153. [51] HAMAMURA K, YOKOTA H. Stress to endoplasmic reticulum of mouse osteoblasts induces apoptosis and transcriptional activation for bone remodeling. FEBS Lett. 2007;581(9):1769-1774. [52] LIU W, ZHAO Z, NA Y, et al. Dexamethasone-induced production of reactive oxygen species promotes apoptosis via endoplasmic reticulum stress and autophagy in MC3T3-E1 cells. Int J Mol Med. 2018;41(4): 2028-2036. [53] YANG J, WU Q, LV J, et al. 4-Phenyl butyric acid prevents glucocorticoid-induced osteoblast apoptosis by attenuating endoplasmic reticulum stress. J Bone Miner Metab. 2017;35(4):366-374. (责任编辑:WZH,ZN,SX) |
| [1] | Pu Rui, Chen Ziyang, Yuan Lingyan. Characteristics and effects of exosomes from different cell sources in cardioprotection [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(在线): 1-. |
| [2] | An Yang, Liao Yinan, Xie Chengxin, Li Qinglong, Huang Ge, Jin Xin, Yin Dong. Mechanism of Inulae flos in the treatment of osteoporosis: an analysis based on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(在线): 1-8. |
| [3] | Zhang Chao, Lü Xin. Heterotopic ossification after acetabular fracture fixation: risk factors, prevention and treatment progress [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1434-1439. |
| [4] | Zhou Jihui, Li Xinzhi, Zhou You, Huang Wei, Chen Wenyao. Multiple problems in the selection of implants for patellar fracture [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1440-1445. |
| [5] | Wang Debin, Bi Zhenggang. Related problems in anatomy mechanics, injury characteristics, fixed repair and three-dimensional technology application for olecranon fracture-dislocations [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1446-1451. |
| [6] | Ji Zhixiang, Lan Changgong. Polymorphism of urate transporter in gout and its correlation with gout treatment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1290-1298. |
| [7] | Yuan Mei, Zhang Xinxin, Guo Yisha, Bi Xia. Diagnostic potential of circulating microRNA in vascular cognitive impairment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1299-1304. |
| [8] | Geng Qiudong, Ge Haiya, Wang Heming, Li Nan. Role and mechanism of Guilu Erxianjiao in treatment of osteoarthritis based on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1229-1236. |
| [9] | Wang Zhengdong, Huang Na, Chen Jingxian, Zheng Zuobing, Hu Xinyu, Li Mei, Su Xiao, Su Xuesen, Yan Nan. Inhibitory effects of sodium butyrate on microglial activation and expression of inflammatory factors induced by fluorosis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1075-1080. |
| [10] | Wang Xianyao, Guan Yalin, Liu Zhongshan. Strategies for improving the therapeutic efficacy of mesenchymal stem cells in the treatment of nonhealing wounds [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1081-1087. |
| [11] | Wan Ran, Shi Xu, Liu Jingsong, Wang Yansong. Research progress in the treatment of spinal cord injury with mesenchymal stem cell secretome [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1088-1095. |
| [12] | Liao Chengcheng, An Jiaxing, Tan Zhangxue, Wang Qian, Liu Jianguo. Therapeutic target and application prospects of oral squamous cell carcinoma stem cells [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1096-1103. |
| [13] | Zhao Min, Feng Liuxiang, Chen Yao, Gu Xia, Wang Pingyi, Li Yimei, Li Wenhua. Exosomes as a disease marker under hypoxic conditions [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1104-1108. |
| [14] | Xie Wenjia, Xia Tianjiao, Zhou Qingyun, Liu Yujia, Gu Xiaoping. Role of microglia-mediated neuronal injury in neurodegenerative diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1109-1115. |
| [15] | Li Shanshan, Guo Xiaoxiao, You Ran, Yang Xiufen, Zhao Lu, Chen Xi, Wang Yanling. Photoreceptor cell replacement therapy for retinal degeneration diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1116-1121. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||