设计:细胞分子学水平体外基因重组实验。
时间及地点:于2010年9月至2012年10月在山西医科大学中心实验室完成。
材料:
实验动物:健康成年雄性SD大鼠5只,鼠龄6-8周,体质量150-180 g,购自山西医科大学大学实验动物中心,动物质量合格证号:SCXK(晋)2006-0003。正常饮食摄水,光照条件良好。
细胞:3T3成纤维细胞,由本实验室保存。DH5α感受态细胞购自北京天根生化公司。
载体:pVAX1真核表达载体,购自美国Invitrogen公司。
构建Myod1和Myog两者真核共表达载体的实验相关试剂:
.jpg)
实验方法:
失神经支配骨骼肌萎缩动物模型制备:大鼠麻醉后,切断坐骨神经建立。7 d后,取失去坐骨神经支配的小腿三头肌为标本进行总RNA的抽提。
大鼠Myod1和Myog基因的cDNA克隆制备:根据GenBank公布的Myod1和Myog序列,应用 Primer 软件Prim 5.0设计PCR引物如下,Myod1 PCR引物:Myod1-cDNA-F和Myod1-cDNA-R;Myog PCR引物:Myog-cDNA-F和Myog-cDNA-R,具体引物信息见表1。
用Trizol抽提小腿三头肌标本的总RNA,经反转录后,分别用引物进行PCR扩增。扩增体系为:10×buffer 5 μL,MgSO4(50 mmol/L)1.5 μL,dNTP(10 mmol/L) 1 μL,Primer F(10 mmol/L)2 μL ,Primer R(10 mmol/L) 2 μL,cDNA 2 μL,Platinum Taq DNA polymerase High Fidility 0.2 μL,ddH2O 36.5 μL。循环条件为:95 ℃预变性3 min;随后94 ℃ 30 s、56 ℃ 30 s、68 ℃ 60 s,共35个循环;最后68 ℃延伸10 min,4 ℃冷却,回收产物。将PCR产物与pMD18-T simple vector连接以制备重组克隆载体,连接体系:Solution I 5 μL,pMD18-T simple vector 1 μL,PCR产物4 μL,16 ℃连接1 h。产物转化至感受态大肠杆菌E.coli. DH5α,扩增回收。
.jpg)
构建pVAX1-IRES2-EGFP载体:设计引物扩增IRES2-EGFP片段,上游引物5’端添加Eco RI位点,下游引物5’端添加Not I位点。应用 Primer 软件Prim5.0设计PCR引物如下:IRES2-EGFP-Eco RI-F和IRES2-EGFP-Not I-R,见表1。以pIRES2-EGFP为模板扩增IRES2-EGFP片段,扩增体系为:10×buffer 5 μL,MgSO4(50 mmol/L)1.5 μL,dNTP(10 mmol/L) 1 μL,IRES2-EGFP-Eco RI-F(10 μmol/L)2 μL,IRES2-EGFP-Not I-R(10 μmol/L)2 μL,pIRES2-EGFP 0.5 μL,Platinum pfx DNA polymerase(5 U/μL) 0.2 μL,ddH2O 37.8 μL。循环条件:95 ℃预变性3 min;之后94 ℃ 30 s、55 ℃ 30 s、68 ℃ 90 s,共30个循环;最后68℃延伸10 min,4 ℃冷却,回收产物。用Eco CRI和Not Ⅰ分别酶切IRES2-EGFP片段和pVAX载体1,酶切体系为:10×buffer 5 μL,DNA(100 mg/L)5 μL,Eco RI 1 μL,Not Ⅰ1 μL,ddH2O 38 μL,37 ℃反应 2 h,回收产物。将酶切的IRES2-EGFP片段连接到pVAX1载体制备重组克隆载体,连接体系为:Ligation buffer 1 μL,酶切的pVAX1(20 mg/L)1 μL,酶切的IRES2-EGFP片段2 μL,T4 DNA ligase 0.5 μL,ddH2O 5.5 μL,室温连接2 h,产物转化法转化感受态大肠杆菌E.coli. DH5α,扩增回收。
构建pVAX1-Myod1-IRES2-EGFP载体:设计引物使Myod1与IRES2-EGFP进行PCR拼接。应用 Primer 软件Prim5.0设计PCR引物如下:Primer 1和2扩增Myod1;Primer 3和IRES2-EGFP-Not I-R扩增IRES2-EGFP,见表1。Primer1的5’端加Eco RI位点。以cDNA克隆质粒为模板,扩增Myod1拼接片段;以pIRES2-EGFP质粒为模板扩增IRES2-EGFP拼接片段。扩增体系为:10×buffer 5 μL,MgSO4(50 mmol/L ) 1 μL,dNTP (10 mmol/L )1 μL,Primer F(10 μmol/L) 2 μL ,Primer R(10 μmol/L)2 μL,Platinum pfx DNA polymerase(5 U/μL)0.2 μL,质粒0.5 μL,ddH2O 38.3 μL。循环条件为:95 ℃预变性3 min;之后94 ℃ 30 s、56 ℃ 30 s、68 ℃ 2 min,共30个循环;最后68 ℃延伸10 min,4 ℃冷却,回收产物。将Myod1片段与IRES2-EGFP片段进行PCR拼接,拼接成Myod1-IRES2-EGFP片段,扩增体系如下:10×buffer 5 μL,MgSO4(50 mmol/L)1 μL,dNTP(10 mmol/L)1 μL,Primer 1(10 μmol/L)2 μL,Primer 2(10 μmol/L)2 μL,Platinum pfx DNA polymerase(5 U/μL)0.2 μL,Myod1片段2 μL,IRES2-EGFP片段2 μL,ddH2O 34.8 μL。循环条件为:95 ℃预变性3 min;之后94 ℃ 30 s、 60 ℃ 30 s、68 ℃ 3 min,共30个循环;最后68 ℃延伸10 min,4 ℃冷却,回收产物。用Eco RI和Not I酶切Myod1-IRES2-EGFP片段和pVAX1载体,酶切体系为:10×buffer 5 μL,DNA(200 mg/L)5 μL,Eco RI 1 μL,Not I 1 μL,ddH2O 38 μL,37 ℃反应2 h,回收产物。用T4 DNA ligase连接Myod1-IRES2-EGFP片段和pVAX1载体,连接体系为:Ligation buffer 1 μL,酶切的pVAX1(20 mg/L)1 μL,酶切的Myod1-IRES2-EGFP片段2 μL,T4 DNA ligase 0.5 μL,ddH2O 5.5 μL。室温连接2 h。产物转化感受态大肠杆菌E.coli.DH5α,扩增回收。
构建pVAX1-Myog-IRES2-EGFP载体:设计引物使Myog与IRES2-EGFP进行PCR拼接。应用 Primer 软件Prim5.0设计PCR引物如下:Primer 4和5扩增Myog;Primer 6和IRES-EGFP-Not I-R扩增IRES2-EGFP ,见表1。Primer4的5’端加Eco RI位点。以cDNA克隆质粒为模板扩增Myog拼接片段;以pIRES2-EGFP质粒为模板扩增IRES2-EGFP拼接片段。扩增体系为:10×buffer 5 μL,MgSO4(50 mmol/L) 1 μL,dNTP(10 mmol/L ) 1 μL,Primer F (10 μmol/L)2 μL ,Primer R(10 μmol/L)2 μL,Platinμmol/L pfx DNA polymerase(5 U/μL)0.2 μL,质粒0.5 μL,ddH2O 38.3 μL。循环条件为:95 ℃预变性 3 min;之后94 ℃ 30 s、56 ℃ 30 s、68 ℃ 2 min,共30个循环;最后68 ℃延伸10 min,4℃冷却,回收产物。将Myog片段与IRES2-EGFP片段进行拼接,拼接成Myog-IRES2-EGFP片段,扩增体系如下:10×buffer 5 μL,MgSO4(50 mmol/L)1 μL,dNT P(10 mmol/L)1 μL,Primer 4(10 μmol/L)2 μL,Primer5(10 μmol/L)2 μL,Platinum pfx DNA polymerase(5 U/μL)0.2 μL,Myog片段2 μL,IRES2-EGFP片段2 μL,ddH2O 34.8 μL。循环条件为:95 ℃预变性3 min;之后94 ℃ 30 s、60 ℃ 30 s、68 ℃ 3 min,共30个循环;最后68 ℃延伸10 min,4℃冷却,回收产物。用Eco RI和Not I酶切Myog-IRES2-EGFP片段和pVAX1载体,酶切体系为:10×buffer 5 μL,DNA(200 mg/L)5 μL,Eco RI 1 μL,Not I 1 μL,ddH2O 38 μL,37 ℃反应2 h,回收产物。用T4 DNA ligase连接Myog-IRES2-EGFP片段和pVAX1载体,连接体系为:Ligation buffer 1 μL,酶切的pVAX1(20 mg/L)1 μL,酶切的Myog-IRES2-EGFP片段2 μL,T4 DNA ligase 0.5 μL,ddH2O 5.5 μL,室温连接2 h。产物转化感受态大肠杆菌E.coli. DH5α,扩增回收。
构建pVAX1-Myod1-IRES2-Myog载体:设计引物使Myog与Myod1-IRES2进行PCR拼接。应用 Primer 软件Prim5.0设计PCR引物如下:Primer 7和8扩增Myod1-IRES2;Primer 9和10扩增Myog,见表1。Primer7的5’端加Nhe I位点,Primer10的5’端加Eco RI位点。以pVAX1-Myod1-IRES2-EGFP为模板,扩增Myod1-IRES2拼接片段;以cDNA克隆为模板扩增Myog拼接片段。PCR体系如下:10×buffer 5 μL,MgSO4(50 mmol/L)1 μL,dNTP(10 mmol/L) 1 μL,Primer F(10 μmol/L)2 μL ,Primer R(10 μmol/L)2 μL,Platinum pfx DNA polymerase(5 U/μL)0.2 μL,质粒 0.5 μL,ddH2O 38.3 μL。循环条件为:95 ℃预变性 3 min;之后94 ℃ 30 s、56 ℃ 30 s、68 ℃2 min,共30个循环;最后68 ℃延伸10 min,4℃冷却,回收产物。将Myod1-IRES2片段与Myog片段进行PCR拼接,拼接成Myod1-IRES2-Myog片段,扩增体系如下:10×buffer 5 μL,MgSO4(50 mmol/L)1μL,dNTP (10 mmol/L)1 μL,Primer 7(10 μmol/L)2 μL,Primer 8(10 μmol/L)2 μL,Platinum pfx DNA polymerase (5 U/μL)0.2 μL,Myog片段2 μL,IRES2-EGFP片段 2 μL,ddH2O 34.8 μL。循环条件为:95 ℃预变性3 min;之后94 ℃ 30 s、60 ℃ 30 s、68 ℃ 3 min,共 30个循环;最后68 ℃延伸10 min,4 ℃冷却,回收产物。用Eco RI和Nhe I酶切Myod1-IRES2-Myog片段和pVAX1载体,酶切体系为:10×buffer 5 μL,DNA (200 mg/L)5 μL,Eco RI 1 μL,Nhe I 1 μL,ddH2O 38 μL,37 ℃反应2 h,回收产物。用T4 DNA ligase连接Myod1-IRES2-Myog片段和pVAX1载体,连接体系为:Ligation buffer 1 μL,酶切的pVAX1(20 mg/L) 1 μL,酶切的Myod1-IRES2-Myog片段2 μL,T4 DNA ligase 0.5 μL,ddH2O 5.5 μL,室温连接2 h,产物转化感受态大肠杆菌E.coli.DH5α,扩增回收。
构建pVAX1-Myod1-IRES2-Myog-IRES2-EGFP真核共表达载体:用Eco RI和Not I酶切pVAX1-IRES2-EGFP和pVAX1-Myod1-IRES2-Myog载体,酶切体系为:10×buffer 5 μL,DNA(200 mg/L)5 μL,Eco RI 1 μL,Nhe I 1 μL,ddH2O 38 μL,37 ℃反应2 h,回收产物。用T4 DNA ligase连接IRES2-GFP片段和pVAX1-Myod1-IRES2-Myog载体制备重组克隆载体。连接体系:Ligation buffer 1 μL,酶切的pVAX1-Myod1-IRES2-Myog载体(20 mg/L)1 μL,IRES2-EGFP片段2 μL,T4 DNA ligase 0.5 μL,ddH2O 5.5 μL,室温连接2 h,产物转化感受态大肠杆菌E.coli. DH5α,扩增回收。
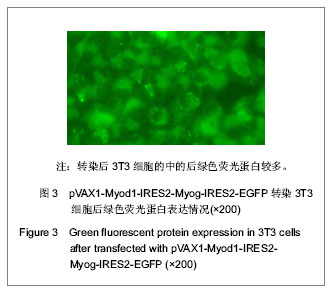
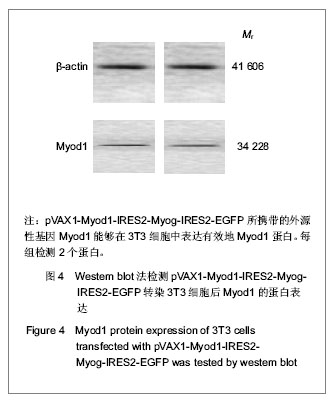
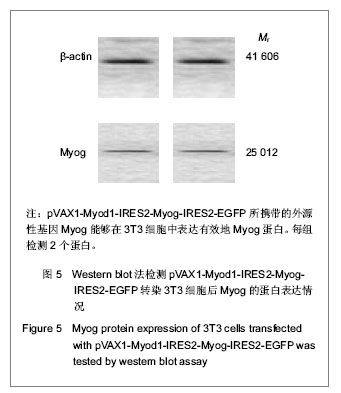
真核共表达载体pVAX1-Myod1-IRES2-Myog-IRES2- EGFP转染3T3细胞及鉴定:利用Lipofectamine 2000 脂质体转染试剂将pVAX1-Myod1-IRES2-Myog-IRES2- EGFP转染至对数生长期的3T3细胞,转染24 h后,用荧光显微镜观察GFP的表达情况,并用Western blot法检测目的蛋白Myod1、Myog的蛋白表达情况。
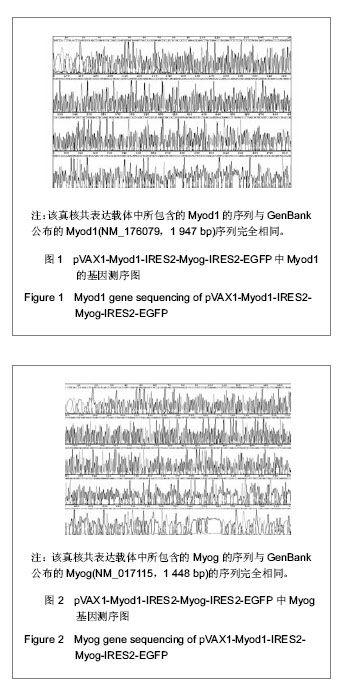
主要观察指标:委托Takara公司和上海生工(Sangon)生物工程公司分别对真核共表达载体pVAX1-Myod1-IRES2-Myog-IRES2-EGFP进行基因测序鉴定。利用荧光显微镜观察pVAX1-Myod1-IRES2- Myog-IRES2-EGFP转染3T3细胞后绿色荧光蛋白的表达情况。Western blot法检测3T3细胞在转染pVAX1-Myod1-IRES2-Myog-IRES2-EGFP之后外源性基因Myod1和Myog的蛋白表达情况。
.jpg)
.jpg)