1.1 设计 体外培养并鉴定HGFs、HGECs、VECLs,构建HGECs-HGFs-VELCs-脱细胞基质-0.25%类人Ⅰ型胶原复合体。动物体内构建口腔黏膜等效物,对其血管化特征进行分析。两组间比较采用t检验。
1.2 时间及地点 实验于2022年3月至2023年12月在口颌面修复重建和再生泸州市重点实验室完成。
1.3 材料
1.3.1 实验动物 雄性BALB/c-nu裸鼠12只, 四五周龄,SPF级,体质量15-18 g,购自成都达硕实验动物有限公司,使用许可证编号:SYXK(川)2018-065。12周龄雌性新西兰大白兔6只,体质量1.8-2.0 kg,购自重庆腾鑫生物技术有限公司,生产许可证编号:SCXK(渝)2017-0010。实验方案已通过西南医科大学实验动物伦理委员会审查(动物伦理编号:201909-1)。
1.3.2 牙龈组织 牙龈组织取自18-24周岁健康青少年,需手术翻瓣拔除的下颌埋伏阻生智齿,在拔除时切取少量无炎症牙龈组织,获得患者及其家属知情同意,并签署了知情同意书。实验已通过西南医科大学附属口腔医院伦理审查协会审查(人体标本伦理编号:20190828001)。
1.3.3 主要试剂及仪器 胎牛血清(浙江天杭);DMEM培养基(美国Thermo Fisher);OCT包埋剂(广州捷威斯);基质胶(深圳赛进);类人Ⅰ型胶原(美国BioVision);CD73、CD90、S100A4抗体(美国Biolegend);波形蛋白(美国SAB);CD31、CD34、血管内皮生长因子165(武汉博士德);细胞角蛋白、CD51、CD54、CD105、Tie-2抗体(北京博奥森);VWF、血管内皮生长因子受体1抗体(美国SAB);血管内皮生长因子受体2抗体(南京巴傲得);吲哚美辛、地塞米松、胰岛素、3-异丁基-甲基嘌呤(北京索莱宝);生物胶(美国3M);EdU试剂盒(广州锐博);罗丹明、异硫氰酸荧光素(FITC)、免疫组化试剂盒(北京中杉金桥);倒置显微镜(日本OLYMPUS);荧光显微镜、冷冻切片机(上海徕卡);激光捕获显微切割系统(上海富鲁达)。
1.4 实验方法
1.4.1 HGFs、HGECs的培养 获取少量下颌埋伏阻生智齿拔除时的健康无炎症牙龈组织,于超净工作台无菌条件下冲洗牙龈组织,分离表层上皮组织和下层固有层组织,分别剪碎成大小约1 mm×1 mm×1 mm,均匀平铺于与培养瓶底部相对的一侧瓶底,轻轻翻转培养瓶,向培养瓶底部加入2 mL含体积分数15%胎牛血清的DMEM培养液,置于37 ℃、体积分数5%CO2孵育箱中培养,培养2 h后轻轻翻转培养瓶,使培养液缓慢浸入瓶底的组织块,进行原代培养,从表层上皮组织分离获得HGECs,从下层固有层组织分离获得HGFs。每隔三四天观察1次,进行换液。待细胞铺满瓶底85%左右进行传代培养。于倒置显微镜下观察细胞状态并捕获图像。
1.4.2 人牙龈间充质干细胞的单克隆培养 将人健康无炎症牙龈组织于超净工作台无菌条件下冲洗后,分离固有层组织,剪碎成大小约1 mm×1 mm×1 mm,均匀平铺于与培养瓶底部相对的一侧瓶底,轻轻翻转培养瓶,向培养瓶底部加入2 mL含体积分数15%胎牛血清、100 mmol/L维生素C的DMEM培养基,置于37 ℃、体积分数5%CO2孵育箱中培养。培养2 h后轻轻翻转培养瓶,进行原代培养。
将生长状态良好的人牙龈间充质干细胞悬液接种于96孔板中,细胞浓度为5×103 L-1,每孔100 µL,次日将96孔板置于倒置显微镜下筛选出仅含单个细胞的孔数,加入适量培养液,置于37 ℃、体积分数5%CO2孵育箱中培养。每日于倒置显微镜下观察细胞扩增情况并捕获图像。当细胞培养形成较大的克隆团块时0.25%胰酶消化团块,1 000 r/min离心5 min,弃上清,依次转移至24孔板、6孔板、细胞培养瓶中进行传代培养。
1.4.3 人牙龈间充质干细胞的干性鉴定
免疫荧光与免疫细胞化学染色:选取生长状态良好的人牙龈间充质干细胞,制备细胞爬片进行鉴定。将细胞爬片浸于丙酮中,用PBS冲洗。①采用免疫荧光染色法对人牙龈间充质干细胞进行CD73、CD90染色:在人牙龈间充质干细胞爬片上分别滴加CD73、CD90工作液 4 ℃孵育过夜,用PBS冲洗后分别滴加罗丹明、FITC染液 37 ℃避光孵育1 h,DAPI核染后于荧光显微镜下观察并捕获图像。②采用免疫细胞化学染色法对人牙龈间充质干细胞进行CD73、CD90染色:人牙龈间充质干细胞爬片滴加H2O2去离子水室温孵育10 min,用PBS冲洗;山羊血清封闭10-15 min,倾去勿洗;分别滴加CD73、CD90工作液4 ℃孵育过夜,用PBS冲洗;二抗工作液孵育10-15 min,用PBS冲洗;辣根酶标记链霉卵白素工作液处理10-15 min,用PBS冲洗;DAB显色5-10 min,用PBS冲洗;苏木精复染,梯度乙醇脱水,二甲苯透明,中性树胶封固,于倒置显微镜下观察并捕获图像。
成脂诱导实验:选取生长状态良好的人牙龈间充质干细胞,以8×104/孔的密度接种于含1%明胶的6孔板中,诱导组待细胞增长至60%时更换为成脂诱导液A液,按照1 d A液、2d成脂诱导液B液的顺序循环换液进行培养;对照组加入普通培养基进行培养。21 d后采用油红O染色试剂盒进行染色,于倒置显微镜下观察并捕获图像。
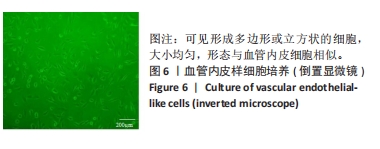
1.4.4 VELCs的培养 前期研究已证实8 ng/mL血管内皮生长因子165对人牙龈间充质干细胞具有良好的诱导分化作用[11]。因此,实验直接选用8 ng/mL血管内皮生长因子165对人牙龈间充质干细胞进行诱导35 d,使其分化形成VELCs。于倒置显微镜下观察细胞状态并捕获图像。
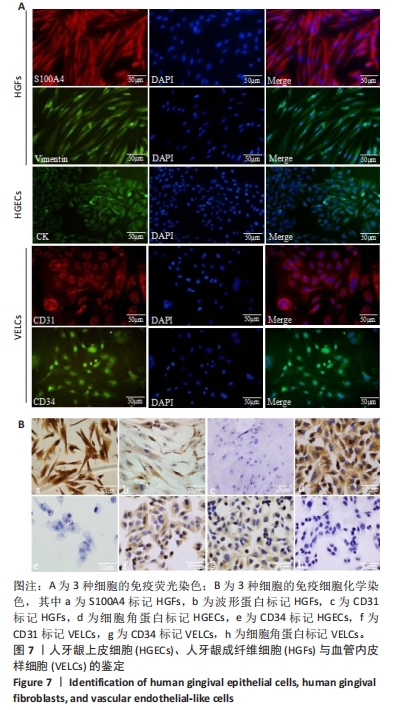
1.4.5 HGECs、VELCs、HGFs的鉴定 基于前期研究基础[10],选取生长状态良好的HGFs、HGECs、VELCs,制备细胞爬片进行鉴定。将细胞爬片浸于丙酮中,用PBS冲洗。①采用免疫荧光染色分别对HGFs进行S100A4、波形蛋白染色,HGECs进行细胞角蛋白染色,VELCs进行CD31、CD34染色。DAPI核染后于荧光显微镜下观察并捕获图像。②采用免疫细胞化学染色法分别对HGFs进行S100A4、波形蛋白、CD31染色,HGECs进行细胞角蛋白、CD34染色,VECLs进行CD31、CD34、细胞角蛋白染色。于倒置显微镜下观察并捕获图像。
1.4.6 脱细胞基质-0.25%类人Ⅰ型胶原生物支架的制备 基于前期研究基础制备脱细胞基质-0.25%类人Ⅰ型胶原生物支架[10-12]。取新西兰大白兔6只,耳缘静脉注射5%戊巴比妥钠6 mL/kg麻醉后处死,切取腹主动脉,用生理盐水冲洗干净后剪为长度2 cm左右,浸泡于含1%苯扎溴安的PBS中室温下处理1 h。用PBS洗净后将血管转移至0.1%胰酶溶液中,置于37 ℃、体积分数5% CO2培养箱中作用6 h。用PBS洗净后转移至含1%TritonX-100的PBS中,室温孵育72 h;用PBS洗净制得脱细胞基质支架。再制备1 cm长的片状脱细胞基质支架和2 mm厚的环形脱细胞基质支架。将脱细胞基质支架浸泡于1 mol/L
丙烯酸溶液中处理1 h,置于无菌培养皿中紫外灯照射30 min。无菌双蒸水清洗后,将脱细胞基质-丙烯酸支架转移至5 mg/mL水溶性碳二酰亚胺溶液中4 ℃下浸泡1 h。用PBS洗净后浸泡于0.25%类人Ⅰ型胶原溶液中室温结合5 h,形成脱细胞基质-0.25%类人Ⅰ型胶原生物支架,见图1。

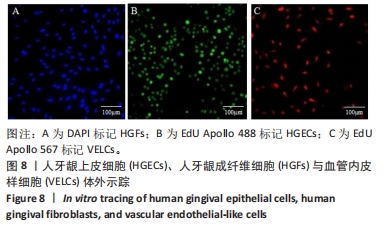
1.4.7 体外示踪标记HGECs、VELCs、HGFs 取生长状态良好的HGECs、VELCs,用含有10 μmol/L EdU Apollo的DMEM培养液培养24 h。部分细胞制备细胞爬片,按照EdU试剂盒步骤进行体外示踪染色,甘油封固。选取生长状态良好的HGFs,制得细胞爬片,加入含有DAPI染色液的DMEM培养液于孵育箱中培养1 h,甘油封固,于荧光显微镜下观察并捕获图像。另外一部分细胞用作种子细胞构建口腔黏膜等效物。
1.4.8 体外三维细胞分层重建组织工程血管化口腔黏膜样结构复合体 基于前期研究基础构建组织工程血管化口腔黏膜样结构复合体[10]。选取生长状态良好DAPI标记的HGFs、EdU Apollo 567标记的VELCs,0.25%胰酶消化,调整细胞浓度为1×109 L-1。取100 μL HGFs、VELCs细胞悬液与基质胶按照4∶1混合后分别植于片状脱细胞基质-0.25%类人Ⅰ型胶原支架、环形脱细胞基质-0.25%类人Ⅰ型胶原支架上,置于孵育箱中共培养1周,得到复合体Ⅰ、复合体Ⅱ。向复合体Ⅰ表面滴加10 μL基质胶,置于孵育箱中静置30 min,待基质胶发生胶变后,将复合体Ⅱ种植于复合体Ⅰ表面,置于孵育箱中共培养1周,形成复合体Ⅲ。选取处于对数生长期EdU Apollo 488标记的HGECs,0.25%胰酶消化,调整细胞浓度为1×109 L-1,取 100 μL细胞悬液与基质胶按照4∶1混合后植于复合体Ⅲ上,置于孵育箱共培养1 周,得到HGECs-HGFs-VELCs-脱细胞基质-0.25%类人Ⅰ型胶原复合体,见图2。

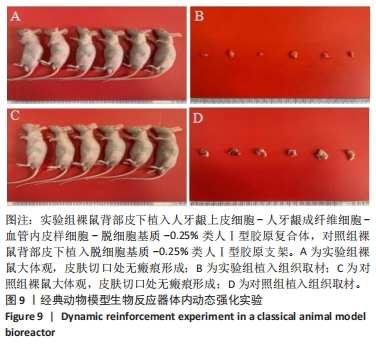
1.4.9 经典动物模型生物反应器行体内动态强化实验 基于前期研究基础进行[10]。 采用随机数字表法将12只裸鼠随机分为实验组和对照组,每组6只。用生理盐水配制溶液,腹腔注射0.5%戊巴比妥钠5 mL/kg麻醉12只裸鼠,于左背部行长1.0 cm×宽1.0 cm全层切口,钝性分离组织至皮下,实验组植入HGECs-HGFs-VELCs-脱细胞基质-0.25%类人Ⅰ型胶原复合体,空支架组植入脱细胞基质-0.25%类人Ⅰ型胶原支架,聚氨酯薄膜覆盖,组织对位缝合。14 d后移除皮下聚氨酯薄膜,于切口表面涂布富含胶原蛋白的生物胶,实验组将EdU Apollo 488标记的HGECs(约1×106个)种植于生物胶表面,对照组不移植细胞。待裸鼠全部苏醒送回SPF动物实验室。继续饲养14 d后腹腔注射5%戊巴比妥钠后处死,于材料植入部位进行组织取材。
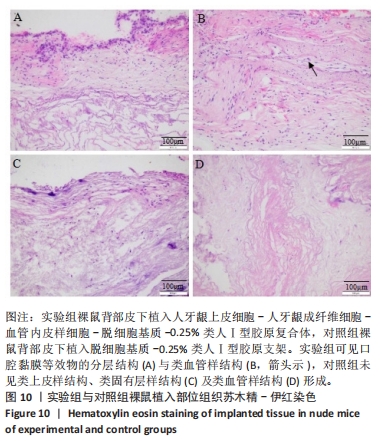
形态学观察口腔黏膜等效物分层结构:将动物体内强化构建的口腔黏膜等效物组织及对照组组织进行石蜡包埋切片,切片脱蜡后进行苏木精-伊红染色,中性树胶封固,显微镜下观察并捕获图像。
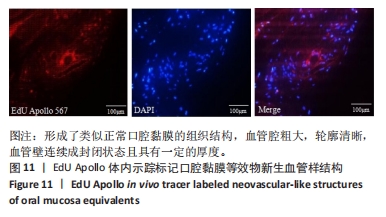
EdU Apollo体内示踪口腔黏膜等效物中新生血管样结构:将口腔黏膜等效物组织切片脱蜡后按照EdU试剂盒步骤染色,甘油封固,于荧光显微镜下观察并捕获图像。
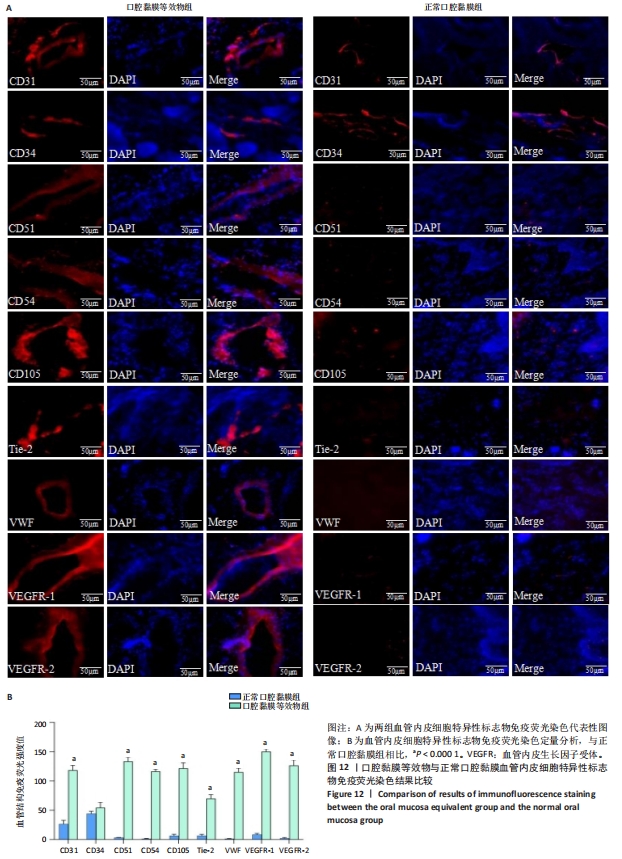
免疫荧光标记口腔黏膜等效物中的新生血管样结构:对三维重建的口腔黏膜等效物组织和正常人口腔黏膜组织石蜡切片分别进行免疫荧光染色。切片脱蜡至水,去离子H2O2阻断内源性过氧化物酶处理10 min。加入一抗(血管内皮细胞标志物CD31、CD34、CD51、CD54、CD105、Tie-2、VWF、血管内皮生长因子受体1、血管内皮生长因子受体2)于4 ℃孵育过夜。加入二抗TRITC 37 ℃避光下孵育1 h。DAPI溶液室温、避光条件下孵育15 min,甘油封固,于荧光显微镜下观察标记的血管样结构并捕获图像,使用Image J软件对标记的血管样结构荧光强度进行测定。
激光捕获显微切割系统靶向捕获口腔黏膜等效物中的新生血管样结构:将口腔黏膜等效物组织及正常口腔黏膜组织于-20 ℃用OCT包埋剂包埋,置于冷冻切片机中制备12 μm薄切片,组织切片至PEN膜载玻片上。将冰冻切片PEN膜载玻片分别进行苏木精-伊红染色,脱水后于激光捕获显微切割系统下观察并对口腔黏膜等效物组织中的新生血管样结构和正常口腔黏膜组织中的毛细血管结构激光靶向切割,将捕获的血管组织于-80 ℃冰箱保存。基于免疫荧光染色结果,对口腔黏膜等效物组和正常口腔黏膜分别采用较为全面的血管内皮细胞特异性标志物表达谱CD31、CD34、CD51、CD54、CD105、Tie-2、VWF、血管内皮生长因子受体1、血管内皮生长因子受体2进行免疫组化染色。口腔黏膜等效物组织和正常口腔黏膜组织行冰冻切片免疫组化染色,于激光捕获显微切割系统下观察并对口腔黏膜等效物组织中呈阳性表达的新生血管样结构和正常口腔黏膜组织中呈阳性表达的毛细血管结构进行激光靶向捕获,置于-80 ℃冰箱保存。正常口腔黏膜组织行石蜡切片免疫组化染色,中性树胶封固后于显微镜下观察并捕获图像,使用Image J软件对免疫组化染色标记的阳性面积进行测定。
1.5 主要观察指标 ①HGFs、HGECs、人牙龈间充质干细胞、VELCs的形态及表面标志物表达;②口腔黏膜等效物的形态学结构;③采用免疫荧光、免疫组化染色对口腔黏膜等效物中的新生血管样结构进行较为全面的血管内皮细胞特异性标志物表达谱标记,行血管化特征分析;④采用激光捕获显微切割系统靶向捕获免疫组织化学特异性标记的口腔黏膜等效物中新生血管样结构,靶向分析其血管化特征。
1.6 统计学分析 采用Graphpad Prism 5.0软件对数据结果进行统计学分析,计量资料以x±s表示,两组间比较采用t检验,P < 0.05为差异有显著性意义。文章统计学方法已经通过西南医科大学附属口腔医院生物统计学专家审核。