3.1 加替沙星-聚癸二酸酐缓释制剂释药特性 加替沙 星-聚癸二酸酐缓释制剂可较好的避免了加替沙星全身用药造成的各种不良反应,并且在局部组织内的药物浓度达到有效抑菌浓度
[4] 。因此,该释药系统的持续释药有可能较好的发挥加替沙星的抗菌作用。此外,在整个实验期间,动物未发生死亡,未观察到其他异常现象。聚癸二酸酐是以表面溶蚀方式降解,通过扫描电镜可见药棒内部结构致密,表面结构成小球状,降解呈表面溶蚀降解,溶蚀面与非溶蚀面分界明显
[5] 。
3.2 加替沙星-聚癸二酸酐缓释制剂预防骨感染机制探讨 加替沙星-聚癸二酸酐缓释制剂预防骨感染机制为预防开放性骨损伤手建模后感染,降低继发骨髓炎发生率,除需严格无菌操作及彻底清创外,传统上一般还需全身应用抗生素进行辅助预防。全身用药虽可在血液中达到较高浓度,但对于一些局部血循环破坏较重的损伤,常不能在损伤局部达到有效的药物浓度,从而限制其有效的预防作用。为增加抗生素预防感染的能力,一些学者开始研究和应用局部缓释抗生素的用药方式,并取得一定的效果。特别是PMMA抗生素珠链对抗生素有较好的缓释作用,长期在局部维持有效药物浓度,因而可较好预防骨关节手建模后继发感染及骨髓炎的发生。Ostermann等
[6]用PMMA珠链治疗四肢开放性骨折,建模后感染率由传统治疗方法的12%下降到3.7%。但PMMA抗生素珠链在机体内不能降解吸收,需再次取出。为此作者研制了加替沙星-聚癸二酸酐局部缓释制剂。
应用抗生素控制感染需满足2个条件
[7-8] :①有效杀菌浓度。②维持足够长的时间。加替沙星-聚癸二酸酐缓释制剂体内降解速度缓慢,在局部可保留很长时间,使实验菌繁殖长时间被抑制,便于机体杀灭,使炎症逐渐好转。
实验以兔右股骨开窗注入金黄色葡萄球菌制成急性骨髓炎模型,致病细菌侵入局部后,首先能引起炎症反应。血管扩张充血,局部组织渗液,炎性渗出物逐渐变成脓性,局部骨质吸收,伏克曼氏(Volkmann canals)及哈佛氏管(Havevsian canals)扩大,由于炎症渗液不断增加,组织压力逐渐上升,迫使髓腔内的渗液和脓汁通过上述皮质骨的管道到达骨膜下,并将骨膜掀起,阻断了骨膜血管对骨皮质的血液应。当骨膜下脓液增多,脓液又可从骨皮质的纵横管道返回骨髓腔,致使感染向骨髓腔上下发展,髓腔内脓液压力增高,压迫血管,也可引起循环障碍,骨质坏死,死骨形成。早期及时使用有效的抗菌药物,对治疗急性骨髓炎极为重要。自庆大霉素珠链问世后,局部药物释放系统被认为是治疗骨感染的一种优良方法。但存在二期拔链,患者疼痛难忍等缺点。许多学者开始研究可吸收材料如胶原、明胶海绵、醇溶蛋白、聚乳酸等为载体的局部药物释放系统。但这些局部药物释放系统本身存在一定的缺点,如药物释放过快,仅维持数天有效浓度;载体易碎裂;具有一定的抗原性。故均未很好地过渡到临床运用
[9] 。
另外,慢性骨髓炎难以治愈是由于死骨、死腔、窦道形成,为致病菌潜伏和繁殖提供良好的外环境
[10] 。清除病灶和血肿、消灭死腔以及应用有效抗生素是治疗慢性骨感染的基本措施Mayberry-Carson等
[11]观察到骨髓炎的致病菌能产生多糖蛋白复合物,易使细菌黏附于死骨上,并形成生物膜,使细菌潜伏在死骨内。Nickel等
[12]的实验证实要杀灭潜伏在生物膜内细菌,局部抗生素浓度必须高于致病菌最低抑菌浓度许多倍。显然全身应用抗生素难以达到这样的治疗要求。局部应用抗生素的方法主要有局部直接注射法
[7] 、闭合灌注和吸引法等
[13] 。局部给药虽能增加病灶抗生素浓度,且全身浓度较低,但由于存在疗程长,操作繁琐等问题,临床应用受到一定限制。自从Wahlig等
[14]研制成功庆大霉素PMMA珠链并应用于治疗骨髓炎后,这种局部药物释放系统已被推广应用,其缺点是需二期拔 链
[15-16] ,因此可吸收局部药物释放系统亟待研究。
理想的药物控制释放系统应具备下列特征:惰性(对药物而言),生物相容的,具有一定机械强度,不会给患者带来任何不适,能获得高的载药量,不会发生意外释放,易于施用及排除,易于加工和保存。因而有关生物降解材料为载体的植入性抗感染LDDS不断受到人们的关注。作者自主合成的新型生物可降解材料聚癸二酸酐是一种生物相容性良好、可吸收降解、无毒、无致畸作用的局部药物释放系统载体,为此设计了此实验,来验证加替沙星-聚癸二酸酐缓释制剂体内释药特性及其对骨感染的预防作用。
加替沙星药物的选择,加替沙星是一种8-氧基氟喹诺酮类抗生素,其8-氧基能降低革兰阳性菌的耐药性,不仅弥补了环丙沙星、氧氟沙星等第三代喹诺酮类药物仅对革兰阴性菌有很好的抗菌作用,而对革兰阳性菌、厌氧菌、支原体、衣原体以及分枝杆菌等活性不强的缺点,对这些病原体也有较好的抗菌作用,而且没有潜在的光敏副反应,并且加替沙星比较耐热,其熔点是160-163 ℃,并且在 4 500 LX强光照射下未发生分解,20 kGy
60 Co对加替沙星进行辐照,对加替沙星的结构没有影响,加替沙星内没有新物质的生成。局部缓释抗生素系统的灭菌多采用60Co辐照灭菌的方法,但是许多抗生素不能耐受
60 Co辐照,这极大限制了抗生素的应用,但是加替沙星能够耐受20 kGy
60 Co辐照,并且结构不发生改变,再加上其广谱抗菌作用,这正是局部缓释抗生素系统选择加替沙星的原因所在。另外,聚酸酐作为合成生物可降解药物缓释材料,在过去的20年中,其在临床医学领域的应用是一个极为活跃的研究领域。聚酸酐对于疏水性药物具有较好的缓释性能,而对亲水性药物的释放速度较快、以及药物在释放之前水解失活。加替沙星是氟喹诺酮类药物中光毒性最小,疏水性最大的药物,这正能满足聚酸酐材料对药物的要求。通过加替沙星-聚癸二酸酐缓释制剂制作工艺、辐照灭菌、降解特性等方面的考虑,加替沙星是最佳选择药物。
现将加替沙星-聚癸二酸酐缓释制剂作为植入式局部药物释放系统,为预防和治疗骨感染开辟了新的DDS。聚癸二酸酐是一种无毒,无致畸,无不良反应,生物相溶性好,在体内可完全降解。实验证实了加替沙星-聚癸二酸酐缓释制剂能有效预防骨感染,有望成为一种预防和治疗骨感染的简单、方便、安全且无需二期取出的方法。
加替沙星-聚癸二酸酐局部缓释系统不良反应分析及生物相容性分析:目前对生物制品或材料的相容性评价方法主要有两类:一是动物体内实验,即将材料或其浸提液放入动物活体内,观察全身及局部组织病理变化;另一类是体外实验,即用材料或其浸提液对体外培养的组织细胞生长、代谢及增殖方面的影响进行观察。生物可降解聚癸二酸酐植入新西兰大耳白兔体内,聚癸二酸酐随时间延长,体积缩小,表明聚癸二酸酐在新西兰大耳白兔体内可以发生降解和吸收。在整个实验期间,所有动物未发生局部红肿,溃烂,未发现任何行为异常,肺、心、肝、肾及局部肌肉组织结构未发生改变,且能生存至预定处死日期。这些初步的观察表明,聚癸二酸酐具有较好的体内生物相容性。
聚癸二酸酐降解属于表面溶蚀降解机制,影响聚癸二酸酐降解的因素主要有:①形态因素。结晶体比无定型结构降解慢,致密结构比多孔结构降解慢。与介质接触面积越小,降解越慢。因此不同的制备方法对材料的药释性能影响很大。②结构因素:加替沙星-聚癸二酸酐缓释制剂载药量越大,降解速率越大。这主要是由于加替沙星易溶于介质,当加替沙星含量增大时,会明显加快加替沙星-聚癸二酸酐降解速度。
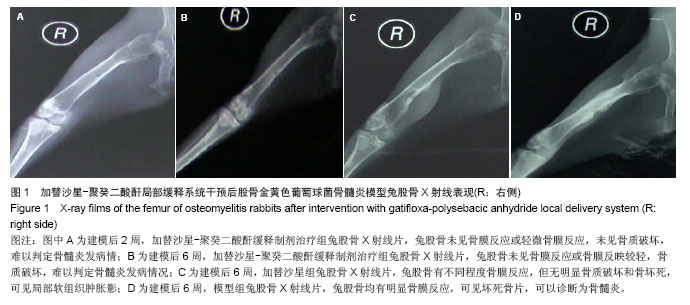
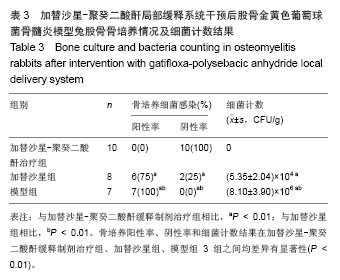
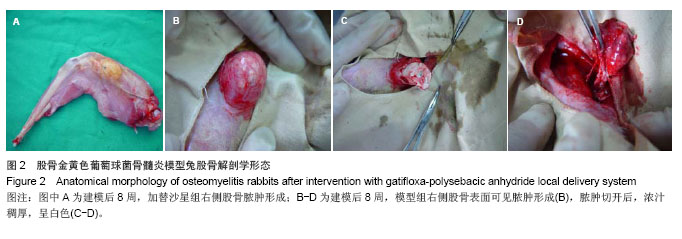
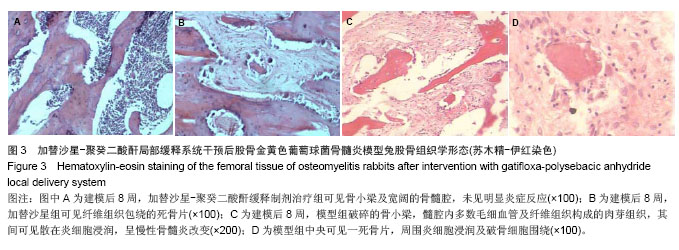
实验通过对3组兔体质量、骨培养及组织学观察分析。模型组7只动物均有不同程度的骨髓炎临床表现,建模后7周体质量明显减轻,骨培养均阳性,细菌经鉴定为金黄色葡萄球菌,说明本试验采用的骨髓炎模型是可靠的。加替沙星-聚癸二酸酐缓释制剂治疗组动物无骨髓炎表现,建模后体质量增加,Laurence得分低,两种指标明显优于加替沙星组和模型组,说明加替沙星-聚癸二酸酐缓释制剂有预防骨感染的作用;加替沙星组骨培养阳性率为75%,与模型组相比差异有显著性意义,说明早期应用加替沙星也能降低骨感染率,但效果不如应用加替沙星-聚癸二酸酐缓释制剂。根据该实验结果,目前考虑加替沙星-聚癸二酸酐缓释制剂能够有效预防骨感染的发生,并且有望成为预防和治疗骨感染的又一种简便、安全、可靠、有效的方法,但加替沙星聚癸二酸干缓释制剂的质量及载药量还需进一步研究得出合适的结果,聚癸二酸干在人体内体液较多的环境下及人体体内环境下是否加快释放速度,还需进一步研究,通过调整聚酸酐分子量及载药量,可以到达调整加替沙星-聚癸二酸酐缓释制剂释放的理想程度,还需进一步完善研究。

.jpg)
.jpg)