Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (15): 2452-2460.doi: 10.12307/2024.255
Influence of bone microenvironment on regeneration process of tissue-engineered bone
Zhong Siyang1, Liao Qing1, Zhou Xingyu1, Li Xianying1, Wei Jingjing2, Yang Lin2
- 1Zhuhai Campus, Zunyi Medical University, Zhuhai 519041, Guangdong Province, China; 2Department of Human Anatomy, Zhuhai Campus, Zunyi Medical University, Zhuhai 519041, Guangdong Province, China
-
Received:2023-02-20Accepted:2023-03-25Online:2024-05-28Published:2023-09-23 -
Contact:Yang Lin, PhD, Associate professor, Department of Human Anatomy, Zhuhai Campus, Zunyi Medical University, Zhuhai 519041, Guangdong Province, China -
About author:Zhong Siyang, Zhuhai Campus, Zunyi Medical University, Zhuhai 519041, Guangdong Province, China Liao Qing, Zhuhai Campus, Zunyi Medical University, Zhuhai 519041, Guangdong Province, China -
Supported by:National Natural Science Foundation of China, No. 82260456, 81960419 (to YL); National-Level Training Program for Students’ Innovation and Entrepreneurship of Zunyi Medical University in 2022, No. 202210661029 (to ZXY); Provincial-Level Training Program for Students’ Innovation and Entrepreneurship of Zunyi Medical University in 2022, No. S202210661043X (to LXY); University-Level Training Program for Students’ Innovation and Entrepreneurship of Zunyi Medical University in 2022, No. ZXCH2022003; Postgraduate Education Innovation Program Project of Zunyi Medical University, No. ZYK89 (to WJJ)
CLC Number:
Cite this article
Zhong Siyang, Liao Qing, Zhou Xingyu, Li Xianying, Wei Jingjing, Yang Lin. Influence of bone microenvironment on regeneration process of tissue-engineered bone[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(15): 2452-2460.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
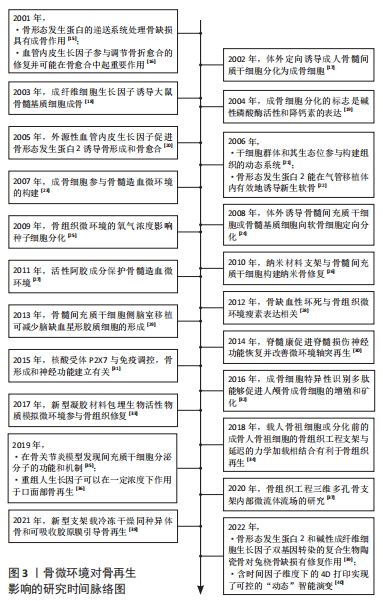
骨再生是一个涉及复杂分子机制的多因素过程,是细胞因子、激素、神经肽、种子细胞调节和环境因子之间的复杂相互作用。在骨组织的研究过程中,研究方向逐渐从单一性的生物类活性物质对骨缺损修复的作用过渡到多种细胞因子组合或共同使用细胞因子和种子细胞对骨缺损修复的作用。此外,研究者还成功在体外通过活体组织提取或人工合成的生物活性物质诱导种子细胞生殖分化为成骨细胞。随着骨缺损修复分子信号通路的研究进一步加深,研究者们逐渐认识到骨组织修复特别是大段骨缺损修复需要构建血管化进行营养物质和代谢废物的运输。然而,神经化的构建也会刺激血管的生成和成骨细胞的增殖和分化。而随着新兴材料和技术在再生医学上的应用,研究人员发现承载多种生物活性物质的仿生支架可促进骨组织的再生和神经化,但多种子细胞或生物分子的简单混合递送容易导致骨组织工程的不可控结果。因此,多因子差异性呈递系统、神经血管耦合、神经与骨再生的双向调控作用、基因转导技术、4D生物打印技术以及愈合微环境的差异是目前研究的新方向[15-40],见图3。"
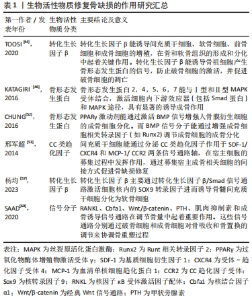
2.1 生物活性物质与骨缺损修复 骨缺损修复是一个分为多个阶段的连续过程,这些阶段相互重叠,由多种细胞因子介导,同一种细胞因子在一个或多个愈合阶段可以产生相互协同或拮抗的作用。在骨愈合过程中,细胞因子形成一个复杂而有序的网络。细胞因子既是骨组织微环境的组成部分,也是骨组织修复和保持骨组织微环境稳态的调节剂,对于骨再生起着核心的调控作用。骨组织重建修复在各个阶段均需要借助精细的调控来完成成骨过程,在此过程当中需要多种化学信号分子参与信息调控,这些化学信号分子包括全身激素如甲状旁腺激素、糖皮质激素和性激素等对骨形成均有影响。近年来,骨组织局部生长调节因子对骨组织的修复机制成为研究热点[41-42]。 2.1.1 生长因子 是一类可以诱导多能细胞增殖和分化的细胞因子,是信息传导过程中的重要介质,在调整相关蛋白质表达方面发挥重要作用。目前认为与骨再生有关的生长因子主要包括血小板衍生生长因子、血管内皮生长因子、成纤维细胞生长因子、骨形态发生蛋白、转化生长因子β、胰岛素样生长因子和血小板衍生生长因子BB等。 生长因子会对信号分子的协同参与和信息表达产生一定的影响,它们在组织再生以及调整相关蛋白表达等方面发挥重要的调节作用[43]。例如,转化生长因子β参与控制骨组织的稳态和重塑,被认为是最主要的骨重塑介质之一[44]。目前受到广泛关注的细胞因子骨形态发生蛋白是转化生长因子β超家族的成员之一,具有诱导成骨细胞分化的能力[45]。骨形态发生蛋白2,4,5,6,7能与Ⅰ型和Ⅱ型丝氨酸-苏氨酸激酶受体结合,激活细胞内信号传导蛋白(Smad)和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)途径,具有显著的诱导成骨作用[46]。骨形态发生蛋白2能够诱导骨髓间充质干细胞向成骨细胞分化,而骨形态发生蛋白7可以直接促进血管生成[47]。此外,血管内皮生长因子也是一个已经被广泛研究的关键生长因子,它可以介导血管的形成,并在血管生成和骨重塑中发挥调节作用[48-49]。此外,其他生长因子在调节骨组织平衡方面也发挥着至关重要的作用[50]。 2.1.2 种子细胞 是组织工程骨微环境的重要组成部分。种子细胞是一种可分化为多种骨组织细胞的干细胞,其可通过分泌多种细胞因子、骨基质参与骨组织细胞的免疫应答、刺激造血及促进骨组织细胞增殖分化等多种生理活动。因此,种子细胞常被植入组织工程材料中以提高该材料的生物活性及成骨效果。目前应用较为广泛的骨组织工程的种子细胞有成骨细胞、软骨细胞、骨髓间充质干细胞、脂肪干细胞、胚胎干细胞、诱导多能干细胞和经血源子宫内膜干细胞等[51]。 种子细胞通过分泌细胞生长因子从而参与一系列成骨信号的信息调控过程。骨膜来源干细胞是骨组织工程领域中使用频率较高的种子细胞,其能同时释放可以控制细胞增殖及分裂的成纤维细胞生长因子2和诱导骨外膜细胞向软骨分化的骨形态发生蛋白2 [52],该种子细胞具有成骨、成软骨及成脂分化的潜能,是构建具备高度生物活性的组织工程骨重要的活性物质来源。然而,骨缺损发生后人体会释放大量趋化因子和致炎因子,这些因子通过诱导机体内的成骨前体细胞向损伤部位迁移从而进行组织修复。有研究发现间充质干细胞能通过分泌CC类趋化因子(CC motif chemokine,CC)作用于基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1)/ 受体-趋化因子受体4(C-X-C motif chemokine receptor 4,CXCR4)和血清单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)/ CC趋化因子受体2(recombinant chemokine C-C-motif Receptor 2,CCR2)两条信号通路轴,在宿主细胞的募集过程中发挥作用,通过募集宿主成骨相关细胞的间接方式促进骨缺损修复[53]。此外,基质细胞衍生因子、骨形态发生蛋白、胰岛素样生长因子和转化生长因子β等多种相关细胞因子能通过Smad、磷脂酰肌醇3-激酶(PI3K,phosphatidylinositol 3 kinase)-akt (protein kinaseB,AKT)依赖性和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)/细胞外调节蛋白激酶(extracellular signal regulated kinases,ERK)等信号通路相互调节形成一个系统化的复杂信息传递网络,共同调控骨组织细胞的增殖分化。 种子细胞还可分泌骨基质,并与骨基质一同构建缺损部位的微环境。种子细胞的微环境主要包括骨组织种子的细胞外基质、细胞间相互作用所需的生物化学因子、局部血液循环网络以及周围的神经组织。目前,骨损伤修复领域使用频率较高的种子细胞为成骨细胞,其分泌的骨基质能作为细胞和细胞、细胞和细胞质之间信号传导的桥梁[54]。骨基质中富含多种蛋白质,还包括如生长因子、蛋白多糖及微基质蛋白等特殊蛋白,它们共同构成骨组织细胞微环境的网络结构,这些结构物质能共同调节骨基质内相应的温度及酸碱度等理化性质从而为细胞生长或是相关蛋白质的信息表达提供适应性的微环境[55]。细胞外基质含有Ⅰ,Ⅲ,Ⅳ,Ⅴ,Ⅶ等各型胶原,这些结构基础对于细胞中基因表达的方式如细胞的支撑、黏附及移行等行为都有重要的调控作用。 此外,种子细胞的增殖分化也受到细胞因子的调控。种子细胞具有多向分化能力,可被诱导分化为纤维软骨细胞等多种骨组织功能细胞。骨髓间充质干细胞具有良好的软骨分化潜能,因而常被选为组织工程中的种子细胞[56]。杨均等[57]发现转化生长因子β中的转化生长因子β1,β3两种亚型的细胞因子具有诱导骨髓间充质干细胞向透明软骨细胞分化和向纤维软骨细胞分化的能力。 因此,不难发现在上述的种子细胞参与构建微环境机制中,种子细胞通过分泌细胞因子和细胞基质参与骨组织微环境的构建,其自身的增殖分化也受到多种生长因子的影响,这些微环境成分的相互作用是构建有机成骨调控体系的基础。 2.1.3 人工合成型生长因子物质 骨缺损部位的骨再生和重塑需要依赖微环境中一系列的生物化学信号分子的调节,如细胞生长因子和种子细胞等。信号通路的中断会影响种子细胞的分化从而减弱骨修复重建效果。由人工设计并合成且来源于生长因子的多肽可作为生长因子的替代物,为骨组织细胞创造良好的生物活性微环境[58]。 细胞因子是由某些骨组织细胞或是非骨组织细胞受到刺激而合成并分泌的小分子多肽。已有研究表明,人工合成的短链多肽在多种化学分子参与的信号传导通路上能充分暴露活性位点并与细胞表面受体结合。细胞因子是信号传导通路中的衔接蛋白,含有各种能与其他蛋白多肽结合的结构域,并通过特异性的蛋白质-蛋白质相互作用形成复合体激活下游的信号通路。因而人工合成具有特定功能的多肽蛋白不仅能有效避免其作用于蛋白中多种多肽作用的非受体靶点,还可以通过化学修饰调节多肽结构以提高其在复合过程的稳定性。人工设计的蛋白多肽作用专一、生物活性更强且易于大规模合成[59],因此,人工合成型生长因子物质具有与细胞因子相似的作用特性,能近距离调控骨组织细胞兴奋从而参与构建骨组织微环境。 目前,使用人工合成的生物化学活性物质替代诱导骨组织干细胞生长分化的生长因子的研究已经取得了一定进展。相关研究发现,Wnt信号通路是目前骨缺损修复研究领域的热点,这一通路上的相关调控因子机制在调节骨分化和骨组织代谢的过程中发挥重要的作用[60]。吴穹[61]设计了5段抑制因子(Dickkopf-1,DKK1)的功能多肽并对其进行了体内及体外实验,实验结果证实,部分DKK1多肽可以作为胞外信号因子发挥Wnt蛋白的作用,与细胞膜受体(low density lipoprotein receptor-related proteins 5/6,LRP5/6)相结合,通过抑制小鼠成肌细胞C2C12和小鼠胚胎成骨细胞前体细胞MC3T3-E1细胞中碱性磷酸酶的活性进而影响成骨相关靶基因的转录和表达,进而促进了骨的形成,这项研究证实了人工合成的多肽具有与Wnt信号通路中负向调节因子的相同调节功能。 生物活性物质在骨组织工程领域应用的挑战主要包括其不稳定性、易失活、半衰期短、代谢快以及在局部制剂中迅速失活,这就需要对生物活性物质的持续释放系统(包括剂量、比例、递送时间及空间分布等)进行进一步的科学研究。生物活性物质的控释系统将能够防止其在局部的快速释放,并为缺损部位提供缓慢和稳定的输送。此外,开发具有特定部位释放特性的改进型控释给药系统以提高生物活性物质的生物利用率有较高的研究价值,可以通过利用各种天然或合成聚合物材料的特殊性能或通过开发具有特殊性能的新型纳米聚合物来实现。生物活性物质修复骨缺损的作用研究见表1。"
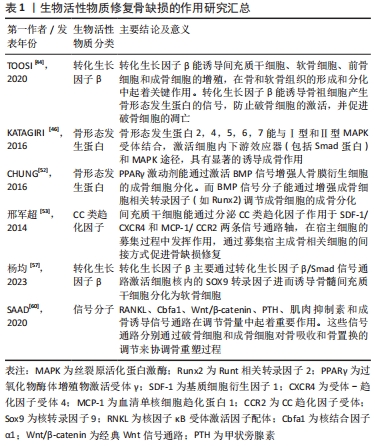
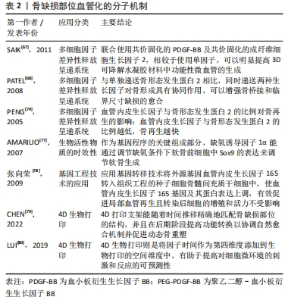
2.2 骨缺损与血管化 骨组织是一个高度血管化的组织。在应用组织工程骨治疗骨缺损时,及时和丰富的血管再生是保证骨缺损修复和组织工程骨存活的基础,血运重建的效果决定了植入组织工程骨后骨缺损部位骨再生和骨端融合的速度和效果[62]。在骨损伤后的修复过程中,新生血管再生是启动骨修复的关键。新生血管不仅为骨修复提供了必须的营养物质、成骨细胞和生长因子,同时更是修复细胞进入损伤区的通道。尤其对于大面积骨缺损,如果缺损部位附近没有完整血管,血管内的循环干细胞就无法通过趋化作用迁移到缺陷中,导致缺损部位的成骨不足及组织工程骨的整合失败[63]。为了解决此问题,CHEN等[64]通过使用内皮细胞和间充质干细胞封装的生物墨水,成功地在三维结构中构建了致密的微血管系统。他们遵循血管生成早于成骨的原则,在构建血管系统后添加成骨细胞,能有效改善骨缺损患者的类骨质沉积及骨体积分数,并形成血管的吻合[65]。GRELLIER等[66]研究表明,缺氧环境下大面积骨缺损部位中心的缺血,导致组织工程骨中的单纯骨髓间充质干细胞不能被诱导分化为成骨细胞,因此早期血管化对骨缺损修复至关重要。 2.2.1 多细胞因子差异性释放呈递系统 在骨的自然骨愈合过程中,血管生成几乎贯穿于愈合的全过程。血管化的建立对提供营养物质和因子以支持骨修复相关细胞的生物过程具有重要意义。而血管生成因子对血管的生成具有调节作用,研究人员必须根据相关因子的不同种类、不同剂量、不同作用时间等状态模式进行因子的递送。血管内皮生长因子具有刺激血管内皮细胞的增殖和迁移的能力,但同时其对周细胞(如血管平滑肌细胞)的生物功能有抑制作用,血管内皮生长因子的持续表达可能导致血管不稳定以及渗漏[62]。尽管血管内皮生长因子具有良好的成骨及成血管功能,但是单独递送血管内皮生长因子并不能实现很好的成骨效果,因此在构建骨组织血管生成的进程上往往需要多重因子的共同作用。SAIK等[67]发现联合使用共价固化的血小板衍生生长因子BB及共价固化的成纤维细胞生长因子2,相较于使用单因子,可以明显提高水凝胶材料中内皮细胞的迁移程度及功能性微血管的生成。PATEL等[68]发现同时递送双细胞因子骨形态发生蛋白与血管内皮生长因子时,5/8的大鼠在12周内骨缺损完全愈合,单独使用骨形态发生蛋白2只有3/8的大鼠存在骨愈合效果。尽管细胞因子骨形态发生蛋白2具有良好的成骨特性,但因其在体内的弥散及降解速度较快,降低了其在缺损部位的局部浓度和治疗效果。然而,单独使用血管内皮生长因子时并没有出现骨缺损的愈合,这表明共同释放双因子对于骨愈合的作用明显强于单因子的递送效果。 此外,研究人员发现,在骨愈合的早期阶段血管内皮生长因子基因的表达较成骨因子骨形态发生蛋白2的表达高峰要早,因此在双细胞因子递送中选择优先递送血管内皮生长因子能获得更好的血管生成以及成骨效果[69-70]。然而,YOUNG等[71]研究发现当设置双因子血管内皮生长因子/ 骨形态发生蛋白2的比率大于1时,同时递送血管内皮生长因子和骨形态发生蛋白2在12周时的骨组织愈合效果不如单独递送骨形态发生蛋白2,这说明在建立血管化时不但要探究不同生长因子之间的相互作用问题,还要注意双重输送或多重输送对骨再生的剂量效应,任何一种因子释放的量不足或是比例选择不当都会干扰体内正常骨的形成[72-75]。由于体内血管生成和血管稳定需要多种生长因子之间的精确协调,以刺激所需的细胞反应。目前研究焦点较少集中于对生长因子剂量效应的确定,但对不同剂量的进一步研究有助于阐明生物活性物质的作用机制。因此,未来进一步的研究应集中于评估对血管和骨形成的剂量依赖性影响。 2.2.2 生物活性物质的时效性 除了血管诱导因子的释放种类和剂量外,血管诱导因子的时效性也至关重要。在骨组织活性支架融合进入机体的初期,促血管生成因子还未发挥诱导种子细胞发生增殖分化形成血管,使得执行运输氧气功能的血红蛋白无法到达缺损部位,从而导致骨组织支架还处于缺氧状态,影响造血干细胞和神经干细胞的增殖分化[76]。AMARILIO等[77]发现在低氧条件下,敲除肢芽间充质中灭活转录因子缺氧诱导因子1α (hypoxia-inducible factor 1α,HIF-1α)后调控小鼠软骨细胞分化的关键调节因子(SRY-related HMG box gene 9,Sox9)表达降低,软骨形成显著减少。这些实验结果说明了干细胞在不同生长阶段内会因为骨组织微环境的含氧量不同而产生不同的表达结果,进而影响骨组织活性支架对骨缺损的修复效果。 2.2.3 基因工程技术的应用 随着近年来组织工程和基因工程的研究进展,将血管内皮生长因子编码基因导入细胞的基因修饰成为重建血循环最具研究前景的治疗模式之一。目前有研究发现应用基因转移技术对种子细胞进行修饰能有效提高目的蛋白的表达。张向荣[78]将外源基因血管内皮生长因子165脂质体以介导方式转入组织工程的种子细胞骨髓间充质干细胞中,移植转染后的骨髓间充质干细胞可使血管内皮生长因子165基因及其蛋白表达上调,有效促进局部血管再生。此外,研究人员通过MTT法对转染后的骨髓间充质干细胞进行测定发现种子细胞骨髓间充质干细胞的增殖和活力不受影响。然而,尽管通过血管内皮生长因子基因转染骨髓间充质干细胞能提高血管内皮生长因子的表达,但其应用于其他种子细胞上时仍存在影响种子细胞的繁殖分化能力及传代能力,导致种子细胞本身发挥的作用降低的可能。 2.2.4 4D生物打印技术的应用 在组织愈合过程中,细胞微环境的动态和广泛重塑通过不断向细胞施加细胞内及细胞外收缩力,进一步触发基因表达和细胞行为的变化,其依赖时间的转换应该是可预测并且是可编程的。理想的组织工程支架应该能够响应这种动态变化,以实现微环境变化与人体的整合。 4D生物打印是近年来的研究热点之一。目前应用最为广泛的的生物打印是在三维空间中生成排列细胞和生物分子的结构[79]。而4D生物打印则是将因子时间作为第四维度添加到生物打印的空间维度中。而生物打印物体因细胞-细胞融合的结构特性或受到特定的外界刺激,可能会改变其功能或形状[80]。例如,打印成平面结构的生物打印材料在接种细胞后经特定的刺激可卷曲或折叠成三维形状。触发形状变化的刺激可以是特定的pH值、电场、磁性、光照、添加化学催化剂或类似刺激的组合[81]。4D生物打印可改变生物打印结构形状的特性可以有效克服常规3D打印的局限性。文章总结了骨缺损部位血管化的机制,见表2。"

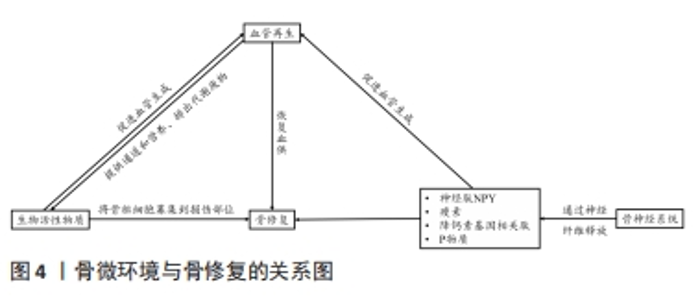
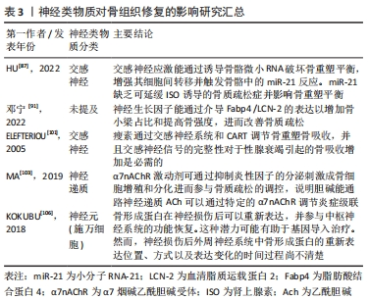
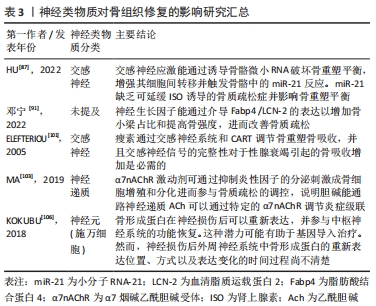
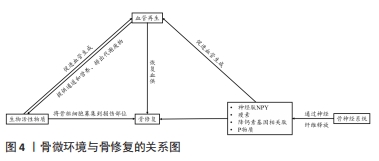
2.3 神经化与骨再生 骨组织是神经系统重要的靶器官,神经元可整合机体内外环境因素从而对骨的正常代谢以及骨的愈合重建进行调控[82]。近年来大量的研究证明骨的再生与重建不仅受全身激素水平与局部细胞因子的调控,还受到神经系统的调控[83]。机体骨折后,生长因子和细胞因子将骨祖细胞募集到缺损部位。随着骨骼重塑,血管生成允许血管网络侵入损伤部位以恢复正常循环,以替换坏死的骨组织,神经纤维及其分泌的物质(包括信号蛋白、神经营养素及神经肽等)与血管再生密切相关。神经再支配发生在血运重建之前,有助于血管再生。 骨组织内部的大多数交感神经和感觉神经多与血管伴行,广泛分布于骨髓腔、骨膜、骨髓及骨小梁中[84]。有国内外的相关研究发现,神经长入与骨生长发育过程中存在时间上重叠的特点[85-86]。感觉神经和交感神经在正常骨骼代谢和骨缺损修复中发挥重要的调节作用[87-88]。在切除交感神经的动物模型中,出现骨吸收增加、骨沉积和矿化减少的现象,导致骨缺损修复效果较差[89-90]。此外,在关节炎小鼠动物模型中,切除交感神经还可能导致软骨下骨增厚[91-92]。 2.3.1 神经肽类物质的作用 骨组织中的神经纤维主要为肽能神经,其主要由分泌降钙素基因相关肽(calcitonin gene-related peptide,CGRP)的感觉神经和分泌血管活性肠肽(vasoactive intestinal peptide,VIP)神经肽Y (neuropeptide tyrosine,NPY)的自主神经构成。神经肽类物质是由神经系统释放并发挥其对骨生物学效应的关键性物质,包括细胞因子、神经营养因子、神经递质以及各种激素。神经肽类物质能与相关受体结合并作用于特定的信号通路,通过多种途径影响骨愈合、骨再生及成骨与破骨之间的平衡。其中降钙素基因相关肽CGRP是一种重要的神经递质,同时也是强效血管活性物质的一种,其可以通过与炎性因子的相互作用以增强血管通透性及促进血管扩张,从而调节血管中的血流变化[93-94]。此外,感觉神经分泌的神经肽对于建立血管化也发挥重要的调节功能。姚旺祥等[95]将感觉神经植入组织工程骨以评估其对大段骨缺损的修复效果时发现组织工程骨中神经肽CGRP、NPY、P物质(substance P,SP)及其受体CGRP1R,NPY1R,MK1水平上调。这些结果说明感觉神经可通过分泌神经肽类物质如SP促进骨髓间充质干细胞的成骨分化和成血管分化,进而促进骨形成。 2.3.2 神经生长因子对血管及骨再生的调控 神经生长因子可以引导血管生长,比较经典的轴突导向因子包括信号素3A(Semaphorin 3A,Sema3)、神经轴突导向因子(Netrins)、磷酸化神经细胞鸟苷酸置换因子(Epherins)等[96-97]。大量文献证实,这些因子结合相应受体后,可以引导血管长入[98]。在胚胎发育期间,神经生长因子/酪氨酸激酶受体A(NGF/TrkA)信号通过诱导感觉神经支配促进血管化[99],而神经生长因子可能引起内皮细胞增殖和炎症。 此外,在建立组织工程骨神经化的进程中,神经生长因子多肽具有指导骨组织细胞生长增殖和分化的功能。姚洋等[100]研究发现体内局部注射神经生长因子能加速小鼠腿骨内钛种植体新生骨胶原的早期成熟,并且促进局部神经元中降钙素基因相关肽(CCRP)的生成和神经元存活。近年来,有研究发现交感神经和感觉神经通过参与多种信号途径对骨组织细胞进行调控,如交感神经信号、乙酰胆碱类信号及激素类等信号。肾上腺素能信号可以通过突触后的肾上腺素能受体(adrenergic receptor,AR)增加成骨细胞核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,Rankl)的表达从而间接刺激破骨细胞的分化[101]。而甲状旁腺素可以作用于细胞因子受体骨保护素 [102],可在破骨细胞发育的后期抑制其形成,能作为激动剂上调成骨细胞中Rankl的表达,从而促进破骨细胞的骨吸收作用。MA等[103]发现交感神经系统能通过增加骨组织中的破骨细胞分化因子Rankl的表达来促进骨吸收。JIAO等[104]在对骨性关节炎动物模型的研究中,发现骨软骨交接区交感神经分支能释放去甲肾上腺素(norepinephrine,NE)信号,并作用于软骨下间充质干细胞上的β2肾上腺素能受体(β2-adrenergic receptors,β2-AR)以及软骨细胞上的α2肾上腺素能受体(α2-adrenergic receptors,α2-AR),进一步通过参与相关的信号传导通路促进骨修复。 2.3.3 骨组织微环境与神经调节的双向调控作用 在神经化组织工程骨的构建过程中,骨组织微环境变化与神经调控的作用是双向的,因此在关注外周神经对骨调控作用的同时还需关注骨组织微环境对外周神经的调控作用,主要体现在骨组织对外周神经功能的调控上。有研究发现,在异位骨化的疾病过程中骨基质会释放骨形态发生蛋白,此过程会改变神经细胞膜的通透性,使得周围神经的血神经屏障开放,导致成骨祖细胞离开神经并迁移到骨化位点,从而发挥对神经的调控作用[105]。KOKUBU等[106]通过体外实验发现骨形态发生蛋白7的应用可以诱导神经膜细胞显著增生并提高其体外生存率,而应用甲状旁腺激素[parathyroidhormone,PTH(1-34)]可上调神经膜细胞骨形态发生蛋白7的水平,由此证明,损伤的周围神经损伤可引起去分化的神经膜细胞内骨形态发生蛋白/细胞内信号传导蛋白(BMP/Smad)信号通路的分子水平上调,以此调控神经的再生。此机制是通过调节机体内相关生物分子的表达来改变神经细胞膜的生理特性进而控制神经再生。这种通过机体回馈调节机制建立神经化的方向目前鲜有研究,这可以未来重建神经化的组织工程骨提供一个新的研究思路。 在骨骼发育和再生过程中,神经和血管向内生长在空间上是相互协调的,在功能上是相互依存的,实现神经血管耦合有助于改善骨骼重塑和代谢。神经血管耦合的机制是复杂的,各种生物活性物质及信号分子通道共同参与神经血管耦合。生物活性物质-血管-神经互相调控作用见图4。"
| [1] XU SF, YU XC, XU M, et al. Successful management of a childhood osteosarcoma with epiphysiolysis and distraction osteogenesis. Curr Oncol. 2014;21(4):e658-e662. [2] RAPOSO-AMARAL CE, BUENO DF, ALEMIDA AB, et al. Is bone transplantation the gold standard for repair of alveolar bone defects? J Tissue Eng. 2014;5: 2041731413519352. [3] GOODAM SB, PAJARINEN J, Yao Z, et al. Inflammation and bone repair: from particle disease to tissue regeneration. Front Bioeng Biotechnol. 2019;7:230. [4] HANKENSO KD, GAGNE K, SHAUGHNESSY M. Extracellular signaling molecules to promote fracture healing and bone regeneration. Adv Drug Deliv Rev. 2015;94:3-12. [5] SCADDEN DT. The stem-cell niche as an entity of action. Nature. 2006;441 (7097):1075-1079. [6] DE JONG MME, KELLERMAYER Z, PAPAZIAN N, et al. The multiple myeloma microenvironment is defined by an inflammatory stromal cell landscape. Nat Immunol. 2021;22(6):769-780. [7] 夏玉城,陶树清.低氧诱导因子和脯氨酸羟化酶在骨发育和骨稳态中的作用[J].实用骨科杂志,2020,26(4):339-342. [8] 谢玉,周诺.Ⅰ型胶原诱导骨髓间充质干细胞及成骨细胞的成骨分化机制[J].中国组织工程研究,2018,22(21):3417-3423. [9] MANCUSO P, RAMAN S, GLYNN A, et al. Mesenchymal stem cell therapy for osteoarthritis: the critical role of the cell secretome. Front Bioeng Biotechnol. 2019;7:9. [10] 许克惠,李娇娇,李香玉,等.光固化3D打印软组织材料的性能研究进展[J].中国生物医学工程学报,2019,38(5):628-635. [11] LAPNER P, BOULIANE M, POLLOCK JW, et al. Intraoperative channeling in arthroscopic rotator cuff repair: a multicenter randomized controlled trial. Am J Sports Med. 2023;51(2):323-330. [12] NAKANO K, MURATA K, OMOKAWA S, et al. Promotion of osteogenesis and angiogenesis in vascularized tissue-engineered bone using osteogenic matrix cell sheets. Plast Reconstr Surg. 2016;137(5):1476-1484. [13] CASANOVA MR, OLIVEIRA C, FERNANDES EM, et al. Spatial immobilization of endogenous growth factors to control vascularization in bone tissue engineering. Biomater Sci. 2020;8(9):2577-2589. [14] GREENHILL C. Bone. Formation of blood vessels in bone maturation and regeneration. Nat Rev Endocrinol. 2014;10(5):250. [15] FERRETTI C, RIPAMONTI U. Human segmental mandibular defects treated with naturally derived bone morphogenetic proteins. J Craniofac Surg 2002;13(3):434-444. [16] 武永刚,陈君长,王坤正.血管内皮细胞生长因子在骨折愈合过程中的表达[J].西安医科大学学报,2001,22(1):51-53, 61. [17] 张丽蓉,夏文杰,项鹏,等.体外定向诱导人骨髓间质干细胞分化为成骨细胞的研究[J].中国病理生理杂志,2002,18(7):745-748. [18] 丁生乐,孙正义.成纤维细胞生长因子对大鼠骨髓基质细胞诱导成骨的影响[J].第四军医大学学报,2003,24(2):119-122. [19] 彭磊,万明习,梁芳慧,等.骨髓成骨细胞在碱热处理的磷灰石涂层钛表面的分化增殖研究(英文)[J].稀有金属材料与工程,2004,33(10): 1018-1022. [20] 钟刚,裴福兴,樊瑜波,等.血管内皮生长因子基因转染促进成骨细胞的成骨活性(英文)[J].中国临床康复,2005,9(22):250-252. [21] 黄晓兵,刘霆,孟文彤,等.骨髓间充质干细胞分化的成骨细胞支持脐血造血干祖细胞的研究[J].中国实验血液学杂志,2006,14(3):552-556. [22] 刘勇,李小飞,程庆书,等.异体移植气管中骨形态发生蛋白诱导软骨再生的实验[J].中国临床康复,2006,10(1):91-93. [23] 智伟,邓力,杨志明,等.成骨细胞参与骨髓造血微环境的构建及发挥调控作用[J].中国修复重建外科杂志,2007,21(5):517-522. [24] ZHENG ZH, ZHU P, WANG YH, et al. In vitro induction of directional differentiation of bone marrow mesenchymal stem cells towards chondrocytes. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 2005;21(1):79-82. [25] 李宁,吴桂英,李启明,等.不同氧浓度微环境对大鼠骨髓间充质干细胞成骨及成脂肪分化的影响[J].重庆医学,2009,38(19):2448-2450. [26] 穆晓红,赵子义,徐林,等.纳米材料支架与骨髓间充质干细胞构建纳米骨修复兔股骨头坏死[J].中国组织工程研究与临床康复,2010,14(51): 9582-9586. [27] 邓皖利,吴宏忠,徐文,等.阿胶补血活性组分对环磷酰胺所致贫血小鼠骨髓造血微环境的影响[J].时珍国医国药,2011,22(10):2542-2544. [28] 刘铁,苏庆军,藏磊,等.股骨头缺血性坏死与局部微环境瘦素表达的相关性研究[J].中国修复重建外科杂志,2012,26(11):1319-1323. [29] 陈玉玺,王晓莉,牟青杰,等.骨髓间充质干细胞对脑缺血大鼠星形胶质细胞影响的实验研究[J].医学研究生学报,2013,26(6):564-567. [30] 潘娅岚,马勇,郭杨,等.脊髓康对脊髓损伤大鼠脊髓组织结构及神经生长因子表达的影响[J].中国实验方剂学杂志,2014,20(15):144-149. [31] 习德娥,韩莉,谭超,等.P2X7受体与基因转录的关系[J].中国免疫学杂志,2015,31(9):1294-1296. [32] 钱海燕,陈慧敏,杜明亮,等.成骨细胞特异性识别多肽对人成骨细胞增殖和矿化影响的实验研究[J].安徽医科大学学报,2016,51(3):337-340. [33] 蒋欣泉.骨缺损修复生物材料与骨再生[J].中华口腔医学杂志,2017, 52(10):600-604. [34] HAUSHERR TC, NUSS K, THEIN E, et al. Effect of temporal onsets of mechanical loading on bone formation inside a tissue engineering scaffold combined with cell therapy. Bone Rep. 2018;8:173-179. [35] 刘国民,卢天成,冀璇,等.与胶原特异性结合的BMP2模拟肽/PLGA3D打印复合支架的制备及成骨诱导活性[J].高等学校化学学报, 2019,40(7):1552-1560. [36] LI F, Yu F, Liao X, et al. Efficacy of recombinant human BMP2 and PDGF-BB in orofacial bone regeneration: a systematic review and meta-analysis. Sci Rep. 2019;9(1):8073. [37] 赵士明,李文雷,赵静一,等.组织工程三维多孔骨支架内部微流体流场研究[J].高技术通讯,2020,30(5):518-525. [38] DOWLATSHAHI S, CHEN CY, ZIGDON-GILADI H, et al. Volumetric assessment of changes in the alveolar ridge dimension following guided bone regeneration using a combination freeze-dried bone allograft with collagen membrane or novel resorbable scaffold: a prospective two-center clinical trial. J Periodontol. 2022;93(3):343-353. [39] 王伟伟,欧志学,章晓云,等.外泌体在激素性股骨头坏死修复信号交流网络中的调控机制[J].中国组织工程研究,2022,26(19):3056-3064 [40] 冯韬,孟正华,郭巍.4D打印智能材料及产品应用研究进展[J].数字印刷,2022,218(3):1-16. [41] DELUCCHI Á, TORO L, ALZAMORA R, et al. Glucocorticoids decrease longitudinal bone growth in pediatric kidney transplant recipients by stimulating the FGF23/FGFR3 signaling pathway. J Bone Miner Res. 2019;34(10):1851-1861. [42] LI D, ZHAO D, ZENG Z, et al. Ternary regulation mechanism of Rhizoma drynariae total flavonoids on induced membrane formation and bone remodeling in Masquelet technique. PLoS One. 2022;17(12):e0278688. [43] SOBUE T, GRAVELY T, HAND A, et al. Regulation of fibroblast growth factor 2 and fibroblast growth factor receptors by transforming growth factor beta in human osteoblastic MG-63 cells. J Bone Miner Res. 2002;17(3):502-512. [44] TOOSI S, BEHRAVAN J. Osteogenesis and bone remodeling: a focus on growth factors and bioactive peptides. Biofactors. 2020;46(3):326-340. [45] 彭竑程,华臻,杨惠林,等.肌源性因子调控骨组织细胞的作用机制研究进展[J].中国修复重建外科杂志,2021,35(7):923-929. [46] KATAGIRI T, WATABE T. Bone morphogenetic proteins. Cold Spring Harb Perspect Biol. 2016;8(6):a021899. [47] EINHORN TA, GERSTENFELD LC. Fracture healing: mechanisms and interventions. Nat Rev Rheumatol. 2015;11(1):45-54. [48] HU K, OLSEN BR. Osteoblast-derived VEGF regulates osteoblast differentiation and bone formation during bone repair. J Clin Invest. 2016; 126(2):509-526. [49] HU K, OLSEN BR. The roles of vascular endothelial growth factor in bone repair and regeneration. Bone. 2016;91:30-38. [50] SIDDIQUI JA, PARTRIDGE NC. Physiological bone remodeling: systemic regulation and growth factor involvement. Physiology (Bethesda). 2016; 31(3):233-245. [51] 何爱娟,张天宇.软骨组织工程种子细胞的研究进展[J].中国眼耳鼻喉科杂志,2020,20(1):3-6. [52] CHUNG JE, PARK JH, YUN JW, et al. Cultured human periosteum-derived cells can differentiate into osteoblasts in a perioxisome proliferator-activated receptor gamma-mediated fashion via bone morphogenetic protein signaling. Int J Med Sci. 2016;13(11):806-818. [53] 邢军超.间充质干细胞在组织工程骨修复骨缺损起始环节中的作用机理研究[D].重庆:第三军医大学,2014. [54] LIN X, PATIL S, GAO YG, et al. The bone extracellular matrix in bone formation and regeneration. Front Pharmacol. 2020;11:757. [55] 胡文成,朱弘一,林俊卿,等.细胞周基质介导骨关节炎发生发展的研究进展[J].上海交通大学学报(医学版),2021,41(8):1089. [56] ZHOU Z, LIU D. Mesenchymal stem cell-seeded porous tantalum-based biomaterial: a promising choice for promoting bone regeneration. Colloids Surf B Biointerfaces. 2022;215:112491. [57] 杨均,李澎.转化生长因子β诱导骨髓间充质干细胞分化为半月板纤维软骨细胞[J].中国组织工程研究,2023,27(15):2412-2419. [58] HO-SHUI-LING A, Bolander J, Rustom LE, et al. Bone regeneration strategies: engineered scaffolds, bioactive molecules and stem cells current stage and future perspectives. Biomaterials. 2018;180:143-162. [59] SAITO A, SUZUKI Y, OGATA S, et al. Prolonged ectopic calcification induced by BMP-2-derived synthetic peptide. J Biomed Mater Res A. 2004;70(1): 115-121. [60] SAAD FA. Novel insights into the complex architecture of osteoporosis molecular genetics. Ann N Y Acad Sci. 2020;1462(1):37-52. [61] 吴穹. DKK1合成多肽对治疗骨质疏松症和成骨作用的研究[D].南京:南京大学,2011. [62] SARAN U, GEMINI PIPERNI S, CHATTERJEE S. Role of angiogenesis in bone repair. Arch Biochem Biophys. 2014;561:109-117. [63] HATTORI K, HEISSIG B, TASHIRO K, et al. Plasma elevation of stromal cell-derived factor-1 induces mobilization of mature and immature hematopoietic progenitor and stem cells. Blood. 2001;97(11):3354-3360. [64] CHEN YC, LIN RZ, QI H, et al. Functional human vascular network generated in photocrosslinkable gelatin methacrylate hydrogels. Adv Funct Mater. 2012;22(10):2027-2039. [65] CORREIA C, GRAYSON WL, PARK M, et al. In vitro model of vascularized bone: synergizing vascular development and osteogenesis. PLoS One. 2011; 6(12):e28352. [66] GRELLIER M, FERREIRA-TOJAIS N, BOURGET C, et al. Role of vascular endothelial growth factor in the communication between human osteoprogenitors and endothelial cells. J Cell Biochem. 2009;106(3):390-398. [67] SAIK JE, GOULD DJ, WATKINS EM, et al. Covalently immobilized platelet-derived growth factor-BB promotes angiogenesis in biomimetic poly (ethylene glycol) hydrogels. Acta biomaterialia. 2011;7(1):133-143. [68] PATEL ZS, YOUNG S, TABATA Y, et al. Dual delivery of an angiogenic and an osteogenic growth factor for bone regeneration in a critical size defect model. Bone. 2008;43(5):931-940. [69] HATTORI K, HEISSIG B, TASHIRO K, et al. Plasma elevation of stromal cellderived factor-1 induces mobilization of mature and immature hematopoietic progenitor and stem cells. Blood. 2001;97(11):3354-3360. [70] PELTOLA MJ, AITASALO KM, SUONPAA JT, et al. In vivo model for frontal sinus and calvarial bone defect obliteration with bioactive glass S53P4 and hydroxyapatite. J Biomed Mater Res. 2001;58(3):261-269. [71] YOUNG S, PATEL ZS, KRETLOW JD, et al. Dose effect of dual delivery of vascular endothelial growth factor and bone morphogenetic protein-2 on bone regeneration in a rat critical-size defect model. Tissue Eng Part A. 2009;15(9):2347-2362. [72] KAIGLER D, WANG Z, HORGERK, et al. VEGF scaffolds enhance angiogenesis and bone regeneration in irradiated osseous defects. J Bone Miner Res. 2006;21(5):735-744. [73] ECKARDT H, DING M, LIND M, et al. Recombinant human vascular endothelial growth factor enhances bone healing in an experimental nonunion model. J Bone Joint Surg Br. 2005;87(10):1434-1438. [74] PENG H, USAS A, OLSHANSKI A, et al. VEGF improves, whereas sFlt1 inhibits, BMP2-induced bone formation and bone healing through modulation of angiogenesis. J Bone Miner Res. 2005;20(11):2017-2027. [75] 彭荟桢,蔡明详,刘湘宁.骨修复过程中的血管生成调控:新思路与新方法[J].中国组织工程研究,2022,26(15):2400-2405. [76] MOHYELDIN A, GARZON-MUVDI T, QUINONES-HINOJOSA A. Oxygen in stem cell biology: a critical component of the stem cell niche. Cell stem cell. 2010;7(2):150-161. [77] AMARILIO R, VIUKOV SV, SHARIR A, et al. HIF1alpha regulation of Sox9 is necessary to maintain differentiation of hypoxic prechondrogenic cells during early skeletogenesis. Development. 2007;134(21):3917-3928. [78] 张向荣.血管内皮细胞生长因子165基因转染人骨髓间充质干细胞构建组织工程皮肤的实验研究[D].南昌:南昌大学,2009. [79] CHEN X, HAN S, WU W, et al. Harnessing 4D printing bioscaffolds for advanced orthopedics. Small. 2022;18(36):e2106824. [80] LUI YS, SOW WT, TAN LP, et al. 4D printing and stimuli-responsive materials in biomedical aspects. Acta Biomater. 2019;92:19-36. [81] LI YC, ZHANG YS, AKPEK A, et al. 4D bioprinting: the next-generation technology for biofabrication enabled by stimuli-responsive materials. Biofabrication. 2016;9(1):012001. [82] 龙域丰,朱古力,易伟宏,等.神经肽类物质在骨代谢与骨再生中的调控作用[J].中华实验外科杂志,2020,37(11):2131-2136. [83] QIN Q, LEE S, PATEL N, et al. Neurovascular coupling in bone regeneration. Exp Mol Med. 2022;54(11):1844-1849. [84] CRAFT CS, SCHELLER EL. Evolution of the marrow adipose tissue microenvironment. Calcified tissue international. 2017;100(5):461-475. [85] 李俊琴,尹欣雨,张帅帅,等.感觉神经在骨修复中的作用及应用[J].生命科学,2020,32(3):227-232. [86] ZHANG Z, HAO Z, XIAN C, et al. Neuro-bone tissue engineering: multiple potential translational strategies between nerve and bone. Acta Biomaterialia. 2022;153:1-12. [87] HU CH, SUI BD, LIU J, et al. Sympathetic neurostress drives osteoblastic exosomal mir-21 transfer to disrupt bone homeostasis and promote osteopenia. Small Methods. 2022;6(3):e2100763. [88] YANG Y, ZHOU J, LIANG C, et al. Effects of highly selective sensory/motor nerve injury on bone metabolism and bone remodeling in rats. J Musculoskelet Neuronal Interact. 2022;22(4):524-535. [89] HU K, ZHOU H, ZHANG G, et al. The effect of chemical sympathectomy and stress on bone remodeling in adult rats. Neuro Endocrinol Lett. 2010; 31(6):807-813. [90] WANG T, CAO J, DU ZJ, et al. Effects of sympathetic innervation loss on mandibular distraction osteogenesis. J Craniofac Surg. 2012;23(5):1524-1528. [91] 邓宁,胡庆芬,邱宇阳,等. NGF介导Fabp4/LCN-2蛋白对骨质疏松大鼠骨微结构及骨强度的影响[J].中国骨质疏松杂志,2022,28(7):992-997. [92] TOMLINSON RE, LI Z, ZHANG Q, et al. NGF-TrkA signaling by sensory nerves coordinates the vascularization and ossification of developing endochondral bone. Cell Rep. 2016;16(10):2723-2735. [93] ROSCH G, El BAGDADI K, MUSCHTER D, et al. Sympathectomy aggravates subchondral bone changes during osteoarthritis progression in mice without affecting cartilage degeneration or synovial inflammation. Osteoarthritis Cartilage. 2022;30(3):461-474. [94] RADDANT AC, RUSSO AF. Calcitonin gene-related peptide in migraine: intersection of peripheral inflammation and central modulation. Expert Rev Mol Med. 2011;13:e36. [95] CHUNG AM. Calcitonin gene-related peptide (CGRP): role in peripheral nerve regeneration. Rev Neurosci. 2018;29(4):369-376. [96] 姚旺祥,马安,裴国献.神经肽在神经化组织工程骨中表达的早期实验研究[J].浙江创伤外科,2010,15(4):439-443. [97] SEIRADAKE E, JONES EY, KLEIN R. Structural perspectives on axon guidance. Annu Rev Cell Dev Biol. 2016;32:577-608. [98] KIM SK, PAK HN, PARK JH, et al. Cardiac cell therapy with mesenchymal stem cell induces cardiac nerve sprouting, angiogenesis, and reduced connexin43-positive gap junctions, but concomitant electrical pacing increases connexin43-positive gap junctions in canine heart. Cardiol Young. 2010;20(3):308-317. [99] MAPP PI, WALSH DA. Mechanisms and targets of angiogenesis and nerve growth in osteoarthritis. Nat Rev Rheumatol. 2012;8(7):390-398. [100] 姚洋,杜宇,古霞,等.局部注射外源性神经生长因子促进小鼠钛种植体周骨胶原早期成熟的研究[J].华西口腔医学杂志,2018,36(2):128-132. [101] ELEFTERIOU F, AHN JD, TAKEDA S, et al. Leptin regulation of bone resorption by the sympathetic nervous system and CART. Nature. 2005;434(7032): 514-520. [102] YASUDA H. Discovery of the RANKL/RANK/OPG system. J Bone Miner Metab. 2021;39(1):2-11. [103] MA F, LUO X, MA J, et al. The effect of the α7nAChR agonist on Wnt/β-catenin signaling in osteoporosis. Int J Clin Exp Pathol. 2019;12(8):2867-2874. [104] JIAO K, NIU LN, LI QH, et al. β2-Adrenergic signal transduction plays a detrimental role in subchondral bone loss of temporomandibular joint in osteoarthritis. Sci Rep. 2015;5(1):12593. [105] DAVIS EL, DAVIS AR, GUGALA Z, et al. Is heterotopic ossification getting nervous? The role of the peripheral nervous system in heterotopic ossification. Bone. 2018;109:22-27. [106] KOKUBU N, TSUJII M, AKEDA K, et al. BMP-7/Smad expression in dedifferentiated Schwann cells during axonal regeneration and upregulation of endogenous BMP-7 following administration of PTH (1-34). J Orthop Surg (Hong Kong). 2018;26(3):2309499018812953. [107] LI Z, MEYERS CA, CHANG L, et al. Fracture repair requires TrkA signaling by skeletal sensory nerves. J.Clin. Invest. 2019;129(12):5137-5150. [108] MUKOUYAMA YS, SHIN D, BRITSCH S, et al. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 2002;109(6):693-705. [109] NUKAVARAPU SP, DORCEMUS DL. Osteochondral tissue engineering: current strategies and challenges. Biotechnol Adv. 2013;31(5):706-721. |
| [1] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [2] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [3] | Wang Shanshan, Shu Qing, Tian Jun. Physical factors promote osteogenic differentiation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1083-1090. |
| [4] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [5] | Zhang Ya, Mu Qiuju, Wang Zilin, Liu Hongjie, Zhu Lili. Hydrogel loaded with platelet-rich plasma promotes wound healing in diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 690-696. |
| [6] | Zhu Liwei, Wang Jiangyue, Bai Ding. Application value of nanocomposite gelatin methacryloyl hydrogels in different bone defect environments [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 753-758. |
| [7] | Wang Yeyuan, Du Yilang, Yu Dehao, Ning Fengting, Bai Bing. Effect of micro-arc oxidation treatment on biological activity of medical metals [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 771-776. |
| [8] | Wang Jiani, Chen Junyu. Angiogenesis mechanism of metal ions and their application in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 804-812. |
| [9] | Yang Yuqing, Chen Zhiyu. Role and application of early transient presence of M1 macrophages in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 594-601. |
| [10] | Maisituremu·Heilili, Zhang Wanxia, Nijiati·Nuermuhanmode, Maimaitituxun·Tuerdi. Effect of intraarticular injection of different concentrations of ozone on condylar histology of rats with early temporomandibular joint osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 505-509. |
| [11] | Liu Xueli, Shen Li, Bi Wenguang, Mou Yang, Li Sen. Effect and mechanism of low intensity pulsed ultrasound on early angiogenesis in rats with acute tendon injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(32): 5097-5103. |
| [12] | Xiong Yang, Zhou Shibo, Yu Xing, Bi Lianyong, Yang Jizhou, Wang Fengxian, Qu Yi, Yang Yongdong, Zhao Dingyan, Zhao He, Qiu Ziye, Jiang Guozheng. Molecular biological mechanism of acquired heterotopic ossification [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(30): 4881-4888. |
| [13] | Gao Xueyu, Zhang Wentao, Sun Tianze, Zhang Jing, Li Zhonghai. Application of metal ions in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 439-444. |
| [14] | Chen Pinrui, Pei Xibo, Xue Yiyuan. Function and advantages of magnetically responsive hydrogel in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 452-457. |
| [15] | Long Zhirui, Huang Lei, Xiao Fang, Wang Lin, Wang Xiaobei. Characteristics of hydrogel microspheres in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 472-478. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||