Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (13): 2087-2092.doi: 10.12307/2022.338
Previous Articles Next Articles
Action mechanism of traditional Chinese medicine on regulating ischemia-hypoxia microenvironment and delaying stem cell senescence based on ciRs-7/miR-7 signaling pathway
Wang Shiqi1, Hui Xiaoshan2, An Lanhua1, Yuan Shuzhang1, Zhang Jinsheng3
- 1Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China; 2Guang’anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China; 3Third Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450008, Henan Province, China
-
Received:2021-01-07Revised:2021-01-08Accepted:2021-02-10Online:2022-05-08Published:2021-12-20 -
Contact:Zhang Jinsheng, Chief physician, MD, Professor, Doctoral supervisor, Third Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450008, Henan Province, China -
About author:Wang Shiqi, Doctoral candidate, Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China Hui Xiaoshan, Doctoral candidate, Guang’anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China Wang Shiqi and Hui Xiaoshan contributed equally to this article. -
Supported by:the National Natural Science Foundation of China, No. 81673893 (to ZJS)
CLC Number:
Cite this article
Wang Shiqi, Hui Xiaoshan, An Lanhua, Yuan Shuzhang, Zhang Jinsheng. Action mechanism of traditional Chinese medicine on regulating ischemia-hypoxia microenvironment and delaying stem cell senescence based on ciRs-7/miR-7 signaling pathway[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(13): 2087-2092.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 干细胞衰老与微环境 2.1.1 干细胞衰老的分子机制 干细胞存在于多种组织及器官中,具有多向分化潜能、自我更新能力,且在内环境调控下,干细胞通过旁分泌形式分泌多种生长因子,发挥免疫调节、营养支持、促血管生成等作用。随着年龄的增长,组织、细胞、器官等发生一系列系统性病变,而干细胞的修复和再生成为衰老疾病发生、发展的重要因素。因此,研究干细胞衰老相关的分子机制,有助于衰老疾病的预防与治疗。 (1)Wnt/β-catenin信号通路:Wnt/β-catenin信号通路是介导干细胞增殖、凋亡的经典信号通路,该信号通路激活的标志是β-catenin的转录活性被激活,它是Wnt信号的关键中介,MARCHETTI等[2]研究认为Wnt信号因子与细胞表面受体结合使β-catenin在胞浆中积聚,进入细胞核与T细胞因子等转录因子结合,致使Wnt靶基因转录,引起干细胞衰老。大脑衰老时Wnt因子活性减弱,导致神经干细胞分化异常。Wnt/β-catenin信号通路通过调控p53/p21信号通路、促炎因子的表达、mTOR信号通路以及 c-Myc基因而干预干细胞的生长[3]。 (2)MAPK/ERK信号通路:MAPK/ERK信号通路在干细胞增殖、基因表达、分化、有丝分裂和凋亡中具有重要的生物学功能。MAPK/ERK与干细胞的分化密切相关,抑制ERK可阻止干细胞自然分化,是干细胞有丝分裂分化的强有力刺激源,与干细胞衰老相关性极强。ERK1/2可以抑制细胞凋亡,加快细胞周期进展。KOLO?A等[4]研究发现激活MAPK/ERK信号通路,可增强衰老相关蛋白p16的表达,加快衰老的进程。 (3)SIRT6/NF-κB信号通路:去乙酰化酶SIRT6是干细胞衰老的关键调控蛋白,通过抑制NF-κB调控端粒非依赖的有机体细胞的衰老。SIRT6功能缺陷可影响DNA修复,致使干细胞衰老,而增强NF-κB信号通路可促进干细胞早衰或正常衰老的发生。李渊等[5]通过研究辐射与造血干细胞衰老相关性发现,SIRT6表达下降,NF-κB表达上升,通过人参皂苷Rg1干预此通路可有效减少造血干细胞衰老。 (4)PI3K/AKT/mTOR信号通路:PI3K/AKT/mTOR信号通路是调控干细胞周期、凋亡、代谢及自噬的关键信号通路。外界信号因子激活PI3K,活化的PI3K与磷酸化激酶结合诱导AKT磷酸化,继而激活其下游重要作用靶点mTOR的活性,mTOR分别控制特定亚组分mRNA的翻译,调节蛋白质的合成,促进干细胞的生长和存活等过程。PI3K及其效应物AKT是维持干细胞稳态的重要调节因子,部分PI3K的缺失会导致干细胞增殖能力降低,而AKT和mTOR的过度激活则会导致干细胞扩增,大量进入细胞周期,发生干细胞耗竭。YANG等[6]实验研究显示,大鼠衰老干细胞增加导致活性氧增强,AKT/mTOR信号通路被激活。使用抑制剂阻断活性氧或AKT/mTOR信号通路,衰老干细胞数量减少。 (5)其他信号因子:转化生长因子β是组成早期衰老相关分泌表型的主要生长因子,转化生长因子β信号通路可调控衰老细胞特异性指标β-半乳糖苷酶的表达。CIESLIK等[7]研究指出,衰老与组织不良纤维化有关,转化生长因子β受体表达减少是因为骨髓间充质干细胞和成纤维细胞对转化生长因子β的无反应性造成的。Nanog是一种衰老相关转录因子,在老年心脏的干细胞中,Nanog表达减少,导致骨髓间充质干细胞逐渐分化,表达胶原的间充质纤维细胞数量增加。转化生长因子β可以促进Nanog的表达,使骨髓间充质干细胞保持在原始状态。Notch是决定细胞命运的跨膜蛋白,Notch信号通路的激活可以降低p16、p21蛋白的表达,促进干细胞的增殖和分化,预防间充质干细胞在长期培养中出现老化[6]。 2.1.2 微环境是影响干细胞衰老的重要因素 干细胞衰老是机体衰老的一部分,衰老的改变可由自身遗传因素决定,当干细胞在体外经过一定次数的细胞分裂后,会出现生长停滞的复制性衰老,如端粒酶缩短及活性改变、细胞周期阻滞、衰老相关基因异常表达等。对衰老干细胞后续研究亦可看出,干细胞在多种外界因素环境刺激下受损细胞逐渐累积,细胞内出现调控紊乱,丧失增殖、分化和自我修复的能力,从而造成干细胞衰老。因此,干细胞的衰老是内因和外因共同作用的结果。通过全基因芯片检测技术发现,虽然激活衰老信号通路的分子机制各不相同,但无论是内在还是外在因素引起的干细胞衰老,最终大多要通过调节细胞周期相关蛋白而发挥作用。如ZENG等[8]研究发现,人参皂苷Rg1干预衰老大鼠,可以有效减少大鼠体内氧化应激含量,明显降低衰老骨髓间充质干细胞中p16、p21、p53 的表达水平,间接增加下游细胞周期蛋白cyclinD、cyclinE和CDK4的表达,并通过调控p53/p21和p16/Rb信号通路延缓干细胞的衰老。 干细胞生存的微环境是影响干细胞生长的主要外界因素,干细胞生存的微环境又可称为干细胞龛,是干细胞分化领域的重要学说之一。SCHOFIELD[9]最先提出这一观点,其认为能够调控干细胞功能活性的外在因素共同组成了干细胞生存的微环境,可防止干细胞分化,确保其持续增殖。这里的微环境不是孤立的静止状态,而是包括能够维持干细胞自身功能状态的细胞外环境或细胞外组织区域,既包含细胞内组分,又关联细胞外基质及信号通路,这是一个动态而复杂的过程。当干细胞受到外界刺激时,可使干细胞出现衰老表现,这种情况主要是因为干细胞受到微环境的变化所影响。有研究报道,干细胞接收并响应来自周围环境的各种反馈信号,从而对组织不断变化的需求做出反应。这些分泌信号来自干细胞本身(自分泌)、邻近的壁龛细胞(旁分泌)及其他组织(全身),构成了干细胞调节通路的一部分[10]。干细胞微环境的关键组分包括特定间质、血管、生长因子、神经递质、信号受体、氧气及温度等[11],这些组成干细胞生存环境的组分随着个体年龄增加发生变化,势必会导致干细胞的功能活性改变,如失去其多向分化能力,影响受损组织再生和修复能力;衰老的干细胞旁分泌特征变化,分泌炎症因子及蛋白酶等对周围细胞功能和组织微环境造成不利影响,这些不利因素降低了微环境的“质”和“量”,同时影响干细胞的功能状态,长时间缺血缺氧会产生一种有毒的内环境,在这种内环境下细胞线粒体呼吸遭受抑制,钙信号失调导致线粒体损伤。缺血细胞产生活性氧,过量的活性氧及过氧化剂防御不足之间的失衡又可导致氧化应激。有研究显示,氧化应激是加速干细胞衰老的重要因素,会诱导干细胞早衰、凋亡或死亡,进一步发展导致机体衰老[12]。益气复脉散通过改善心功能,修复组织受损结构,减少心肌梗死后心肌氧化应激、坏死、胶原沉积和心肌纤维化,从改善大环境到改良微环境治疗心血管疾病[13]。加味丹参饮含药血清干预骨髓间充质干细胞,促进骨髓间充质干细胞的增殖分化,增强骨髓间充质干细胞分泌血管内皮生长因子和碱性成纤维细胞生长因子的能力,减轻骨髓间充质干细胞衰老,有效改善微循环,促进梗死区血管新生,使缺血心肌得到保护[14]。由此可见,干细胞衰老与微环境的正常与否密切相关。 2.2 细胞外信号通路影响微环境与干细胞衰老 "

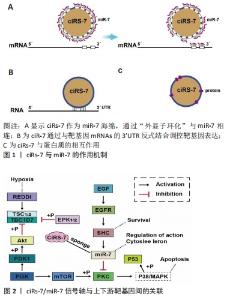
2.2.1 细胞外信号通路对缺血缺氧微环境的调控 人体增龄过程中会伴发动脉粥样硬化、血管狭窄继发缺血缺氧性损伤等一系列疾病,不仅会使组织生存的微环境发生缺血坏死,还会导致细胞生存的微环境异常。信号通路作为干细胞与微环境之间的连接方式,对细胞增殖、分化、自噬和衰老有重要调节作用。因此,越来越多的研究倾向于通过信号通路调控缺血缺氧微环境,进而影响细胞的生存发展、凋亡和代谢过程。 PI3K/AKT信号通路被认为是介导细胞保护的经典通路,是参与细胞发展过程的重要通路之一,涂献坤等[15]研究显示大鼠脑组织缺血24 h后,缺血脑组织p-Akt蛋白表达下降,同时证实PI3K/Akt信号通路参与了缺血性脑损伤的发病过程,其上游靶标基因EGFR在功能上与PI3K/AKT和MAPK/ EPK1/2相关联,在脑缺血后被反式激活,并通过激活下游信号级联PI3K/AKT信号通路促进大脑神经元功能再生[1]。表皮生长因子与表皮生长因子受体相结合,表皮生长因子受体在酪氨酸残基上被磷酸化激活,是调节细胞周期的关键因素。与缺血缺氧密切相关的信号因子还包括ERK1/2,缺氧2 h,大鼠脑微血管内皮细胞内p-ERK1/2 蛋白表达水平明显降低;缺氧6 h,大鼠海马神经元p-ERK1/2表达减少;大鼠大脑中动脉阻塞7 d后,p-ERK1/2表达下降[16-17]。PI3K/AKT参与了对ERK活性的调节,Raf/MAPK/ERK1/2参与了细胞存活和抑制凋亡的过程[2]。由此可见,PI3K/AKT、ERK1/2信号通路与缺血缺氧微环境相关性最强,是调节血管生成所必须的。通过调控此信号通路或其上下游靶标基因,可以提供细胞保护或损伤机制的详细情况。 2.2.2 衰老干细胞自噬相关信号通路对缺血缺氧微环境的影响 自噬是细胞的自我吞噬,在缺血缺氧、饥饿、氧化应激水平升高,或体内受损细胞器、蛋白质过多时,细胞可以激活自噬,通过消化回收代谢物,实现细胞的自我调节和回收利用。干细胞经过多次分化会出现复制性衰老,复制性衰老的干细胞通过抑制自噬,可在一定程度上减缓干细胞的衰老状态,可以看出自噬是一把双刃剑。Ho等[1]建立年轻小鼠及老年小鼠动物模型,改变小鼠的基因组使其均不发生自噬,发现年轻小鼠自噬丧失导致造血干细胞早衰及外观发生异常改变,这表明自噬可以抑制干细胞衰老,当自噬受到阻碍则加快干细胞衰老。衰老干细胞的自噬作用可以通过不同途径调节其水平,其中主要通过依赖mTOR信号通路、p53信号通路、线粒体自噬及调控自噬相关蛋白等途径来调节干细胞自噬水平。 (1)mTOR信号通路:尽管干细胞的衰老研究认为,mTOR是调节干细胞增殖、凋亡的关键信号因子,但MA等[18]研究发现,衰老大鼠骨髓间充质干细胞出现明显的退行性病变,表现出增殖能力减弱及分化不平衡,p53、p21、p16衰老相关蛋白表达上升。使用mTOR抑制剂雷帕霉素后,骨髓间充质干细胞活性增强,相关蛋白标志物表达降低,因此,抑制mTOR的活性可以有效延缓干细胞衰老。由于骨髓间充质干细胞在体外培养的氧体积分数为20%,远高于体内环境,在心肌梗死大鼠模型中显示,移植入缺血缺氧梗死区的干细胞由于低氧应激反应使凋亡率降低,细胞给药前的低氧预适应使干细胞能够更好适应缺氧环境,这可能都与低氧应激诱发了自噬相关。如雷帕霉素减弱AMPK/mTOR活性,自噬抑制剂3-MA促进缺氧诱导的间充质干细胞凋亡,证实了在缺氧条件下间充质干细胞的凋亡受自噬调节。因此,骨髓间充质干细胞在缺血缺氧微环境下通过激活自噬来提高其存活率,这可能是移植治疗心肌梗死的一个有效途径[19]。另外,研究证明,干细胞衰老受其细胞周期阻滞影响颇深。使用雷帕霉素抑制剂可以抑制mTORC1的活性,调控cyclinD、cyclinE和CDK4等细胞周期蛋白的表达,使多数细胞处于G0期,从而抑制干细胞的衰老[20]。 (2) p53信号通路:p53蛋白对干细胞衰老具有双向调节作用。当干细胞进入复制性衰老时,自噬增加。作为自噬标志性蛋白,LC3-Ⅰ型向LC3-Ⅱ型转换的多少可以判断自噬通量是否激活,敲除p53基因导致LC3-Ⅱ型转换减少及mTOR表达增加,从而可以证明骨髓间充质干细胞体外扩增过程中自噬激活的关键是p53信号通路[21]。MRAKOVCIC等[22]研究显示,FIP200蛋白在神经干细胞分化中起关键作用,敲除FIP200基因导致神经干细胞大量死亡,氧化应激水平作用上升。p53通过与FIP200相互作用,起到抑制自噬的作用,诱导干细胞衰老。这一结果提示,p53对干细胞自噬的反向抑制作用可能大于正向激活作用。 (3)其他途径:胰岛素生长因子1表达减少可以通过上调自噬通量来保护缺氧条件下的衰老间充质干细胞,从而提高心肌梗死移植后间充质干细胞的存活率[23]。 GATA4是调控心肌基因表达的重要转录因子,是心肌梗死检测的重要指标。衰老干细胞自噬的研究发现,选择性自噬通过激活NF-κB信号通路降低GATA4的表达可以抑制骨髓间充质干细胞的衰老,而GATA4还可通过核膜的降解来促进细胞衰老,认为其对自噬的调节也具有双面性[21]。总之,衰老干细胞的自噬受到多因素的参与,而细胞自噬既是对抗恶劣微环境的手段,也是许多物种对抗衰老的措施。 2.2.3 circrna/miRNA与干细胞衰老 (1)circrna/miRNA是干细胞衰老机制研究的焦点:长期以来,人们对细胞衰老的分子机制研究主要集中于蛋白基因,而哺乳动物的转录产物90%是由非编码RNA组成,非编码RNA参与多种生物学进程。 miRNA是在真核生物转录调控中起关键作用的内源性非编码RNA。目前已知的与调节衰老相关的miRNA多存在于造血干细胞和骨髓间充质干细胞中,miRNA通过靶向参与DNA损伤、表观遗传、新陈代谢的相关基因,被认为是衰老的关键调节剂 [24]。let-7家族[25]、miR-9[26]、miR-29[27]、miR-34a[28]、miR-212/132[29]、miR-195[30]、miR-495等多个miRNA通过不同途径影响干细胞衰老进程[31]。如miR-195抑制干细胞端粒酶活性,使干细胞增殖分化能力减弱,促进干细胞衰老;miR-495抑制细胞周期,提升了骨髓间充质干细胞凋亡水平,诱发干细胞衰老。JEDARI等[32]研究得出,miR-7是参与神经干细胞分化的又一重要miRNA,在青年大鼠及老年大鼠脑缺血模型中显示,α-突触核蛋白在老年大鼠脑中积聚,miR-7显著抑制靶蛋白α-突触核蛋白的表达,减轻脑缺血后造成的脑损伤[33]。 circRNA在哺乳动物中广泛表达,单个circRNA的分子末端可以共价链接,呈闭环状结构,对核糖核酸酶(RNase)不敏感,不易被降解,因此circRNA具有更高的稳定性,无论作为新的临床标志物或是实验研究应用上都具有更强的优势。不同物种基因中存在成千上万的circRNA,但只有少数得到了认证。作为microRNA的“海绵”或抑制剂,circRNA主要产生于大脑区域,自然存在于细胞内,尤其是在神经元的生存生长及突触可塑性过程中的表达最明显[34]。在大鼠缺血缺氧脑损伤模型中,鉴定出大约66个差异表达的circRNAs,其中作为miR-143海绵作用的circDLGAP4在脑缺血情况下表达显著降低,提示脑缺血缺氧可能与circRNA的表达失衡直接相关[35]。在老年动物中,circRNA在神经元中增多并在大脑皮质和海马区积聚。circRNA随着年龄的增长而增加,这可能是因为老年动物的细胞增殖能力减弱,circRNA在增殖过程中分配给子细胞的数量减少,不断产生的 circRNA稳定性强又不易降解,因此会在脑中积聚,这为其作为衰老的生物标志物提供了基础[36-37]。由此可见,circRNA和miRNA之间的相互作用与脑缺血缺氧损伤及细胞凋亡、细胞代谢变化、免疫系统改变密不可分[38]。 (2)ciRs-7/miR-7延缓干细胞衰老:ciRs-7/miR-7之间的作用机制可能是调控缺血缺氧微环境延缓干细胞衰老的重要因素。 ciRs-7对miR-7的海绵作用:ciRs-7在大脑中高表达,拥有74个miRNA的保守结合位点,是目前研究中拥有miRNA结合位点最多的circRNA。ciRs-7与miR-7效应子紧密结合,比其他线性转录本紧密约10倍[39],因此,miR-7的功能受到更有效调控。ciRs-7与miR-7在小鼠胚胎脑组织中具有相同的特异表达区,在斑马鱼脑组织中发现ciRs-7注射液与敲除后的miR-7表型相似[40]。这些研究结果可以看出,ciRs-7的正、反式调节对miR-7起到海绵作用,且海绵效应与ciRs-7的表达水平相关,脑中ciRs-7的高表达对miR-7的海绵作用更强,增加 miR-7靶基因的表达调控功能[41]。 ciRs-7对miR-7的转录或转录后调控:ciRs-7通过与靶mRNA的3'端非编码区(UTR)结合或基于circRNA-miRNA-mRNA轴等方式,在转录水平上或转录后调控基因表达方面发挥了重要的作用[42-43]。ciRs-7在大脑中的高表达与miR-7在小鼠脑切片和分离的小鼠原代细胞中的表达一致。大鼠心肌缺血再灌注模型中表现出特定circRNA的上调,促进细胞凋亡并加重损伤,在心肌梗死模型中作为保护剂miR-7a的海绵,ciRs-7可增加心肌梗死面积[44],提示ciRs-7与miR-7存在内源性相关作用的关系,即ciRs-7既是miR-7的“海绵”,亦是竞争性内源RNA抑制剂[45]。 ciRs-7/miR-7与靶蛋白的相互作用:miR-7作为多种疾病及信号通路的关键调控因子,可以靶向EGFR、PIK3CD、IGF1R、mTOR、p53等的表达,这些基因是影响干细胞增殖、凋亡和衰老的关键因子,ciRs-7可能是参与其调节神经元功能的重要因素[46]。LI等[40]研究认为,ciRs-7/miR-7对IGF1、EGFR和mTOR起到关键调控作用,显著提高神经干细胞在缺血缺氧微环境中的增殖分化能力。miR-7同家族基因miR-7a在心肌梗死后与ciRs-7共表达可逆转ciRs-7诱导的细胞凋亡,并提升半胱氨酸蛋白酶3的活性,提示ciRs-7/miR-7在梗死区的缺血缺氧微环境中对心肌细胞具有明显的保护作用[47]。 综上所述,ciRS-7/miR-7轴与缺血缺氧微环境中信号通路或信号因子及干细胞衰老、自噬等分子作用机制具有密切相关性,这为其调控缺血缺氧微环境延缓干细胞衰老具有重要意义,见图1,2。"
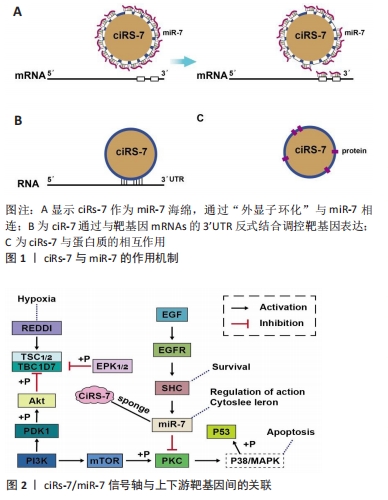

2.3 中医药调控细胞外信号通路改良缺血缺氧微环境的初步探索 中医药在延缓干细胞衰老、防治机体衰老中的功效越来越显著。无论是中药复方还是中药单体,以其多途径、多靶点、多角度的形式调控缺血缺氧微环境,影响细胞外信号通路,具有明显优势。 对于大鼠脑缺血缺氧模型,经人参皂苷Rg1干预后,通过降低D-半乳糖苷处理后的神经干细胞p-AKT及p-mTOR蛋白表达水平,下调p53、p16、p21及Rb的表达量,可以起到延缓神经干细胞衰老、降低其氧化应激水平的作用,这可能与抑制PI3K/AKT/mTOR通路活性有关[48-49]。另外,相较于大鼠衰老模型组,人参皂苷Rg1干预后,β-半乳糖苷酶染色阳性细胞百分率及G0/G1期细胞比例明显下降,混合细胞集落生成单位数量升高,SIRT6 mRNA、蛋白表达上调,NF-κB mRNA、蛋白表达下调,证实了人参皂苷Rg1可能通过调控SIRT6/NF-κB信号通路延缓造血干细胞的衰老[50]。LIU等[51]建立大鼠脑缺血再灌注模型,运用淫羊藿苷干预间充质干细胞,激活PI3K/EPK1/2信号通路,可显著提高海马和额叶皮质区血管内皮生长因子及脑源性神经营养因表达量,促进神经干细胞的增殖,且已有研究发现淫羊藿苷对神经干细胞的诱导作用还与细胞周期基因cyclinD1和p21 mRNA、蛋白表达增加有关[52]。 相对于中药单体来说,中药复方成分复杂,发挥作用的成分也不尽相同,且不同的配伍对中药的药效也会存在差异。HE等[53]使用龙蛭汤含药血清作用于缺血损伤细胞模型,结果显示自噬小体增多,自噬因子LC3-Ⅱ及Beclin-1蛋白表达增加,促进细胞增殖、迁移,细胞管型形成增多;周胜强[54]认为补阳还五汤具有补气、活血、通络的功效,在大鼠缺血模型中,补阳还五汤可以升高p-PI3K、p-Akt及p62蛋白表达水平,降低脑缺血半暗带自噬水平,保护脑神经。课题组在前期实验研究中发现,补肾化瘀生新方通过调控缺血缺氧微环境,显著提升骨髓间充质干细胞的生存率,降低凋亡率及氧化应激水平,通过下调p16、p53、p21蛋白表达可延缓骨髓间充质干细胞衰老,且补肾化瘀生新方可有效提升大鼠海马区神经干细胞在半暗带区的增殖分化水平,促进脑缺血后神经元及神经功能的恢复[55-56]。 综上所述,以补肾、活血化瘀为代表的中药单体或复方,可明显改善缺血缺氧微环境的功能状态,主要通过调控PI3K/AKT/mTOR、NF-κB、p53信号通路及其上下游信号因子发挥延缓干细胞衰老的作用。"

| [1] HO TT, WARR MR, ADELMAN ER, et al. Autophagy maintains the metabolism and function of young and old stem cells. Nature. 2017; 543(7644):205-210. [2] MARCHETTI B, TIROLO C, L’EPISCOPO F, et al. Parkinson’s disease, aging and adult neurogenesis: Wnt/β-catenin signalling as the key to unlock the mystery of endogenous brain repair. Aging Cell. 2020;19(3):e13101. [3] WU J, LIU S, MENG H, et al. Neuropeptide Y enhances proliferation and prevents apoptosis in rat bone marrow stromal cells in association with activation of the Wnt/β-catenin pathway in vitro. Stem Cell Res. 2017;21:74-84. [4] KOLOŠA K, MOTALN H, HEROLD-MENDE C, et al. Paracrine effects of mesenchymal stem cells induce senescence and differentiation of glioblastoma stem-like cells. Cell Transplant. 2015;24(4):631-644. [5] 李渊,周玥,王亚平,等.人参皂苷Rg1基于SIRT6/NF-κB信号通路对辐射致造血干/祖细胞衰老的保护作用[J].中草药,2017,48(21): 4497-4501. [6] YANG M, TENG S, MA C, et al. Ascorbic acid inhibits senescence in mesenchymal stem cells through ROS and AKT/mTOR signaling. Cytotechnology. 2018;70(5):1301-1313. [7] CIESLIK KA, TRIAL J, CRAWFORD JR, et al. Adverse fibrosis in the aging heart depends on signaling between myeloid and mesenchymal cells; role of inflammatory fibroblasts. J Mol Cell Cardiol. 2014;70:56-63. [8] ZENG Y, HU W, JING P, et al. The regulation of ginsenoside Rg1 upon aging of bone marrow stromal cell contribute to delaying senescence of bone marrow mononuclear cells (BMNCs). Life Sci. 2018;209:63-68. [9] SCHOFIELD R. The relationship between the spleen colony-forming cell and the haemopoietic stem cell. Blood Cells. 1978;4(1-2):7-25. [10] CHACÓN-MARTÍNEZ CA, KOESTER J, WICKSTRÖM SA. Signaling in the stem cell niche: regulating cell fate, function and plasticity. Development. 2018;145(15):dev165399. [11] ROSSI L, SALVETTI A. Planarian stem cell niche, the challenge for understanding tissue regeneration. Semin Cell Dev Biol. 2019;87:30-36. [12] 王诗琦,张金生.中医药调控缺血缺氧微环境对骨髓间充质干细胞增殖、分化及衰老的影响[J].中国组织工程研究,2021,25(7):1129-1134. [13] ZHANG Y, ZHANG L, ZHANG Y, et al. YiQiFuMai Powder Injection Attenuates Coronary Artery Ligation-Induced Heart Failure Through Improving Mitochondrial Function via Regulating ROS Generation and CaMKII Signaling Pathways. Front Pharmacol. 2019;10:381. [14] 赵慧杰.加味丹参饮含药血清对骨髓间充质干细胞增殖及分泌bFGF、VEGF 的影响[J].亚太传统医药,2019,15(8):41-43. [15] 涂献坤,杨滨,涂德文,等.PI3K/Akt通路在丙泊酚减轻大鼠脑缺血性损伤中的作用[J].中国药理学通报,2019,35(5):630-633. [16] LIU B, LUO C, ZHENG Z, et al. Shengui Sansheng San extraction is an angiogenic switch via regulations of AKT/mTOR, ERK1/2 and Notch1 signal pathways after ischemic stroke. Phytomedicine. 2018;44:20-31. [17] JEONG JE, PARK JH, KIM CS, et al. Neuroprotective effects of erythropoietin against hypoxic injury via modulation of the mitogen-activated protein kinase pathway and apoptosis. Korean J Pediatr. 2017;60(6):181-188. [18] MA Y, QI M, AN Y, et al. Autophagy controls mesenchymal stem cell properties and senescence during bone aging. Aging Cell. 2018;17(1): e12709. [19] JAKOVLJEVIC J, HARRELL CR, FELLABAUM C, et al. Modulation of autophagy as new approach in mesenchymal stem cell-based therapy. Biomed Pharmacother. 2018;104:404-410. [20] WEICHHART T. mTOR as Regulator of Lifespan, Aging, and Cellular Senescence: A Mini-Review. Gerontology. 2018;64(2):127-134. [21] RASTALDO R, VITALE E, GIACHINO C. Dual Role of Autophagy in Regulation of Mesenchymal Stem Cell Senescence. Front Cell Dev Biol. 2020;8:276. [22] MRAKOVCIC M, FRÖHLICH LF. p53-Mediated Molecular Control of Autophagy in Tumor Cells. Biomolecules. 2018;8(2):14. [23] YANG M, WEN T, CHEN H, et al. Knockdown of insulin-like growth factor 1 exerts a protective effect on hypoxic injury of aged BM-MSCs: role of autophagy. Stem Cell Res Ther. 2018;9(1):284. [24] DALGAARD LT, ELIASSON L. An ‘alpha-beta’ of pancreatic islet microribonucleotides. Int J Biochem Cell Biol. 2017;88:208-219. [25] CAPPELLETTI C, GALBARDI B, BRUTTINI M, et al. Aging-associated genes and let-7 microRNAs: a contribution to myogenic program dysregulation in oculopharyngeal muscular dystrophy. FASEB J. 2019; 33(6):7155-7167. [26] KATZ S, CUSSIGH D, URBÁN N, et al. A Nuclear Role for miR-9 and Argonaute Proteins in Balancing Quiescent and Activated Neural Stem Cell States. Cell Rep. 2016;17(5):1383-1398. [27] LYU G, GUAN Y, ZHANG C, et al. TGF-beta signaling alters H4K20me3 status via miR-29 and contributes to cellular senescence and cardiac aging. Nat Commun. 2018;9(1):2560. [28] JAUHARI A, SINGH T, SINGH P, et al. Regulation of miR-34 Family in Neuronal Development. Mol Neurobiol. 2018;55(2):936-945. [29] HADAR A, MILANESI E, WALCZAK M, et al. SIRT1, miR-132 and miR-212 link human longevity to Alzheimer’s Disease. Sci Rep. 2018;8(1):8465. [30] OKADA M, KIM HW, MATSU-URA K, et al. Abrogation of Age-Induced MicroRNA-195 Rejuvenates the Senescent Mesenchymal Stem Cells by Reactivating Telomerase. Stem Cells. 2016;34(1):148-159. [31] LI X, SONG Y, LIU D, et al. MiR-495 Promotes Senescence of Mesenchymal Stem Cells by Targeting Bmi-1. Cell Physiol Biochem. 2017;42(2):780-796. [32] JEDARI B, RAHMANI A, NADERI M, et al. MicroRNA-7 promotes neural differentiation of trabecular meshwork mesenchymal stem cell on nanofibrous scaffold. J Cell Biochem. 2020;121(4):2818-2827. [33] KIM T, MEHTA SL, MORRIS-BLANCO KC, et al. The microRNA miR-7a-5p ameliorates ischemic brain damage by repressing α-synuclein. Sci Signal. 2018;11(560):eaat4285. [34] KONDO MA, MOHAN A, MATHER KA. Going around in circles: deciphering the role of circular RNAs in neurodegenerative disease. Curr Opin Psychiatry. 2020;33(2):141-147. [35] JIANG L, LI H, FAN Z, et al. Circular RNA expression profiles in neonatal rats following hypoxic-ischemic brain damage. Int J Mol Med. 2019; 43(4):1699-1708. [36] BACHMAYR-HEYDA A, REINER AT, AUER K, et al. Correlation of circular RNA abundance with proliferation--exemplified with colorectal and ovarian cancer, idiopathic lung fibrosis, and normal human tissues. Sci Rep. 2015; 5:8057. [37] KUMAR L, SHAMSUZZAMA, HAQUE R, et al. Circular RNAs: the Emerging Class of Non-coding RNAs and Their Potential Role in Human Neurodegenerative Diseases. Mol Neurobiol. 2017;54(9):7224-7234. [38] GUERRA BS, LIMA J, ARAUJO B, et al. Biogenesis of circular RNAs and their role in cellular and molecular phenotypes of neurological disorders. Semin Cell Dev Biol. 2020 Sep 3. doi: 10.1016/j.semcdb.2020.08.003. Online ahead of print. [39] LI HM, MA XL, LI HG. Intriguing circles: Conflicts and controversies in circular RNA research. Wiley Interdiscip Rev RNA. 2019;10(5):e1538. [40] LI L, CHEN Y, NIE L, et al. MyoD-induced circular RNA CDR1as promotes myogenic differentiation of skeletal muscle satellite cells. Biochim Biophys Acta Gene Regul Mech. 2019;1862(8):807-821. [41] LIU L, LIU FB, HUANG M, et al. Circular RNA ciRS-7 promotes the proliferation and metastasis of pancreatic cancer by regulating miR-7-mediated EGFR/STAT3 signaling pathway. Hepatobiliary Pancreat Dis Int. 2019;18(6):580-586. [42] HANSEN TB, JENSEN TI, CLAUSEN BH, et al. Natural RNA circles function as efficient microRNA sponges. Nature. 2013;495(7441):384-388. [43] PENG L, YUAN XQ, LI GC. The emerging landscape of circular RNA ciRS-7 in cancer (Review). Oncol Rep. 2015;33(6):2669-2674. [44] CAI W, ZHANG Y, SU Z. ciRS-7 targeting miR-135a-5p promotes neuropathic pain in CCI rats via inflammation and autophagy. Gene. 2020;736:144386. [45] LIN SP, YE S, LONG Y, et al. Circular RNA expression alterations are involved in OGD/R-induced neuron injury. Biochem Biophys Res Commun. 2016;471(1):52-56. [46] ZHOU X, JIANG L, FAN G, et al. Role of the ciRS-7/miR-7 axis in the regulation of proliferation, apoptosis and inflammation of chondrocytes induced by IL-1β. Int Immunopharmacol. 2019;71:233-240. [47] GENG HH, LI R, SU YM, et al. The Circular RNA Cdr1as Promotes Myocardial Infarction by Mediating the Regulation of miR-7a on Its Target Genes Expression. PLoS One. 2016;11(3):e0151753. [48] CHEN L, YAO H, CHEN X, et al. Ginsenoside Rg1 Decreases Oxidative Stress and Down-Regulates Akt/mTOR Signalling to Attenuate Cognitive Impairment in Mice and Senescence of Neural Stem Cells Induced by D-Galactose. Neurochem Res. 2018;43(2):430-440. [49] LI YB, WANG Y, TANG JP, et al. Neuroprotective effects of ginsenoside Rg1-induced neural stem cell transplantation on hypoxic-ischemic encephalopathy. Neural Regen Res. 2015;10(5):753-759. [50] TANG YL, ZHOU Y, WANG YP, et al. SIRT6/NF-κB signaling axis in ginsenoside Rg1-delayed hematopoietic stem/progenitor cell senescence. Int J Clin Exp Pathol. 2015;8(5):5591-5596. [51] LIU D, YE Y, XU L, et al. Icariin and mesenchymal stem cells synergistically promote angiogenesis and neurogenesis after cerebral ischemia via PI3K and ERK1/2 pathways. Biomed Pharmacother. 2018;108:663-669. [52] FU X, LI S, ZHOU S, et al. Stimulatory effect of icariin on the proliferation of neural stem cells from rat hippocampus. BMC Complement Altern Med. 2018;18(1):34. [53] HE Q, LIU Q, CHEN Y, et al. Long-Zhi Decoction Medicated Serum Promotes Angiogenesis in Human Umbilical Vein Endothelial Cells Based on Autophagy. Evid Based Complement Alternat Med. 2018; 2018:6857398. [54] 周胜强.补阳还五汤调控Cav1/mTOR/ULK1通路介导的自噬抗脑缺血损伤机制研究[D].长沙:湖南中医药大学,2017. [55] 刘振伟,孙慧君,张金生.补肾化瘀生新方对大脑中动脉栓塞模型大鼠海马区神经干细胞增殖的影响[J].中医学报,2020,35(7):1485-1490. [56] 张宝霞,张金生,惠小珊,等.补肾化瘀生新方改善缺血缺氧性微环境延缓骨髓间充质干细胞衰老的作用[J].中国实验方剂学杂志, 2020, 26(16):87-92. |
| [1] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [2] | Jin Tao, Liu Lin, Zhu Xiaoyan, Shi Yucong, Niu Jianxiong, Zhang Tongtong, Wu Shujin, Yang Qingshan. Osteoarthritis and mitochondrial abnormalities [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1452-1458. |
| [3] | Zhang Lichuang, Xu Hao, Ma Yinghui, Xiong Mengting, Han Haihui, Bao Jiamin, Zhai Weitao, Liang Qianqian. Mechanism and prospects of regulating lymphatic reflux function in the treatment of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1459-1466. |
| [4] | Xiao Hao, Liu Jing, Zhou Jun. Research progress of pulsed electromagnetic field in the treatment of postmenopausal osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1266-1271. |
| [5] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1272-1277. |
| [6] | Wang Shuo, Liu Wenying, Lü Chaofan, Li Jiacong, Geng Yi, Zhao Yungang. Cardioprotective effect of 3-nitro-N-methyl salicylamide on the isolated rat heart under cold ischemia preservation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1194-1201. |
| [7] | Li Zhiyi, He Pengcheng, Bian Tianyue, Xiao Yuxia, Gao Lu, Liu Huasheng. Bibliometric and visualized analysis of ferroptosis mechanism research [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1202-1209. |
| [8] | Yang Shenglin, Pu Xingwei, Luo Chunshan, Yang Jianwen. Neuroprotective effects of tetrandrine preconditioning in rabbits with spinal cord ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1223-1227. |
| [9] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1260-1265. |
| [10] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1102-1106. |
| [11] | Zhou Hongqin, Wu Dandan, Yang Kun, Liu Qi. Exosomes that deliver specific miRNAs can regulate osteogenesis and promote angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1107-1112. |
| [12] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [13] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1119-1124. |
| [14] | Hui Xiaoshan, Bai Jing, Zhou Siyuan, Wang Jie, Zhang Jinsheng, He Qingyong, Meng Peipei. Theoretical mechanism of traditional Chinese medicine theory on stem cell induced differentiation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1125-1129. |
| [15] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||