Chinese Journal of Tissue Engineering Research ›› 2014, Vol. 18 ›› Issue (3): 412-419.doi: 10.3969/j.issn.2095-4344.2014.03.014
Previous Articles Next Articles
Alginate-chitosan microcapsule in tissue engineering research
Jiang Heng-li 1, 2, Cui Yuan-lu 1, 2, Qi Xue-jie 1, 2, Qi Yun3, Ding Shu3
- 1 Tianjin State Key Laboratory of Modern Chinese Medicine (State Key Laboratory), Tianjin 300193, China; 2 Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China; 3 School of Environmental Science and Engineering, Tianjin University, Tianjin 300193, China
-
Online:2014-01-15Published:2014-01-15 -
Contact:Cui Yuan-lu, M.D., Investigator, Doctoral supervisor, Tianjin State Key Laboratory of Modern Chinese Medicine (State Key Laboratory), Tianjin 300193, China; Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China -
About author:Jiang Heng-li, Studying for master’s degree, Tianjin State Key Laboratory of Modern Chinese Medicine (State Key Laboratory), Tianjin 300193, China; Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China -
Supported by:the National Natural Science Foundation of China, No. 51108310; the Doctoral Fund of Ministry of Education of China, No. 20091210110003; the Scientific and Technological Plan for the Sea of Tianjin, No. KX2010-0005
CLC Number:
Cite this article
Jiang Heng-li, Cui Yuan-lu, Qi Xue-jie, Qi Yun, Ding Shu. Alginate-chitosan microcapsule in tissue engineering research[J]. Chinese Journal of Tissue Engineering Research, 2014, 18(3): 412-419.
share this article
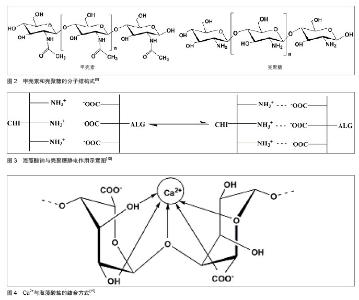
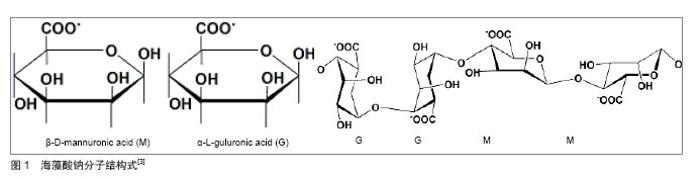
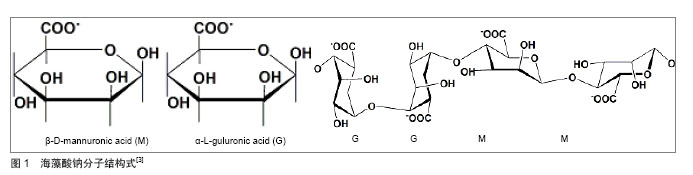
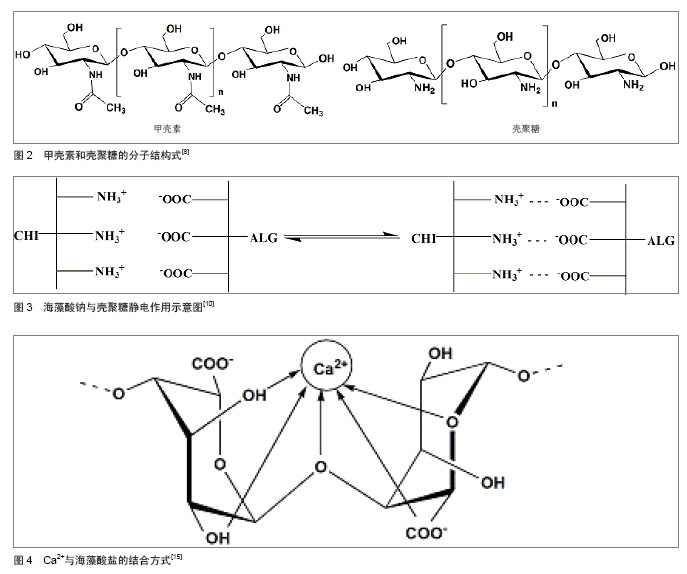
2.1.2 壳聚糖 壳聚糖(C6H11O4N)n是甲壳素脱乙酰化后得到的物质(图2),是自然界惟一的聚阳离子碱性多糖,易溶于甲酸、乙酸、乳酸等有机酸和无机酸中,形成黏性溶液;其分子链上有很多游离伯氨基,在酸性溶液中结合质子,成为带正电荷的聚电解质[8-9],表面高密度的正电荷有利于黏附表面带负电荷的细胞,而且壳聚糖的结构与细胞外基质成分糖胺聚糖(GAGS)相似,其适于作为支架材料用于软骨组织工程的研究。 2.2 海藻酸钠-壳聚糖微胶囊的成型机制及制备 2.2.1 海藻酸钠-壳聚糖微囊成型机制 李沙等[10]借助差示扫描量热法考察了海藻酸钠-壳聚糖微囊成型机制,将用于制备微囊的3种组分海藻酸钠、壳聚糖与钙盐、等量物理混合物、不含壳聚糖的海藻酸钠与钙形成的空白微囊及海藻酸钠与壳聚糖胶凝反应生成的产物,作扫描量热分析以探讨微囊的成型机制。分析样品的扫描量热谱图认为海藻酸钠与壳聚糖通过静电相互作用形成微囊,壳聚糖单体分子上质子化的氨基与海藻酸钠M单元的羧基通过正负电荷吸引形成聚电解质膜(图3)。 2.2.2 海藻酸钠-壳聚糖微囊制备方法 通过聚电解质络合原理制备的海藻酸钠-壳聚糖微胶囊,是以聚电解质复合结构为囊膜,以海藻酸钠为囊芯物的微胶囊。目前,制备方法主要包括一步法、两步法和复合法[11-12]。 一步法是将壳聚糖和钙离子混合液滴入海藻酸钠溶液中反应,或反向操作将海藻酸钠溶液滴入壳聚糖和钙离子的混合溶液中形成外部依次为壳聚糖沉积层、壳聚糖/海藻酸钠络合层和海藻酸钙凝聚层,内部是液芯的微胶囊;两步法是将海藻酸钠溶液滴到钙离子溶液中钙化成核后用壳聚糖包覆成膜,最后用柠檬酸钠溶液进行液化处理得到微胶囊;复合法是指凝胶化海藻酸盐与壳聚糖反应制备海藻酸钠-壳聚糖微胶囊后以双功能团分子如戊二醛等对微胶囊的表面进行交联[13]。例如王家荣等[13]采用两步法制备了海藻酸钠-壳聚糖-海藻酸钠生物微胶囊,并考察了氯化钙浓度、海藻酸钠浓度、壳聚糖浓度及其pH值,以及柠檬酸钠溶液pH值对微胶囊性能的影响。实验结果表明,胶囊粒径随氯化钙浓度和海藻酸钠浓度的增加而增大,胶囊的膜厚随壳聚糖浓度的增加而增厚,随壳聚糖溶液pH值的增加而降低;而在胶囊液化处理过程中,柠檬酸钠溶液的pH值对微胶囊的机械强度有很大的影响。当氯化钙浓度为1.5%,海藻酸钠浓度为2%,壳聚糖浓度和pH值分别为1.5%和5.0及柠檬酸钠溶液的pH值为7.2时,可制得粒径为2.65 mm、机械强度为150 mN的海藻酸钠-壳聚糖-海藻酸钠生物微胶囊。 海藻酸钙水凝胶为离子包埋型水凝胶[14],将海藻酸钠加入含钙离子介质中,只有G单元参与离子交联作用,两个均聚G嵌段通过协同作用结合,在中间形成钻石形的亲水空间,Ca2+占据这些空间并与G单元上的多个氧原子螯合,海藻酸链与链间结合紧密并相互作用形成三维网络结构,Ca2+像鸡蛋一样嵌于其中形成了“蛋盒结构”[15](图4),而均聚的M嵌段与Ca2+不能形成该结构由于其韧性大、易弯曲等特点。 GM交替嵌段在生成水凝胶的过程中将各嵌段链接起来而并不具有直接作用。 氯化钙是Ca2+交联海藻酸盐水凝胶体系常选用的交联剂,即将海藻酸钠滴入到含钙离子溶液中,钙离子就从液滴表面逐渐渗透进内部,这常被称作外部凝胶 法[16],其凝胶速率很难控制且凝胶化过程过快常产生呈梯度变化的交联密度和不均一性的结构,具有良好力学性能和形态的三维结构便无法获得;而内部凝胶法选用的是碳酸钙能制备粒径较小的凝胶微球,且可以实现工业化生产[17-18]。 通过荧光标记海藻酸钠,制备内部凝胶化及外部凝胶化海藻酸钙微球观察凝胶结构,并通过Leica confocal software 分析凝胶内部的荧光分布可发现内部凝胶化呈现内外均一的凝胶结构[19]。例如于炜婷等[19]采用乳化-内部凝胶化技术制备粒径可控且分布较均匀的海藻酸钙凝胶微球,其工艺易于放大以实现工业规模生产,因而已被用于蛋白、多肽类药物的缓控释载体和酶的固定化研究。实验提出将乳化-内部凝胶化工艺用于微生物固定化培养的研究,以啤酒酵母S.cerevisiae BY4741为模型,重点考察了乳化-内部凝胶化工艺过程相关参数对微生物活性的影响规律,发现酸是影响其活性的主要因素。因此,从内部凝胶化的原理入手,确定了适合微生物包埋的工艺条件,制备过程中微生物活性可保持77.0%,凝胶微球体积产率93.5%。进而制备载细胞海藻酸钠-壳聚糖微胶囊,考察载细胞海藻酸钠-壳聚糖微胶囊固定化培养过程中啤酒酵母的生长动力学,结果表明在细胞增殖过程中,微胶囊形态保持良好,酵母菌的生长动力学明显优于游离培养组。因此,乳化-内部凝胶化工艺有望成为规模化微生物固定化培养和生产的新技术。 Liu等[20]研究了通过外部凝胶化和内部凝胶化技术制备的海藻酸钠-壳聚糖微胶囊溶胀特性,借助激光扫描共聚焦显微镜对内部或外部凝胶化海藻酸钙进行结构分析,注意到内部凝胶化的膨胀率明显低于外部凝胶化微胶囊。 2.3 影响微胶囊性能的因素 影响海藻酸钠-壳聚糖微胶囊性能的因素主要是壳聚糖溶液的性质:壳聚糖的分子质量、壳聚糖溶液的pH值、浓度等,这些因素主要影响微胶囊的膜强度和控释性能。 2.3.1 壳聚糖分子质量对微胶囊性能的影响 壳聚糖分子量对微胶囊膜强度的影响机制主要包括:壳聚糖分子进入海藻酸钙凝胶网络的扩散速率和程度及壳聚糖分子与海藻酸钠分子之间的反应程度。分子质量大的壳聚糖具有较大的链节空间尺寸,因而扩散进入海藻酸钙凝胶网络的阻力也较大,从而扩散速率和程度都相对较低,因此成膜反应主要发生在海藻酸钙凝胶珠表面,即使其链节上荷正电的氨基数目较多,与海藻酸钠分子的反应程度仍然较低,形成的膜薄,抗膨胀能力较弱;分子质量低的壳聚糖空间位阻低,进入海藻酸钙凝胶网络很容易,进入的分子数目增多同时提供的氨基数目也随之增多,从而与海藻酸钠分子反应程度增大,生成的膜厚,抗膨胀能力较强。 Polk 等 [21]研究发现:壳聚糖相对分子质量对微胶囊的强度和控释性的影响是很重要的。McKnight等[22]研究了在膜形成过程中影响膜硬度和弹性的3个主要因素:壳聚糖的分子质量,反应基团离壳聚糖主链的距离及反应基团的类型。有研究采用亚硝酸盐氧化法制备了不同分子质量的壳聚糖,发现高分子质量壳聚糖制备的微囊膜薄接近透明,微囊十分脆弱,若悬浮液提供的浮力消失,微囊很容易在自身重力作用下破碎[23];另一方面通过降低壳聚糖分子质量形成的微囊膜厚、弹性强,球形圆整,囊边缘光滑不变形。刘群等[24]以乳化/内部凝胶化法制备了海藻酸钠-壳聚糖微囊,以膨胀度为指标证明低分子质量壳聚糖制备的微胶囊膜厚度远远高于高分子质量,并且低分子质量壳聚糖成膜反应速率大于高分子质量壳聚糖。Daugulis 等[25]也发现随着壳聚糖相对分子质量的降低,制备的微胶囊强度提高。李会静等[26]研究了海藻酸钠-壳聚糖凝胶微囊制备及两相培养过程参数对酵母细胞生长及转化生产芳香醇的影响规律,结果证明制备参数(壳聚糖分子质量)与培养基-有机溶剂比例对酵母细胞生长及转化能力有明显影响;在两相体系中培养24 h后,微囊化酵母细胞浓度为7.41×1011L-1,底物转化率为77.2%,产物芳香醇质量浓度可达5.71 g/L。 2.3.2 壳聚糖溶液pH值对微胶囊性能的影响 海藻酸钠-壳聚糖囊膜由壳聚糖分子上质子化的氨基与海藻酸钠M单元的羧基通过静电相互作用形成,壳聚糖溶液的pH值直接影响两种天然高分子材料的电荷分布以及分子结构,当溶液的pH值与壳聚糖的pKa=6.3接近时,此时壳聚糖分子几乎不带电,电荷密度显著降低,分子空间伸展小,分子扩散系数较高,能更深入地进入海藻酸钙凝胶网络中,发生的聚电解质络合程度深,所以膜厚。 杨唐仪等[27]采用响应面法优化海藻酸钠-壳聚糖-粉末活性炭生物微胶囊制备工艺,筛选出影响微胶囊机械强度的重要参数,利用Box-Behnken design确定了参数之一壳聚糖pH值的最佳水平为6.0。但微胶囊作为动物细胞或微生物细胞的固定化载体时,pH值对维持细胞活性至关重要。付颖丽等[28]的实验发现:不同pH值壳聚糖溶液制备的微胶囊对微生物的影响较大,微生物对pH值的要求较为苛刻。于炜婷等[29]探讨了不同pH条件对壳聚糖分子成膜深度、囊膜膨胀性能及通透性的影响规律,结合不同种类细胞的结构特点及对环境pH值的敏感特性,确定了制备动物细胞、微生物细胞培养用海藻酸钠-壳聚糖微胶囊的最佳pH值。 2.3.3 壳聚糖溶液浓度对微胶囊性能的影响 在相同条件下制备的海藻酸钙凝胶珠,当增加壳聚糖溶液的浓度时溶液与凝胶珠中的壳聚糖浓度梯度随之增大,致使壳聚糖分子的扩散推动力增大,扩散程度和反应程度也相应的增加,膜变厚,抗膨胀能力增强。不同方法制备的凝胶珠,导致其膜强度不同的主要因素是自身结构的差异。 王岸娜等[30]通过单因素实验和正交实验得出:壳聚糖浓度对微胶囊的包埋率和载药量有很大影响。王华明等[31]通过海藻酸钠与钙、壳聚糖反应制备海藻酸钙-壳聚糖凝胶微球,利用红外光谱和扫描电镜对其进行表征,探讨壳聚糖浓度对复合材料凝胶性能(如强度、含水率和溶胀度)的影响。结果表明,材料中的海藻酸钙和壳聚糖存在分子间相互作用(氢键),在凝胶表面能形成很多网格,壳聚糖极大地改善了复合材料的凝胶性能。邢楠等[32]分别用激光共聚焦扫描显微镜和全自动型倒置生物显微镜观察标记异硫氰酸荧光黄的牛血清白蛋白由微胶囊外部向内部扩散的动态过程,对牛血清白蛋白在海藻酸钙-壳聚糖微胶囊中的双向通透性能进行了定性和定量初步研究,考察了壳聚糖、海藻酸钠溶液浓度及微胶囊组成成分对牛血清白蛋白通透性能的影响。 2.4 海藻酸钠-壳聚糖微胶囊的应用前景 随着生物技术和膜技术研究的不断深入,微胶囊制备方法不断完善,应用领域不断扩宽,微胶囊已被应用于细胞培养、细胞和酶固定化、药物缓控释、人工器官及基因运载工具、抗癌药物筛选等生物医学领域[33-35]。海藻酸钠-壳聚糖的高微囊强度及其可调节的渗透性,使其成为包埋活细胞和控制释放体系的理想载体[36]。 2.4.1 海藻酸钠-壳聚糖微胶囊在固定化细胞技术中的应用 固定化技术是指利用物理或化学手段,将游离细胞或酶与固态不溶性载体相结合,固定在限定的空间区域,保持细胞及其内酶的活性、并能够反复使用的方 法[37-38],主要包括固定化酶、固定化细胞及固定化藻技术。一方面,固定化细胞技术既不需纯化也不必把酶从细胞中提取出来,酶活力损失小,另外,固定化细胞技术是一种新型的废水处理技术,用于废水脱色是一种十分具有生物效益的策略[39],因此,近年来,人们开始广泛研究利用微胶囊固定细胞。 Chandy等[40]制备海藻酸钠-壳聚糖-聚乙二醇微胶囊,应用扫描电镜检测发现它的机械稳定性和蛋白扩散性能良好,用此胶囊包埋血红蛋白并观察血红蛋白的释放,没有溶血现象且稳定性和生物相容性很好。与此同时,付颖丽等[41]制备了海藻酸钠-壳聚糖微胶囊用于动物和微生物细胞的微囊化培养与移植,通过活体实验方法也进一步证明了海藻酸钠-壳聚糖微胶囊具有良好的生物相容性;于炜婷等[19]以啤酒酵母S.cerevisiae BY4741为模型,将乳化-内部凝胶化工艺用于微生物固定化培养的研究,制备了载细胞海藻酸钠-壳聚糖微胶囊,结果证明,在细胞增殖过程中微胶囊形态保持良好,酵母菌的生长动力学明显优于游离培养组。但是,微胶囊固定化细胞过程中也有许多细节因素需要考虑,Huguet等[42]通过分析牛血清白蛋白、人血红蛋白及不同分子质量的Dextran在壳聚糖包被海藻酸钙微珠中的释放规律,考察了成囊材料对固定化细胞培养的影响。付颖丽等[28]通过考察大肠杆菌DH5α在海藻酸钠-壳聚糖胶囊内的生长、繁殖、代谢及死亡的动态过程,提出在固定化细胞过程中必须综合考虑pH值对细胞活性及微囊膜通透性能的影响,降低壳聚糖溶液的pH值,通透性能好,有利于细胞更容易的吸收营养物质,但是细胞对pH值的敏感性又意味着不能单纯考虑通透性的要求。细胞成囊技术通过控制细胞使其连续释放生物产品给宿主而能够治疗各类疾病,许多生物技术公司也将他们的注意力集中到这种技术上,然而目前微囊化细胞制备和培养研究仅限于小规模实验室范围,从临床到市场的一些问题如发展的科学问题、伦理问题、政府法规等问题仍未得到妥善解决[43]。 2.4.2 海藻酸钠-壳聚糖微胶囊在药物制剂中的作用 药物微囊化技术在制药领域的应用日益广泛,特别是在解决口服药存在的问题上,它一方面改善了药物的稳定性,另一方面延缓了药物释放,减少了不良反应,显示出了许多优势。自从在重组基因上获得支持后,蛋白质药物市场正在快速发展,传递这些药物最首选的路径-口服成为最大的挑战。在设计蛋白质和多肽的口服给药制剂pH敏感性水凝胶海藻酸钠和壳聚糖引起了人们的关注[44]。方面, Zhang等[45]制备了壳聚糖-海藻酸钠载胰岛素微囊,研究了其制备过程、物理性能及胰岛素在模拟胃肠道条件下的释放行为。口服给药系统克服了胰岛素常规给药途径注射法需要多次给药及产生多种不良后果的缺陷,制成微囊的工艺避免了胰岛素通过胃肠道时胃酸的破坏及胃肠道酶的降解作用,发展了一种口服胰岛素制剂。盐酸尼卡地平口服后能被快速完全吸收,半衰期很短,Takka等[46-47]将其制成壳聚糖-海藻酸钙微粒,进一步探讨了海藻酸钠的类型及一些形式调控因素如聚合物的质量比、CaCl2的浓度和固化时间对药物释放和药物包埋效率的影响。 微胶囊作为药物缓释载体能很好地控制药物释放,起到缓释作用。微囊中药物的释放机制一般认为有3种:一是物理过程-扩散,溶剂进入微球将药物溶解,药物经囊膜或材料及其中孔隙扩散进入介质,微球表面药物的溶解及扩散则容易形成释药的突释效应;二是物理化学过程-囊膜或材料的溶蚀,材料性质、介质组成、pH值、体积和温度等决定了其溶解速率;三是囊膜及材料降解或在酶作用下酶解(化学反应及生化反应),形成体内代谢产物,使药物释放出来,但仍需经溶解及扩散才能进入体液[48]。 Li等[49]通过乳化交联技术制备载凝血酸海藻酸钠-壳聚糖微胶囊,在模拟体液中进行微胶囊的体外降解试验,在预定时间取出样品洗涤,冻干至恒质量,计算样品的质量损失比率。结果发现,在一开始降解速率较快,随后降解比率随时间的延长而缓慢升高,4周以后降解比率也只达到40%。Martinez等[50]以它莫西芬为模型药物制备了海藻酸钠-壳聚糖纳米粒,药物释放研究在含0.5% SDS的PBS中进行,发现药物释放包括两个阶段,第一阶段时间短,药物释放最快,第二阶段药物释放变缓,而且比第一阶段时间长。研究发现在纳米粒表面的它莫西芬与纳米粒的相互作用较弱,在第一阶段便被释放出来,然后留在纳米粒内部的它莫西芬在第二阶段才被释放出来。研究还发现微粒的大小与纳米层的厚度也能调节药物的释放速率。 海藻酸钠与壳聚糖均是无毒、生物相容性好的天然高分子材料,得到广泛应用,如外科修复材料和透皮给药、眼部给药、缓释包衣、结肠给药、微球栓塞、人体器官和基因运载工具等,其中作为缓释制剂的骨架及包埋材料等尤为重要[51-52]。海藻酸钠单独作为药物释放载体曾引起了人们极大的兴趣,但凝胶溶蚀现象严重加速药物释放使其使用受到了限制[53]。另外,Østberg 等[54]也发现海藻酸盐凝胶珠作为控释系统时只可以用于大分子难溶性化合物,而对小分子可溶性药物不适用。Tamilvanan等[55]发现用壳聚糖包覆海藻酸钠,可抑制凝胶珠的溶蚀,使药物释放速率显著减缓。Sezer等[56-57]分别考察了承载大分子及小分子药物的海藻酸钠在包裹壳聚糖后的释放特征,充分证明在凝胶结构中添加壳聚糖能减慢药物从载体中的释放。王岸娜等[31]研究了复凝聚法制备碘微囊的工艺,考察了在模拟胃液环境下海藻酸钠-壳聚糖微胶囊的控释效果。海藻酸钠-壳聚糖微胶囊具有很好的pH响应性,卢凤琦等[58]的实验显示海藻酸钠-壳聚糖微囊在pH值1.4的缓冲液中缓释作用明显大于pH值7.2的缓冲液,因此,该微胶囊可用于对胃刺激性大的药物的剂型设计。肖莉等[59]的实验表明芦丁海藻酸钠-壳聚糖漂浮微囊在人工肠液中释放迅速,释放率是人工胃液中释放率的10倍,提示海藻酸钠-壳聚糖微囊可以制成pH值响应性的脉冲释放制剂。 值得注意的是,当通过海藻酸钠外面包覆壳聚糖膜来改善凝胶珠中的药物释放时,影响作用不仅仅取决于裹在微球表面的壳聚糖的密度,也与制备方法(一步法、两步法)及其他因素:包裹壳聚糖之前微球的状态(湿态还是干态)及参与反应的海藻酸钠浓度有关。总体来看,一步法制备的微囊比两步法中药物的突释作用厉害的多;另外,无论采用哪种制备方法,当海藻酸钠浓度从1.5%增加到3.0%或5.0%时都能造成严重的突释,此时提高壳聚糖的浓度反而会导致微囊更严重的爆破,从而促进药物释放[60]。 2.4.3 海藻酸钠-壳聚糖微胶囊在组织工程中的应用前景 组织工程兴起于20世纪80年代,它借助工程学和生命科学的原理方法,在体内植入具有生物活性的体外人工取代物,对组织缺损进行修复,起到替代组织、器官的部分或全部功能[61]。的作用 陈文斌等[62]将负电性海藻酸钙微球与正电性壳聚糖微球通过静电作用贴附在一起制备自组装支架,小粒径壳聚糖微球贴附到海藻酸钙微球表面形成核壳结构状,克服了微球型注射支架存在的体内成型困难和微球游走等问题。Marsich 等[63]利用海藻酸钠和乳糖修饰壳聚糖制备了一种新的生物活性支架,其物理化学性能表明海藻酸钠-乳糖/壳聚糖水凝胶具有较好的机械性能。生物化学与生物学研究表明这些三维支架能维持软骨细胞表型,显著刺激促进软骨细胞生长和增殖。这项研究可以被看作是生物活性支架用于软骨细胞体外培养、扩增和细胞传递的第一步。覃昱等[64]制备壳聚糖海藻酸钠复合微球,将微球与骨髓基质细胞一起培养,研究此种复合物的生物相容性。结果表明,壳聚糖-海藻酸钠复合材料对骨髓基质细胞的增殖、分化及分泌功能无明显影响,验证其在组织工程领域作为骨支架材料的可行性。"
| [1]叶莉,王士斌.微囊化干细胞及其应用研究进展[J].生物工程学报,2010,26 (12) :1611-1617.[2]De S, Robinson D. Polymer relationships during preparation of chitosan-alginate and poly-l-lysine-alginate nanospheres.J Controll Release.2003;89 (1): 101-112.[3]Hunt NC,Grover LM.Encapsulation and culture of Mammalian cells including corneal cells in alginate hydrogels.Methods Mol Biol.2013;1014:201-210.[4]Lundqvist LC,Jam M,Barbeyron T,et al.Substrate specificity of the recombinant alginate lyase from the marine bacteria Pseudomonas alginovora.Carbohydr Res.2012;352:44-50.[5]Gu F,Amsden B,Neufeld R.Sustained delivery of vascular endothelial growth factor with alginate beads.J Controll Release.2004;96(3): 463-472. [6]Siddhesh NP,Pawar KE.Alginate derivatization: a review of chemistry, properties and applications.Biomaterials. 2012; 33(11):3279-3305. [7]曹月龙,庞 坚,詹红生,等.海藻酸盐在软骨组织工程中的应用[J].中国组织工程研究与临床康复,2007,11(48): 9777-9780.[8]Vijay SY,Sadhana SR.Unprecedented chitin and chitosan: A Chemical Overview. J Polym Environ.2013;21(2): 606-614. [9]Kim SK.Marine Biomaterials:Characterization,Isolation,and Application.CRC Press,2013:45-60. [10]李沙,侯新朴.海藻酸钠-壳聚糖微囊成型机理及其对大分子药物的载药、释药研究[J].药学学报,2003,38(5): 380-383. [11]何荣军,杨 爽,孙培龙,等.海藻酸钠/壳聚糖微胶囊的制备及其应用研究进展[J].食品与机械,2010,26(2):166-168.[12]Alexakis T,Boadi DK,Quong D,et al.Micro encapsulation of DNA within alginate micro spheres and crosslinked chitosan membranes for in vivo application.Appl Biochem Biotechnol. 1995;50(1): 93-106. [13]王家容,金谊,刘望才,等.海藻酸钠-壳聚糖-海藻酸钠生物微胶囊的制备[J].宁波大学学报,2007,20(4):516-519.[14]Eiselt P,Yeh J,Latvala RK,et al. Porous carriers for biomedical applications based on alginate hydrogels.Biomaterials.2000; 21:1921-1927. [15]Massimiliano B, Gudmund SB,Sergio P,et al.On the Initial Binding of Alginate by Calcium Ions. The Tilted Egg-Box Hypothesis.J Phys Chem B.2013;117(24): 7277-7282.[16]Eva P,Marek B,Dusan C,et al.Method for preparation of planar alginate hydrogels by external gelling using an aerosol of gelling solution. Carbohyd Polym.2012;90(1):472-482. [17]Song HY,Yu WT,Gao M,et al. Microencapsulated probiotics using emulsification technique coupled with internal or external gelation process.Carbohydr Polym.2013;96(1): 181-189.[18]林军章,于炜婷,徐小溪,等.乳化/内部凝胶化工艺制备海藻酸钙凝胶微球的研究[J]. 功能材料,2008,39(11):1879-1882.[19]于炜婷,林军章,刘袖洞,等.乳化-内部凝胶化工艺制备固定化酵母微胶囊[J].化工学报,2009,60(3):710-717. [20]Liu XD,Xu WM,Liu Q.Swelling behaviour of alginate-chitosan microcapsules prepared by external gelation or internal gelation technology. Carbohydr Polym. 2004;(56): 459-464.[21]Polk A,Goosen M.Kinetics of protein diffusion from a poly(D,L-lactide) reservoir system.J Pharm Sci.1990;79(5): 407. [22]McKnight CA,Ku A,Goosen MF.Synthesis of chitosan-alginate microcapsule membranes.J Bioact Compat Polym.1988; 10(3):334-355.[23]Choi WS,Ahn KJ,Lee DW,et al. Preparation of chitosan oligomers by irradiation. Polym Deg Stab.2002;78: 533-538. [24]刘群,薛伟明,于玮婷,等.海藻酸钠-壳聚糖微胶囊膜强度的研究[J].高等学校化学学报,2002,23(7):1417-1420. [25]Daugulis A,Faulkner P,Goosen M.Alginate‐Polylysine microcapsules of controlled membrane molecular-weight cutoff for mammalian cell culture engineering.Biotechnol Prog.1987;3(4):231-240. [26]李会静,于玮婷,许冠哲.海藻酸钠-壳聚糖凝胶微囊固定化细胞非水相中催化性能[A];中国化学会第28届学术年会第12分会场摘要集[C],2012. [27]杨唐仪,李朝霞,丁成,等. 响应面法优化海藻酸钠-壳聚糖-粉末活性炭生物微胶囊制备工艺[J].化学通报,2011,74(3): 252-258.[28]付颖丽,雄 鹰,刘袖洞,等.海藻酸钠/壳聚糖微胶囊固定化大肠杆菌的研究[J].生物工程学报,2002,18(2): 239-241. [29]于炜婷,刘袖洞,李晓霞,等.壳聚糖溶液 pH对载细胞海藻酸钠- 壳聚糖微胶囊性能的影响[J].高等学校化学学报,2006,27(1): 182-186.[30]王岸娜,吴立根,周跃勇.壳聚糖海藻酸钠微胶囊制备研究[J].河南工业大学学报, 2007,28(6):19-23. [31]王华明,曹 阳,徐 龙,等.壳聚糖对藻酸钙凝胶性能的影响[C].二〇〇八全国功能材料科技与产业高层论坛论文集,2008. [32]邢楠,田丰,刘圣军,等.海藻酸钙-壳聚糖微胶囊组成对BSA通透性能影响的研究[J].化学学报,2007,65(24): 2952-2958.[33]Huang XB,Zhang XY,Wang XG,et al.Microenvironment of alginate-based microcapsules for cell culture and tissue engineering. J Biosci Bioeng.2012;114 (1):1-8.[34]Datta S,Christena LR,Sriramulu YR,et al. Enzyme immobilization: an overview on techniques and support materials. Biotech.2013;3(1):1-9. |
| [1] | Pu Rui, Chen Ziyang, Yuan Lingyan. Characteristics and effects of exosomes from different cell sources in cardioprotection [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(在线): 1-. |
| [2] | Zhang Chao, Lü Xin. Heterotopic ossification after acetabular fracture fixation: risk factors, prevention and treatment progress [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1434-1439. |
| [3] | Zhou Jihui, Li Xinzhi, Zhou You, Huang Wei, Chen Wenyao. Multiple problems in the selection of implants for patellar fracture [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1440-1445. |
| [4] | Wang Debin, Bi Zhenggang. Related problems in anatomy mechanics, injury characteristics, fixed repair and three-dimensional technology application for olecranon fracture-dislocations [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1446-1451. |
| [5] | Ji Zhixiang, Lan Changgong. Polymorphism of urate transporter in gout and its correlation with gout treatment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1290-1298. |
| [6] | Yuan Mei, Zhang Xinxin, Guo Yisha, Bi Xia. Diagnostic potential of circulating microRNA in vascular cognitive impairment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1299-1304. |
| [7] | Wang Xianyao, Guan Yalin, Liu Zhongshan. Strategies for improving the therapeutic efficacy of mesenchymal stem cells in the treatment of nonhealing wounds [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1081-1087. |
| [8] | Wan Ran, Shi Xu, Liu Jingsong, Wang Yansong. Research progress in the treatment of spinal cord injury with mesenchymal stem cell secretome [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1088-1095. |
| [9] | Liao Chengcheng, An Jiaxing, Tan Zhangxue, Wang Qian, Liu Jianguo. Therapeutic target and application prospects of oral squamous cell carcinoma stem cells [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1096-1103. |
| [10] | Zhao Min, Feng Liuxiang, Chen Yao, Gu Xia, Wang Pingyi, Li Yimei, Li Wenhua. Exosomes as a disease marker under hypoxic conditions [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1104-1108. |
| [11] | Xie Wenjia, Xia Tianjiao, Zhou Qingyun, Liu Yujia, Gu Xiaoping. Role of microglia-mediated neuronal injury in neurodegenerative diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1109-1115. |
| [12] | Li Shanshan, Guo Xiaoxiao, You Ran, Yang Xiufen, Zhao Lu, Chen Xi, Wang Yanling. Photoreceptor cell replacement therapy for retinal degeneration diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1116-1121. |
| [13] | Jiao Hui, Zhang Yining, Song Yuqing, Lin Yu, Wang Xiuli. Advances in research and application of breast cancer organoids [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1122-1128. |
| [14] | Wang Shiqi, Zhang Jinsheng. Effects of Chinese medicine on proliferation, differentiation and aging of bone marrow mesenchymal stem cells regulating ischemia-hypoxia microenvironment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1129-1134. |
| [15] | Zeng Yanhua, Hao Yanlei. In vitro culture and purification of Schwann cells: a systematic review [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1135-1141. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||