Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (7): 1091-1098.doi: 10.12307/2023.756
Previous Articles Next Articles
Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells
Pan Xiaolong1, Fan Feiyan1, Ying Chunmiao1, Liu Feixiang2, Zhang Yunke1, 2
- 1Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China; 2First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China
-
Received:2022-11-08Accepted:2022-12-26Online:2024-03-08Published:2023-07-17 -
Contact:Zhang Yunke, Chief physician, Professor, Doctoral supervisor, Post-doctoral cooperative supervisor, Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China; First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China -
About author:Pan Xiaolong, Master, Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China -
Supported by:the National Natural Science Foundation of China, No. 81974564 (to ZYK); the National Natural Science Foundation of China, No. 82104730 (to LFX); the Zhongyuan Talent Program - Science and Technology Innovation Leading Talent Project, No. 224200510027 (to ZYK)
CLC Number:
Cite this article
Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 间充质干细胞的特征及临床应用 人间充质干细胞主要有两个主要来源:成人和围产期,成人来源指人体内可以分离间充质干细胞的特定组织,包括骨髓、脂肪组织、牙髓、外周血、月经血和肌肉等,围产期间充质干细胞的来源包括脐带成分,如脐带、华通氏胶、脐血以及胎盘结构,如胎盘膜、羊膜、绒毛膜和羊水等[11]。作为一种多能干细胞,间充质干细胞可以分化为中胚层细胞系,如肌细胞、软骨细胞、脂肪细胞和基质层成纤维细胞;还有内胚层和外胚层,如干细胞、神经元和胶质细胞,从而补充组织中丧失的细胞[12]。但越来越的研究发现旁分泌功能才是间充质干细胞治疗人类疾病的核心功能,其通过分泌生长因子、细胞因子、趋化因子、细胞外基质成分和代谢产物等在疾病治疗过程中发挥免疫调节、组织重塑和细胞稳态等功能[13]。 目前,间充质干细胞的临床试验已经涉及骨骼系统、神经系统及呼吸系统等多种系统疾病。HOANG等[11]最近通过对间充质干细胞用于临床疾病治疗的研究进行综述,发现不同来源的的间充质干细胞(主要是临床应用最广泛的来源于骨髓、脂肪和脐带的间充质干细胞[14])可能对特定器官的疾病具有倾向性,如骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)可能对脑及脊髓的疾病具有较好疗效,脐带间充质干细胞对可能对肺部疾病具有较好疗效,而脂肪间充质干细胞(adipose tissue-derived stem cells,ADSCs)可能是内分泌、生殖系统和烧伤疾病的理想种子细胞。而与不同间充质干细胞对特定器官具有倾向性相对应的是中医自古就强调中药的归经特性。归经是指中药对机体某脏腑经络的选择性作用。研究发现引经药可通过基质细胞衍生因子1/CXC族细胞因子受体4及单核细胞趋化蛋白1 / CC趋化因子受体2等信号轴促进间充质干细胞向特定器官的归巢[15]。所以,课题组认为未来根据不同疾病选择针对性的间充质干细胞种类及中药无疑具有提高间充质干细胞临床疗效的巨大潜力。"


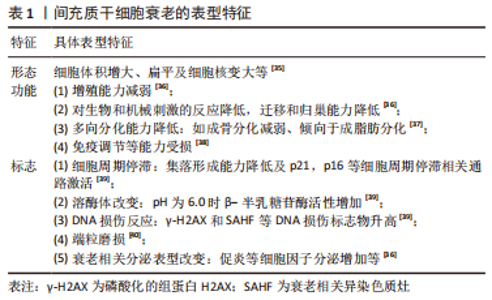
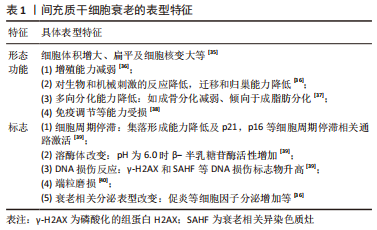
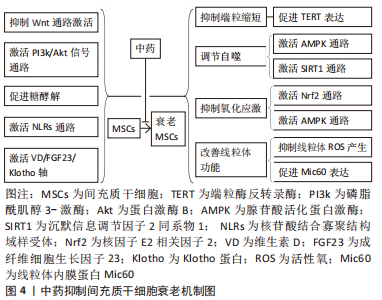
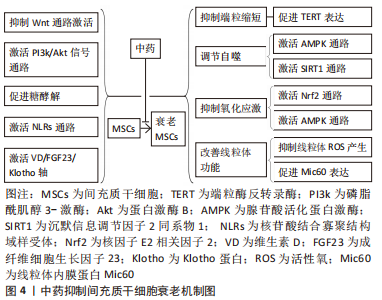
2.2 间充质干细胞衰老的机制 有研究首次提出了细胞衰老的概念[16],最初是观察到正常的二倍体细胞在有限的分裂次数(Hayflick 极限)后停止增殖。随后对细胞衰老的研究不断深入,2019年国际细胞衰老协会将细胞衰老定义为由应激性损伤和某些生理过程触发的一种细胞状态,其特征是长期且通常不可逆的细胞周期停滞,伴随分泌特征、大分子损伤和新陈代谢改变[17]。间充质干细胞在体外扩增主要经历复制衰老,而移植入体内的间充质干细胞主要经历应激诱导的衰老。导致间充质干细胞衰老的机制目前尚不完全清楚,但DNA损伤、端粒缩短、氧化应激、自噬障碍和线粒体功能障碍在间充质干细胞衰老中发挥了关键作用,是间充质干细胞衰老的主要公认机制[18-19]。 2.2.1 DNA损伤 DNA损伤包括端粒缩短、自发的脱氨基、水解、单链及双链断裂等[20]。由于大量的外源性和内源性基因毒素,DNA损伤在间充质干细胞生命中持续发生,DNA的完整性只有通过不断修复才能得以维持。但即使修复了大部分的DNA损伤,仍有一些逃脱了检测或者无法修复(主要是DNA双链断裂)导致细胞凋亡或衰老,而在细胞凋亡和衰老之间的抉择主要取决于DNA损伤的程度和持续时间,短期的剧烈DNA损伤常导致细胞凋亡,而长期的轻度DNA损伤常导致细胞衰老[21]。长期的DNA损伤主要通过激活p53/p21和p16通路造成细胞周期停滞和衰老[22-23]。 2.2.2 端粒缩短 每一次有丝分裂都会降低干细胞的增殖能力,导致它们复制衰老,而端粒缩短是间充质干细胞复制衰老的核心机制。哺乳动物细胞的端粒由数千个被Shelterin复合体覆盖的TTAGGG重复序列串联组成,该复合体有助于形成套索状结构(t环)以保护端粒DNA暴露的染色体末端免受DNA损伤。但由于 DNA的半不连续复制以及核酸酶和活性氧等有害因子的危害,端粒在每一次细胞分裂后都会发生缩短[24]。端粒缩短导致端粒DNA环失稳和端粒脱帽,未受保护的端粒类似于持续性DNA双链断裂,导致DNA损伤反应以及下游p53通路的激活,造成细胞周期停滞和衰老[25],而通过促进端粒反转录酶表达等增加端粒长度可延缓间充质干细胞衰老[26]。 2.2.3 氧化应激 活性氧是导致细胞氧化损伤的主要原因,其主要由线粒体氧化磷酸化过程中的电子泄漏产生,低水平的活性氧对于维持细胞的增殖、分化和存活是必要和有利的,而且细胞可以通过产生超氧化物歧化酶、谷胱甘肽等内源性抗氧化剂清除活性氧,但在多种应激情况下,细胞活性氧产生过多或清除障碍导致细胞内活性氧的积累[27]。过多的活性氧主要通过以下两种途径造成细胞衰老[28]:①造成DNA损伤和端粒缩短,激活DNA损伤反应及其下游p53通路激活;②激活核因子κB信号通路促进白细胞介素1β、肿瘤坏死因子α等衰老相关分泌表型因子分泌,造成细胞自分泌和旁分泌衰老。研究发现通过激活核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号通路等抑制氧化应激可抑制间充质干细胞衰老[29]。 2.2.4 自噬障碍 自噬可降解受损细胞器和蛋白质聚集体,维持细胞在饥饿和应激状态下的新陈代谢,与细胞衰老、凋亡等生理病理过程密切相关[30]。自噬主要包括巨自噬、微自噬及伴侣介导的自噬三种类型,而巨自噬(以下简称自噬)是细胞内最有效的细胞降解途径,也是目前研究最多的自噬类型。自噬包括吞噬泡的形成和延伸、自噬体的形成、自噬体与溶酶体融合以形成自噬溶酶体,最后通过溶酶体内一系列的水解酶将所包裹的细胞质底物进行降,进而实现细胞对自身代谢所需原料的再利用[31]。衰老的间充质干细胞自噬水平降低,促进自噬可通过提高细胞内蛋白质及细胞器质量控制抑制间充质干细胞衰老[32]。 2.2.5 线粒体功能障碍 线粒体作为细胞内氧化磷酸化和三磷酸腺苷合成的主要场所,是细胞的动力工厂,线粒体功能障碍是诱导细胞衰老的主要原因之一。线粒体形态及功能障碍导致细胞衰老的机制主要包括4个方面[33]:①线粒体代谢障碍导致氧化型烟酰胺腺嘌呤二核苷酸/还原型烟酰胺腺嘌呤二核苷酸比例降低从而导致p53通路的激活;②线粒体自噬障碍导致线粒体质量控制下将,功能障碍的线粒体在体内聚集导致活性氧生成增加;③线粒体动态失调导致线粒体过度偏向融合,产生过多拉长的线粒体导致活性氧过度生成;④线粒体细胞内通讯障碍导致线粒体接纳来自内质网的钙增多,线粒体内过多的钙导致活性氧生成过多。研究发现使用光生物调节疗法等改善线粒体功能可抑制间充质干细胞衰老[34]。"


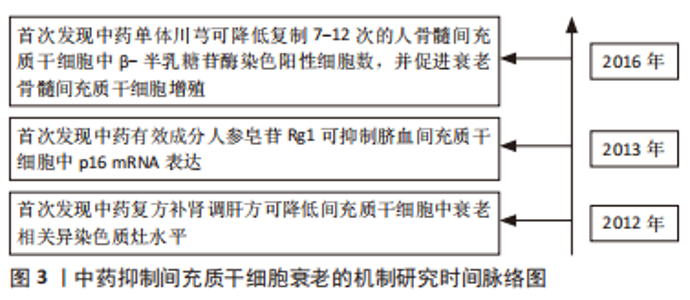
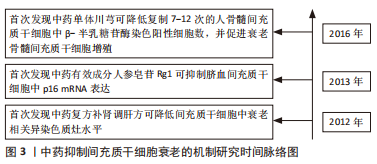
2.4.1 中药复方 健骨二仙丸:由龟板、鹿角胶、党参、枸杞子、续断及山药组成,具有补肾填精益气功效,可促进骨髓间充质干细胞成骨分[41]。郭柏铭[42]研究发现H2O2处理后的骨髓间充质干细胞出现体积增大、细胞扁平、核变大、β-半乳糖苷酶染色阳性率增高及p53、p21和p16 mRNA表达升高等一系列衰老特征,而健骨二仙丸和金匮肾气丸含药血清可抑制骨髓间充质干细胞衰老,显著改善衰老骨髓间充质干细胞代谢活力和增殖能力。 补肾化瘀生新方:由熟地黄、巴戟天、川芎、当归、石斛、肉桂和甘草组成,具有补肾活血功效。补肾化瘀生新方在体外对骨髓间充质干细胞的复制衰老及D-半乳糖和缺血缺氧微环境导致的衰老均具有抑制作用,并可促进衰老骨髓间充质干细胞增殖[43-45]。而在体内,研究发现补肾化瘀生新方联合骨髓间充质干细胞静脉移植相较于单纯骨髓间充质干细胞静脉移植可显著降低D-半乳糖诱导的衰老大鼠脑、心脏、肺脏及肝脏中p16、p53和p21 mRNA表达,说明补肾化瘀生新方可提高骨髓间充质干细胞移植的抗衰老作用[46]。 左归丸:由熟地黄、山药、枸杞、山茱萸、川牛膝、鹿角胶、龟板胶及菟丝子组成,具有补肾填精功效,是当前抑制间充质干细胞衰老的代表性中药复方。研究发现左归丸不仅可改善衰老骨髓间充质干细胞形态和结构,促进其增殖和成骨分化,而且对D-半乳糖导致的衰老骨髓间充质干细胞中β-半乳糖苷酶活性、磷酸化的组蛋白H2AX等细胞衰老相关标志的升高具有明显抑制作用,作用机制可能与抑制Wnt通路激活相关[47-50]。 补肾调肝方:由骨碎补、狗脊、白芍、柴胡、郁金、当归、玫瑰花、川楝子、川芎、白术、合欢皮、菊花、菖蒲和甘草组成。研究发现补肾调肝方水提液可改善衰老骨髓间充质干细胞形态,促进其增殖和成骨分化,降低衰老骨髓间充质干细胞中衰老相关异染色质水平,作用机制可能与抑制HIRA和ASF1a基因蛋白表达相关[51-52]。 独活寄生汤:由独活、桑寄生、杜仲、川牛膝、细辛、秦艽、茯苓、肉桂、防风、川芎、人参、甘草、当归、芍药和地黄组成,具有补益肝肾、祛风止痛的功效。WANG等[53]研究发现独活寄生汤以及其组成药物川芎不仅可通过激活Smad蛋白1/5/8和细胞外调节蛋白激酶信号通路增强骨髓间充质干细胞的成骨分化,而且可降低复制7-12代的骨髓间充质干细胞中衰老细胞数,促进衰老骨髓间充质干细胞增殖。 文章总结了抑制间充质干细胞衰老的相关中成药[42-53],见表2。"

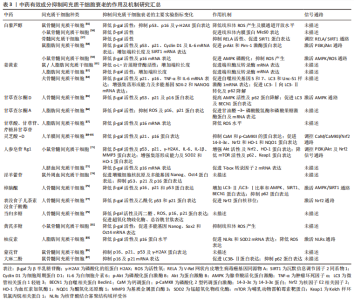
2.4.2 中药有效成分 白藜芦醇:是虎杖等多种中药的有效成分,具有抗炎、抗氧化和抗衰老等多种药理作用[54]。改善线粒体功能是当前白藜芦醇抑制间充质干细胞衰老和改善衰老间充质干细胞功能的主要机制。张大勇等[55]发现白藜芦醇可降低骨髓间充质干细胞线粒体活性氧产生及线粒体膜通道开放水平,通过改善线粒体功能抑制骨髓间充质干细胞衰老。LV等[56]研究发现白藜芦醇可显著改善衰老骨质疏松SAMP6小鼠的成骨能力,体外研究进一步发现来自于4月龄SAMP6小鼠的骨髓间充质干细胞表现出β-gal阳性率增高及成骨分化能力减弱等衰老特征,而白藜芦醇可通过促进骨髓间充质干细胞中线粒体内膜蛋白Mic60表达改善衰老骨髓间充质干细胞线粒体功能,促进其成骨分化,这可能是白藜芦醇防治骨质疏松的机制所在。除了改善线粒体功能,HE等[57]研究发现藜芦醇作为一种天然的沉默信息调节因子2同系物1(silent information regulator 2 homolog 1,SIRT1)激动剂可通过抑制V-Rel网状内皮增生病毒癌基因同源物A活性促进衰老骨髓间充质干细胞中SIRT1蛋白表达,通过调控V-Rel网状内皮增生病毒癌基因同源物A/SIRT1信号轴抑制骨髓间充质干细胞衰老。LEI等[58]发现白藜芦醇可通过促进Pim-1激酶的表达抑制脂肪间充质干细胞衰老并恢复衰老脂肪间充质干细胞的旁分泌作用,增强衰老脂肪间充质干细胞培养基对大鼠胰岛细胞瘤细胞胰岛素分泌的促进作用,而衰老脂肪间充质干细胞中Pim-1激酶的表达增加可能与磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases,PI3K)/蛋白激酶B(protein kinase B,Akt)通路激活相关。ZHOU等[59]发现白藜芦醇可通过激活腺苷酸活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)信号通路抑制活性氧的产生从抑制骨髓间充质干细胞衰老,增强衰老骨髓间充质干细胞的细胞活力及成骨分化能力。 姜黄素:是姜黄和石菖蒲等中药的主要有效成分之一,具有抗氧化、抗炎、抗动脉粥样硬化及抗肿瘤等多种药理作用[60]。姜黄素主要通过提高端粒酶反转录酶活性抑制间充质干细胞衰老。PIRMORADI等[61]研究发现姜黄素可通过促进端粒酶反转录酶mRNA表达显著降低第5和7次传代的脂肪间充质干细胞中衰老细胞数量,促进衰老脂肪间充质干细胞增殖。但姜黄素水溶后治疗效果较差,SERATI-NOURI等[62]将负载姜黄素的介孔二氧化硅纳米颗粒集成到电纺聚己内酯/明胶纳米纤维支架中,实现姜黄素的两阶段释放相较于游离姜黄素可进一步促进脂肪间充质干细胞中端粒酶逆转录酶蛋白及mRNA表达,增加复制衰老脂肪间充质干细胞的端粒长度,抑制脂肪间充质干细胞复制衰老。除此之外,DENG等[63]研究发现姜黄素可通过促进自噬抑制间充质干细胞衰老。 甘草活性成分:甘草具有补脾益气和缓急止痛等功效,现代研究发现甘草中含有三萜类、黄酮类、多糖类及香豆素类等多种活性成分,具有抗氧化、抗肿瘤和抗衰老等多种药理作用[64]。目前,至少已有7种甘草活性成分被证明具有抑制间充质干细胞衰老的作用,其中以黄酮类化合物研究较为深入。MAHARAJAN等[65]发现甘草查尔酮 D可通过上调AMPK介导的自噬激活抑制H2O2诱导的骨髓间充质干细胞衰老。WU等[66研究发现复制9代之后的脂肪间充质干细胞表现出括体积增大和p16蛋白表达增加等明显衰老特征,而甘草酮查尔A可通过促进脂肪间充质干细胞中甘油醛-3-磷酸脱氢酶和磷酸果糖激酶等糖酵解相关基因转录激活糖酵解从而抑制脂肪间充质干细胞复制衰老,促进衰老脂肪间充质干细胞增殖和成骨分化。除了黄酮类化合物,降瑞婵等[67]研究发现甘草中的5中活性成分甘草酸、甘草苷、异甘草苷、芹糖甘草苷和芹糖异甘草苷均可抑制脂肪间充质干细胞衰老,其中以甘草酸的抗衰老效果最佳,其次是甘草苷和芹糖异甘草,作用机制可能与抑制活性氧产生相关。 灵芝酸-D:是中药灵芝的主要活性成分之一,研究发现灵芝酸D可增加D-半乳糖诱导的衰老人羊膜间充质干细胞中14-3-3蛋白家族中14-3-3ε蛋白表达[68-69],而14-3-3ε蛋白的过表达可通过激活钙调蛋白/2型钙调蛋白激酶/Nrf2信号轴抑制人羊膜间充质干细胞衰老,促进其增殖。 人参皂苷Rg1:是益气中药人参的主要活性成分之一,具有抗衰老、抗氧化和保护神经功能等多种药理作用,可促进间充质干细胞的增殖和分化[70]。汪子铃[71]发现人参皂苷Rg1可通过激活PI3K/Akt/哺乳动物雷帕霉素靶蛋白信号通路增强D-半乳糖诱导的骨髓间充质干细胞中p62依赖性细胞自噬,而自噬的增强可通过激活Nrf2通路抑制骨髓间充质干细胞衰老。王爽[72]发现人参皂苷 Rg1可通过提高p16和T-box转录因子2 mRNA表达抑制D-半乳糖导致的人脐血间充质干细胞衰老,促进衰老人脐血间充质干细胞成骨分化,抑制其向脂肪细胞分化。 淫羊藿苷:是补肾中药淫羊藿的主要活性成分之一,具有良好的促进骨髓间充质干细胞成骨分化的作用[73]。王鹏珍等[74]研究发现淫羊藿苷和碱性成纤维细胞生长因子单独应用均可降低体外培养大鼠外周血间充质干细胞中β-gal 染色阳性细胞数,促进大鼠外周血间充质干细胞增殖及干性维持,且两者联合作用显著优于单独应用。 樟脑醌:是中药樟脑的主要活性成分。MAHARAJAN等[75]研究发现樟脑醌可通过促进AMPK/SIRT1通路激活增加H2O2诱导的衰老骨髓间充质干细胞中膜型微管相关蛋白1轻链3 /胞浆型微管相关蛋白1轻链3比率和自噬相关蛋白Beclin1表达,降低p62蛋白表达,通过促进自噬抑制骨髓间充质干细胞衰老。 表没食子儿茶素没食子酸酯:主要存在于绿茶中,具有抗菌、抗肿瘤及抗炎等多种药理作用[76]。SHIN等[77]发现表没食子儿茶素没食子酸酯可通过促进Nrf2核移位逆转H2O2导致的骨髓间充质干细胞中p53和p21蛋白水平升高,抑制骨髓间充质干细胞衰老。 当归多糖:是补血活血中药当归的主要活性成分,可通过激活PI3K/Akt和Wnt/β-连环蛋白等信号通路促进间充质干细胞增殖和分化[78]。耿珊[79]研究发现来自白血病患者的骨髓间充质干细胞相较于来源于健康人骨髓间充质干细胞的集落形成能力和多向分化能力明显降低,细胞中超氧化物歧化酶及总谷胱甘肽明显降低,而β-半乳糖苷酶染色阳性率及p16、p53及p21mRNA则明显升高,表现出典型的衰老表型特征,而当归多糖不仅可显著改善来源于白血病患者骨髓间充质干细胞的上述表型特征,促进其增殖,并且可增强衰老骨髓间充质干细胞对白血病干细胞增殖的抑制作用,起到防治白血病的作用。 黄芪多糖:是益气中药黄芪的主要有效成分之一,具有修复甲醛染毒人骨髓间充质干细胞的DNA损伤的作用[80]。YANG等[81]发现黄芪多糖可通过抑制线粒体活性氧产生逆转柠檬酸铁铵导致的骨髓间充质干细胞衰老,提高衰老骨髓间充质干细胞内多能基因Nanog、Sox2和Oct4 mRNA表达,改善衰老骨髓间充质干细胞增殖能力。 柚皮素:存在于石斛及枳实等多种中药中,具有抗氧化、抗炎等多种药理作用[82]。吴雅廷等[83]发现柚皮素可降低体外培养脂肪间充质干细胞中活性氧及p16蛋白表达,降低β-gal 染色阳性细胞,抑制脂肪间充质干细胞衰老,促进脂肪间充质干细胞的增殖,这可能是柚皮素激活核苷酸结合寡聚结构域样受体信号通路上调锰超氧化物歧化酶基因的表达的结果。 蒙花苷:存在于密蒙花、野菊花及薄荷等多种中药中,具有抗氧化、抗炎及抗骨质疏松等多种药理作用[84]。崔直等[85]发现蒙花苷处理后,D-半乳糖诱导的衰老骨髓间充质干细胞中衰老相关蛋白 p16、p21的p53表达明显降低,DNA损伤相关细胞核内磷酸化组蛋白H2AX阳性细胞明显减少,说明蒙花苷具有抑制骨髓间充质干细胞衰老的作用。 大麻二酚:是药用植物大麻的活性成分之一,具有具有抗惊厥、抗焦虑、抗炎及神经保护等多种药理作用[86]。李琳等[87]发现大麻二酚可通过促进自噬相关蛋白膜型微管相关蛋白1轻链3B表达抑制D-半乳糖诱导的骨髓间充质干细胞衰老,促进衰老骨髓间充质干细胞成骨分化。 文章总结了中药有效成分抑制间充质干细胞衰老的作用及机制[55-87],见表3。"


2.4.3 中药单体 艾叶:具有温经止血和散寒止痛等功效,现代研究发现其含有挥发油、酚酸、黄酮和多糖等多种活性成分,具有抗炎和抗肿瘤等多种药理作用[88]。HO等[89]研究发现艾叶水提物不仅可通过抑制线粒体活性氧产生抑制阿霉素诱导的脂肪间充质干细胞衰老,而且可明显改善老年大鼠的前肢握力、记忆力和心脏功能,具有良好抗衰老作用。 黄芪:具有补气升阳、益气固表及敛疮生肌等功效,现代研究发现黄芪含有多糖、黄酮类和三萜类等多种有效成分,具有抗肿瘤和神经保护等多种药理作用[90]。研究发现黄芪可通过调节维生素D/成纤维细胞生长因子23/Klotho轴抑制D半乳糖导致的骨髓间充质干细胞衰老,促进衰老骨髓间充质干细胞成骨分化,从而起到防治骨质疏松的作用[91-92]。"

| [1] CHUNG JW, CHANG WH, BANG OY, et al. Efficacy and safety of intravenous mesenchymal stem cells for ischemic stroke. Neurology. 2021;96(7): e1012-e1023. [2] SZYDLAK R. Biological, chemical and mechanical factors regulating migration and homing of mesenchymal stem cells. World J Stem Cells. 2021;13(6): 619-631. [3] PENG X, ZHOU X, YIN Y, et al. Inflammatory microenvironment accelerates bone marrow mesenchymal stem cell aging. Front Bioeng Biotechnol. 2022;10:870324. [4] LEHMANN J, NARCISI R, FRANCESCHINI N, et al. WNT/beta-catenin signalling interrupts a senescence-induction cascade in human mesenchymal stem cells that restricts their expansion. Cell Mol Life Sci. 2022;79(2):1-19. [5] WANG B, LIU Z, CHEN VP, et al. Transplanting cells from old but not young donors causes physical dysfunction in older recipients. Aging cell. 2020;19(3):e13106. [6] GANGULY P, EL-JAWHARI JJ, GIANNOUDIS PV, et al. Age-related changes in bone marrow mesenchymal stromal cells: a potential impact on osteoporosis and osteoarthritis development. Cell Transplant. 2017;26(9): 1520-1529. [7] LIU Y, CHEN Q. Senescent mesenchymal stem cells: disease mechanism and treatment strategy. Curr Mol Biol Rep. 2020;6(4):173-182. [8] LÓPEZ-OTÍN C, BLASCO MA, PARTRIDGE L, et al. The hallmarks of aging. Cell. 2013; 153(6):1194-1217. [9] 徐德成,马迎民,范吉平.中医“肾精”的现代医学内涵[J].中医杂志, 2017,58(22): 1891-1897. [10] 方健康,周轶平,李玛琳.中药对骨髓间充质干细胞增殖、凋亡及分化的影响研究进展[J].中国中药杂志,2014,39(15):2834-2837. [11] HOANG DM, PHAM PT, BACH TQ, et al. Stem cell-based therapy for human diseases. Signal Transduct Target Ther. 2022;7(1):1-41. [12] 陈娜,王晓含,张运克.间充质干细胞对衰老相关性缺血性卒中的作用及机制[J].中国组织工程研究,2022,26(24):3914-3920。 [13] HAN Y, YANG J, FANG J, et al. The secretion profile of mesenchymal stem cells and potential applications in treating human diseases. Signal Transduct Target Ther. 2022;7(1):1-19. [14] ZHOU T, YUAN Z, WENG J, et al. Challenges and advances in clinical applications of mesenchymal stromal cells. J Hematol Oncol. 2021;14(1): 1-24. [15] 李应福,谢兴文,李宁,等.引经理论与骨髓间充质干细胞、信号通路的相关性[J].中医杂志,2019,60(6):477-481. [16] HAYFLICK L, MOORHEAD PS. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961;25:585-621. [17] GORGOULIS V, ADAMS PD, ALIMONTI A, et al. Cellular senescence: defining a path forward. Cell. 2019;179(4):813-827. [18] ERMOLAEVA M, NERI F, ORI A, et al. Cellular and epigenetic drivers of stem cell ageing. Nat Rev Mol Cell Biol. 2018;19(9):594-610. [19] AL-AZAB M, SAFI M, IDIIATULLINA E, et al. Aging of mesenchymal stem cell: machinery, markers, and strategies of fighting. Cell Mol Biol Lett. 2022; 27(1):1-40. [20] SCHUMACHER B, POTHOF J, VIJG J, et al. The central role of DNA damage in the ageing process. Nature. 2021;592(7856):695-703. [21] PETROVA NV, VELICHKO AK, RAZIN SV, et al. Small molecule compounds that induce cellular senescence. Aging Cell. 2016;15(6):999-1017. [22] BLACKFORD AN, JACKSON SP. ATM, ATR, and DNA-PK: the trinity at the heart of the dna damage response. Mol Cell. 2017;66(6):801-817. [23] WENG Z, WANG Y, OUCHI T, et al. Mesenchymal stem/stromal cell senescence: hallmarks, mechanisms, and combating strategies. Stem Cells Transl Med. 2022;11(4): 356-371. [24] LUPATOV AY, YARYGIN KN. Telomeres and telomerase in the control of stem cells. Biomedicines. 2022;10(10):2335. [25] 营孙阳,熊加秀,麦洪旭,等.端粒酶调控研究进展[J].遗传,2016,38(4): 289-299. [26] ZHAO Q, WANG XY, YU XX, et al. Expression of human telomerase reverse transcriptase mediates the senescence of mesenchymal stem cells through the PI3K/AKT signaling pathway. Int J Mol Med. 2015;36(3):857-864. [27] OH J, LEE YD, WAGERS AJ. Stem cell aging: mechanisms, regulators and therapeutic opportunities. Nat Med. 2014;20(8):870-880. [28] VARESI A, CHIRUMBOLO S, CAMPAGNOLI L IM, et al. The role of antioxidants in the interplay between oxidative stress and senescence. Antioxidants. 2022;11(7):1224. [29] ZHONG L, DENG J, GU C, et al. Protective effect of MitoQ on oxidative stress-mediated senescence of canine bone marrow mesenchymal stem cells via activation of the Nrf2/ARE pathway. In Vitro Cell Dev Biol Anim. 2021;57(7):685-694. [30] LI A, GAO M, LIU B, et al. Mitochondrial autophagy: molecular mechanisms and implications for cardiovascular disease. Cell Death Dis. 2022;13(5):1-15. [31] GRIFFEY CJ, YAMAMOTO A. Macroautophagy in CNS health and disease. Nat Rev Neurosci. 2022;23(7):411-427. [32] 邓嘉强,李韦瑶,钟丽君,等.自噬与间充质干细胞衰老的关系研究进展[J].中国生物工程杂志,2022,42(3):55-61. [33] GHOSH‐CHOUDHARY SK, LIU J, FINKEL T. The role of mitochondria in cellular senescence. FASEB J. 2021;35(12):e21991. [34] EROGLU B, GENOVA E, ZHANG Q, et al. Photobiomodulation has rejuvenating effects on aged bone marrow mesenchymal stem cells. Sci Rep. 2021;11(1):1-18. [35] OJA S, KOMULAINEN P, PENTTILÄ A, et al. Automated image analysis detects aging in clinical-grade mesenchymal stromal cell cultures. Stem Cell Res Ther. 2018;9(1):1-13. [36] WONG PF, DEVI MD, RAMASAMY TS. Senotherapeutics for mesenchymal stem cell senescence and rejuvenation. Drug Discov Today. 2022;28(1): 103424. [37] MA Y, QI M, AN Y, et al. Autophagy controls mesenchymal stem cell properties and senescence during bone aging. Aging cell. 2018;17(1): e12709. [38] LUNYAK VV, AMARO-ORTIZ A, GAUR M. Mesenchymal stem cells secretory responses: senescence messaging secretome and immunomodulation perspective. Front Genet. 2017;19(8):220. [39] HERNANDEZ-SEGURA A, NEHME J, DEMARIA M. Hallmarks of cellular senescence. Trends Cell Biol. 2018;28(6):436-453. [40] GÜNEŞLIOL BE, KARACA E, AĞAGÜNDÜZ D, et al. Association of physical activity and nutrition with telomere length, a marker of cellular aging: a comprehensive review. Crit Rev Food Sci Nutr. 2021;23:1-19. [41] 程志安,韩凌,危建安,等.六味地黄丸、金匮肾气丸及健骨二仙丸含药血清对BMSCs成脂、成骨细胞分化相关基因的影响[J].中国中西医结合杂志,2013,33(2): 261-265. [42] 郭柏铭.氧化应激对间充质干细胞老化的作用及补肾法的调控[D].广州:广州中医药大学,2014. [43] 张宝霞,张金生,惠小珊,等.补肾化瘀生新方改善缺血缺氧性微环境延缓骨髓间充质干细胞衰老的作用[J].中国实验方剂学杂志,2020, 26(16):87-92. [44] 朱慧芳.补肾化瘀生新方对骨髓间充质干细胞β-半糖苷酶活性调控作用的实验研究[D].郑州:河南中医学院,2015. [45] 张阳阳.基于衰老相关基因探讨补肾化瘀生新方延缓骨髓间充质干细胞衰老的机制[D].郑州:河南中医药大学,2016. [46] 张宝霞,张金生,许二平,等.补肾化瘀生新法协同静脉注射骨髓间充质干细胞对延缓大鼠衰老作用[J].中国实验方剂学杂志,2018,24(24): 116-121. [47] KANG X, CHEN L, YANG S, et al. Zuogui Wan slowed senescence of bone marrow mesenchymal stem cells by suppressing Wnt/β-catenin signaling. J Ethnopharmacol. 2022;10;294:115323. [48] 丁富平,张晨,张玉卓,等.左归丸水煎液对衰老MSCs的影响[J].转化医学电子杂志,2017,4(4):11-15. [49] 詹菲,张晨,黄进,等.左归丸对衰老大鼠骨髓MSC形态学影响的研究[J].时珍国医国药,2015,26(3):513-515. [50] 黄进,徐志伟,詹菲,等.左归丸对衰老大鼠骨髓间充质干细胞成骨和成脂分化的影响[J].中药新药与临床药理,2015,26(1):5-8. [51] 梁祖建,吴春飞,张百挡.补肾调肝方诱导衰老BMSCs成骨分化的实验研究[J].中国骨质疏松杂志,2013,19(3):212-216. [52] 梁祖建. 补肾调肝法治疗高龄原发性骨质疏松症的理论、临床与实验研究[D].广州:广州中医药大学,2012. [53] WANG JY, CHEN WM, WEN CS, et al. Du-Huo-Ji-Sheng-Tang and its active component Ligusticum chuanxiong promote osteogenic differentiation and decrease the aging process of human mesenchymal stem cells. J Ethnopharmacol. 2017;198:64-72. [54] ALMATROODI SA, A ALSAHLI M, S M ALJOHANI A, et al. Potential therapeutic targets of resveratrol, a plant polyphenol, and its role in the therapy of various types of cancer. Molecules. 2022;27(9):2665. [55] 张大勇,林九洲,王雅艳,等.白藜芦醇通过保护线粒体功能延缓骨髓间充质干细胞衰老[J].浙江大学学报(医学版),2019,48(6):617-624. [56] LV YJ, YANG Y, SUI BD, et al. Resveratrol counteracts bone loss via mitofilin-mediated osteogenic improvement of mesenchymal stem cells in senescence-accelerated mice. Theranostics. 2018;12(12):5334. [57] HE S, ZHOU M, ZHENG H, et al. Resveratrol inhibits the progression of premature senescence partially by regulating v-rel avian reticuloendotheliosis viral oncogene homolog A (RELA) and sirtuin 1 (SIRT1). Ren Fail. 2022;44(1):171-183. [58] LEI LT, CHEN JB, ZHAO YL, et al. Resveratrol attenuates senescence of adipose-derived mesenchymal stem cells and restores their paracrine effects on promoting insulin secretion of INS-1 cells through Pim-1. Eur Rev Med Pharmacol Sci. 2016;20(6):1203-1213. [59] ZHOU T, YAN Y, ZHAO C, et al. Resveratrol improves osteogenic differentiation of senescent bone mesenchymal stem cells through inhibiting endogenous reactive oxygen species production via AMPK activation. Redox Rep. 2019; 24(1):62-69. [60] RACZ LZ, RACZ CP, POP LC, et al. Strategies for improving bioavailability, bioactivity, and physical-chemical behavior of curcumin. Molecules. 2022; 27(20):6854. [61] PIRMORADI S, FATHI E, FARAHZADI R, et al. Curcumin affects adipose tissue-derived mesenchymal stem cell aging through TERT gene expression. Drug Res (Stuttg). 2018;68(4):213-221. [62] SERATI-NOURI H, RASOULPOOR S, POURPIRALI R, et al. In vitro expansion of human adipose-derived stem cells with delayed senescence through dual stage release of curcumin from mesoporous silica nanoparticles/electrospun nanofibers. Life Sci. 2021; 285:119947. [63] DENG J, OUYANG P, LI W, et al. Curcumin alleviates the senescence of canine bone marrow mesenchymal stem cells during in vitro expansion by activating the autophagy pathway. Int J Mol Sci. 2021;22(21):11356. [64] 李娜,张晨,钟赣生,等.不同品种甘草化学成分、药理作用的研究进展及质量标志物(Q-Marker)预测分析[J].中草药,2021,52(24):7680-7692. [65] MAHARAJAN N, GANESAN CD, MOON C, et al. Licochalcone d ameliorates oxidative stress-induced senescence via ampk activation. Int J Mol Sci. 2021;22(14):7324. [66] WU Y, WANG H, ZHU J, et al. Licochalcone A activation of glycolysis pathway has an anti-aging effect on human adipose stem cells. Aging (Albany NY). 2021;13(23):25180-25194. [67] 降瑞婵,刘海亮.甘草中5种活性物质对人脂肪间充质干细胞的抗衰老作用[J].同济大学学报(医学版),2021,42(2):179-186. [68] XU Y, YUAN H, LUO Y, et al. Ganoderic acid D protects human amniotic mesenchymal stem cells against oxidative stress-induced senescence through the PERK/NRF2 signaling pathway. Oxid Med Cell Longev. 2020;27: 8291413. [69] YUAN H, XU Y, LUO Y, et al. Ganoderic acid D prevents oxidative stress‐induced senescence by targeting 14‐3‐3ε to activate CaM/CaMKII/NRF2 signaling pathway in mesenchymal stem cells. Aging cell. 2022;21(9): e13686. [70] 周春根,江滨,倪敏,等.人参皂苷Rg1对间充质干细胞作用的研究进展[J].中华中医药学刊,2021,39(4):130-132, 293。 [71] 汪子铃.人参皂苷Rg1调控Keap1-NRF2-ARE通路延缓骨髓间充质干细胞衰老的机制研究[D].重庆:重庆医科大学,2021. [72] 王爽.人参皂苷Rg1对体外培养人脐带血间充质干细胞衰老的影响[D].遵义:遵义医学院,2013. [73] 张锦明,田滢舟,赵玲,等.淫羊藿苷促进骨髓间充质干细胞成骨分化缓解小鼠骨质疏松的机制[J].中国组织工程研究,2022,26(19):2991-2996. [74] 王鹏珍,孟庆奇,陈松生,等.淫羊藿苷联合碱性成纤维细胞生长因子促进外周血间充质干细胞自我更新[J].中国生物化学与分子生物学报, 2021,37(12):1667-1674. [75] MAHARAJAN N, CHO GW. Camphorquinone promotes the antisenescence effect via activating AMPK/SIRT1 in stem cells and D-galactose-induced aging mice. Antioxidants. 2021;10(12):1916. [76] 韩晓阳,陈悦,杨洋,等.表没食子儿茶素没食子酸酯的抗感染作用研究进展[J].中国现代应用药学,2021,38(20):2616-2620. [77] SHIN JH, JEON HJ, PARK J, et al. Epigallocatechin-3-gallate prevents oxidative stress-induced cellular senescence in human mesenchymal stem cells via Nrf2. Int J Mol Med. 2016;38(4):1075-1082. [78] XIE X, LIU M, MENG Q. Angelica polysaccharide promotes proliferation and osteoblast differentiation of mesenchymal stem cells by regulation of long non-coding RNA H19: an animal study. Bone Joint Res. 2019;8(7):323-332. [79] 耿珊.当归多糖调控CML患者骨髓间充质干细胞衰老抑制白血病干细胞增殖的机理研究[D].重庆:重庆医科大学,2016. [80] 舍雅莉,刘永琦,孙少伯,等.黄芪多糖对甲醛染毒人骨髓间充质干细胞DNA损伤的保护作用[J].中草药,2019,50(12):2928-2933. [81] YANG F, YAN G, LI Y, et al. Astragalus polysaccharide attenuated iron overload-induced dysfunction of mesenchymal stem cells via suppressing mitochondrial ROS. Cell Physiol Biochem. 2016;39(4):1369-1379. [82] NOR MUHAMAD ML, EKEUKU SO, WONG SK, et al. A scoping review of the skeletal effects of naringenin. Nutrients. 2022;14(22):4851. [83] 吴雅廷,刘海亮.柚皮素对脂肪间充质干细胞增殖的影响[J].同济大学学报(医学版),2021,42(1):3-10. [84] YANG Y, CHENG R, LIU J, et al. Linarin protects against cadmium-induced osteoporosis via reducing oxidative stress and inflammation and altering RANK/RANKL/OPG pathway. Biol Trace Elem Re. 2022;200(8):3688-3700. [85] 崔直,王珮琳,滕松松,等.蒙花苷消除衰老骨髓间充质干细胞的衰老表型发挥抗衰老作用[J].现代生物医学进展,2020,20(18):3407-3412. [86] 段婷,瞿鹏飞,瞿浩,等.大麻二酚干预药物成瘾研究进展[J].中国药理学通报, 2020,36(8):1059-1062 [87] 李琳,朱彪,田萧羽,等.大麻二酚对衰老小鼠骨髓间充质干细胞成骨分化影响的体外细胞实验[J].解放军医学院学报,2022,43(1):75-80, 120. [88] SU SH, SUNDHAR N, KUO WW, et al. Artemisia argyi extract induces apoptosis in human gemcitabine-resistant lung cancer cells via the PI3K/MAPK signaling pathway. J Ethnopharmacol. 2022;299:115658. [89] HO TJ, GOSWAMI D, KUO WW, et al. Artemisia argyi exhibits anti-aging effects through decreasing the senescence in aging stem cells. Aging (Albany NY). 2022;14(15):6187-6201. [90] 马艳春,胡建辉,吴文轩,等.黄芪化学成分及药理作用研究进展[J].中医药学报,2022,50(4):92-95. [91] 王焕珍,田永松,杨殿忠,等.黄芪含药血清对D-半乳糖诱导大鼠衰老骨髓间充质干细胞维生素D-FGF23-Klotho轴的影响[J].时珍国医国药,2020,31(8):1833-1836. [92] 李文,顾春松,管连城,等,陈云志,柴艺汇.黄芪对D-半乳糖诱导骨髓间充质干细胞钙结节数、骨钙素mRNA 及蛋白表达水平的影响[J].时珍国医国药,2020,31(11):2586-2590. |
| [1] | Feng Ruiqin, Han Na, Zhang Meng, Gu Xinyi, Zhang Fengshi. Combination of 1% platelet-rich plasma and bone marrow mesenchymal stem cells improves the recovery of peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 985-992. |
| [2] | Qiu Xiaoyan, Li Bixin, Li Jingdi, Fan Chuiqin, Ma Lian, Wang Hongwu. Differentiation of insulin-producing cells from human umbilical cord mesenchymal stem cells infected by MAFA-PDX1 overexpressed lentivirus [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1000-1006. |
| [3] | Liu Qiwei, Zhang Junhui, Yang Yuan, Wang Jinjuan. Role and mechanism of umbilical cord mesenchymal stem cells on polycystic ovary syndrome [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1015-1020. |
| [4] | Sun Teng, Han Yu, Wang Shuang, Li Jialei, Cao Jimin. miR-20a regulates pressure overload-induced cardiac hypertrophy [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1021-1028. |
| [5] | Zhuge Xiaoxuan, Li Ce, Bao Guangjie, Kang Hong. Potential value of canonical and non-canonical roles of connexin 43 in disease treatment [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1130-1136. |
| [6] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [7] | Wang Tihui, Wang Xu, Wu Jinqing, Chen Jiliang, Wang Xiaolu, Miao Juan. Application of three-dimensional simulated osteotomy of the distal femur in total knee arthroplasty [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 905-910. |
| [8] | Liu Changzhen, Liu Xin, Li Yuefei, Wang Jianye, Feng Zhimeng, Sun Zhaozhong. Imaging landmarks of one-hole split endoscope in the treatment of upper lumbar intervertebral disc herniation under the guidance of three-dimensional reconstruction [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 939-944. |
| [9] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [10] | Xue Jingwen, Wang Fangfang, Zhang Xin, Pang Ruifeng, Wang Xiaoye, Ma Xiaoru. Effect of ganoderma spore on mitochondrial autophagy and apoptosis in testicular tissue of diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 562-568. |
| [11] | Wang Shijie, Wen Dengtai, Wang Jingfeng, Gao Yinghui. Mammalian target of rapamycin in relation to exercise, high fat/high salt diet, and aging [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 574-580. |
| [12] | Wei Yuanxun, Chen Feng, Lin Zonghan, Zhang Chi, Pan Chengzhen, Wei Zongbo. The mechanism of Notch signaling pathway in osteoporosis and its prevention and treatment with traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 587-593. |
| [13] | Liu Luxing, Di Mingyuan, Yang Qiang. Signaling pathways in the mechanism underlying active ingredients of Chinese medicine in the treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 609-614. |
| [14] | Yan Binghan, Li Zhichao, Su Hui, Xue Haipeng, Xu Zhanwang, Tan Guoqing. Mechanisms of traditional Chinese medicine monomers in the treatment of osteoarthritis by targeting autophagy [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 627-632. |
| [15] | Lin Feng, Cheng Ling, Gao Yong, Zhou Jianye, Shang Qingqing. Hyaluronic acid hydrogel-encapsulated bone marrow mesenchymal stem cells promote cardiac function in myocardial infarction rats (III) [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 355-359. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||