Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (1): 153-159.doi: 10.12307/2022.026
Previous Articles Next Articles
Research hotspots and application value of tissue-engineered skin
Lin Miaoyuan1, Li Yuwan2, Liu Yi3, Chen Bei1, Zhang Li1
- 1Affiliated Hospital of Zunyi Medical University, Zunyi 563000, Guizhou Province, China; 2Department of Sports Medicine, Peking University Third Hospital, Institute of Sports Medicine of Peking University, Beijing Key Laboratory of Sports Injuries, Beijing 100191, China; 3Department of Joint Surgery, Affiliated Hospital of Zunyi Medical University, Zunyi 563000, Guizhou Province, China
-
Received:2021-01-06Revised:2021-01-08Accepted:2021-02-05Online:2022-01-08Published:2021-10-25 -
Contact:Zhang Li, Professor, Master’s supervisor, Affiliated Hospital of Zunyi Medical University, Zunyi 563000, Guizhou Province, China Li Yuwan, MD, Attending physician, Department of Sports Medicine, Peking University Third Hospital, Institute of Sports Medicine of Peking University, Beijing Key Laboratory of Sports Injuries, Beijing 100191, China -
About author:Lin Miaoyuan, Master candidate, Affiliated Hospital of Zunyi Medical University, Zunyi 563000, Guizhou Province, China -
Supported by:Chinese Postdoctoral Science Foundation, No. 2020M680258 (to LYW)
CLC Number:
Cite this article
Lin Miaoyuan, Li Yuwan, Liu Yi, Chen Bei, Zhang Li. Research hotspots and application value of tissue-engineered skin[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(1): 153-159.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
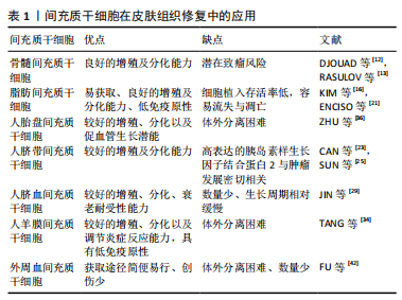
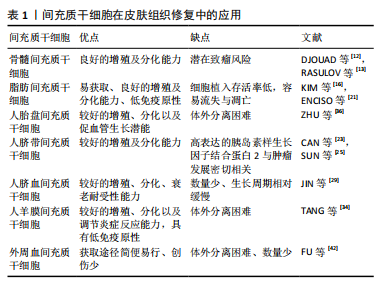
2.1 间充质干细胞 组织工程种子细胞的筛选是构建组织工程皮肤的第一步,不同组织来源间充质干细胞是近年来组织工程化皮肤新兴的种子细胞之一,为此提供丰富的细胞来源。此外,间充质干细胞在创面修复过程各个阶段也扮演了重要的角色。间充质干细胞治疗创面的机制众多,主要有以下4点[7]:①直接分化成皮肤细胞进行组织修复;②抑制免疫细胞增殖,减少促炎细胞因子的表达;③间充质干细胞旁分泌生长因子和细胞因子调控细胞局部反应;④动员其他干细胞发挥组织创面的修复作用。下面简要综述骨髓间充质干细胞、脂肪间充质干细胞、人胎盘间充质干细胞、人脐带间充质干细胞、人脐血间充质干细胞、人羊膜间充质干细胞、外周血间充质干细胞在创面修复中的应用情况。 2.1.1 骨髓间充质干细胞 骨髓间充质干细胞是骨髓中的一类具有干细胞特性的非造血干细胞。1968年FRIEDENSTEIN等首次发现并成功分离出具有多向分化能力的骨髓间充质干细胞,在一定条件下能够分化成骨、成脂、成软骨、成肌肉等多种组织。此外,骨髓间充质干细胞还能分泌促红细胞生成素、巨噬细胞炎性蛋白、趋化因子、血管内皮生长因子、表皮生长因子、角质形成细胞生长因子及其他生物活性分子等,促进新血管形成与皮肤再生。骨髓间充质干细胞主要通过5种移植方式促进皮肤愈合:直接覆盖创面表面、皮下注射、真皮层注射、静脉注射、创面周围注射。研究证实,机体损伤后刺激骨髓间充质干细胞到达受损的器官组织,分泌以上细胞因子和动员其他干细胞增殖分化,从而促进非造血组织修复再生[8]。BADIAVAS等[9]切除小鼠背部皮肤全层,移植绿色荧光蛋白标记的骨髓间充质干细胞,在皮肤伤口部位观察到大量胶原蛋白和角蛋白,明显加速皮肤组织重塑。此外,骨髓间充质干细胞对β射线造成的皮肤损伤创面也有积极影响[10]。FALANGA等[11]以纤维蛋白喷雾形式搭载自体骨髓间充质干细胞治疗皮肤癌术后急性伤口和下肢慢性伤口,大体观察发现两种伤口部位很快长满肉芽组织,较于常规治疗方案,患者伤口愈合时间缩短和疼痛显著缓解。大多数研究结果显示,骨髓间充质干细胞的免疫调节作用有利于皮肤组织再生。然而,有研究将骨髓间充质干细胞和B16黑色素瘤细胞同时局部注射小鼠体内,发现小鼠体内肿瘤组织形成[12],这提示骨髓间充质干细胞的免疫抑制作用存在着促进同种异体动物肿瘤生长的风险,可能与干细胞移植改变体内微环境有关,因此干细胞移植不得不考虑可能带来肿瘤复发的可能。RASULOV等[13]对1例40%深度热烧伤,Ⅲ度占30%的女性患者进行异体骨髓间充质干细胞移植治疗,结果显示骨髓间充质干细胞能够刺激创面新生血管与伤口边缘上皮形成,从而减少瘢痕形成及缩短患者住院时间。虽然上述研究表明,骨髓间充质干细胞对皮肤创伤有积极的治疗作用,但治疗方法通常要求必须培养足够数量的骨髓间充质干细胞,以便局部应用。对于较小的创面,患者尚可提供足够数量的自体骨髓间充质干细胞,但对于创面较大合并有感染时,骨髓间充质干细胞的治疗并非首选治疗方式,当严重的烧伤和创伤发生时,临床中常见抗生素的使用如磺胺嘧啶银,往往会导致骨髓抑制及骨髓间充质干细胞减少[14]。 2.1.2 脂肪间充质干细胞 ZUK等[15]首次从人抽脂术中成功分离出脂肪干细胞。一次微创吸脂手术即可获得大量脂肪间充质干细胞,在烧伤、慢性溃疡、糖尿病足等创面治疗方面,自体脂肪间充质干细胞加速和改善伤口愈合具有明显的可行性及生物安全性。一方面,脂肪间充质干细胞通过其旁分泌作用调节炎症作用,主要分泌多种生长因子包括血管内皮生长因子、碱性成纤维细胞生长因子、肝细胞生长因子等;另一方面脂肪间充质干细胞刺激巨噬细胞释放集落刺激因子、单核细胞趋化蛋白1等。这些因素证实脂肪间充质干细胞能够为机体建立良好的损伤修复微环境,抑制伤口的早期炎症反应,调控局部细胞生长分化,促进新生血管形成,加速胶原合成,从而帮助皮肤组织早期修复[16]。KIM等[17]将脂肪间充质干细胞与皮肤成纤维细胞共培养,发现脂肪间充质干细胞能通过细胞间直接接触和旁分泌功能影响成纤维细胞的增殖、迁徙能力以及胶原合成。SYROMIATNIKOVA等[18] 从脂肪组织中分离出脂肪间充质干细胞和微囊泡,其中释放的外泌体通过传递脂质、蛋白、mRNA和miRNA等,减少紫外线介导的表皮增厚并修复真皮层细胞,有望用于治疗紫外线光老化引起的皮肤损伤。SUARTZ等[19]发现脂肪间充质干细胞能改善小鼠缺血皮瓣的存活率。由于移植的脂肪间充质干细胞直接与外界环境接触,没有任何覆盖物,细胞容易直接流失,造成细胞损伤和死亡,而通过明胶或者明胶复合物覆盖创面后能形成柔韧透明的薄膜,起到固定或者保护创面以及防止脂肪间充质干细胞流失的作用,从而加速创面愈 合[20]。在犬类皮肤创面注射同种异体脂肪间充质干细胞,与对照组相比,实验组创面组织显示出更好的再生能力与治愈速度,无炎症浸润,这表明脂肪间充质干细胞能促进表皮和真皮再生以及重建皮肤功能[21]。然而,国内学者韩兵等[22]将博来霉素注射到裸鼠体内,间隔1 h再注射脂肪间充质干细胞,结果皮肤纤维化受到抑制。此外脂肪间充质干细胞体内存活率低及易发生凋亡,如何提高脂肪间充质干细胞体内植入存活率,是未来临床高效利用脂肪间充质干细胞的关键。 2.1.3 人脐带间充质干细胞 从羊膜、脐带内层、华通胶和血管周围区域等部位获取。与其他成体组织间充质干细胞相比,人脐带间充质干细胞的基因谱接近胚胎干细胞,具有较高的增殖能力及多向分化能力[23]。不同的间充质干细胞具有独特的免疫调控功能,MENG等[24]实验对比人脐带间充质干细胞与人脐血间充质干细胞两种细胞,发现二者都大量分泌凝血酶敏感蛋白1、肿瘤坏死因子α刺激蛋白6、基质金属蛋白酶抑制剂1、白细胞介素8、趋化因子、糖基化抑制剂和胰岛素样生长因子结合蛋白3等,然而,衰老相关型表型CCL2在人脐带间充质干细胞中的表达明显高于人脐血间充质干细胞,说明人脐带间充质干细胞具有较好的衰老耐受性;人脐带间充质干细胞高分泌胰岛素样生长因子结合蛋白1和胰岛素样生长因子结合蛋白2,其中胰岛素样生长因子结合蛋白2与肿瘤发展密切相关[25]。上述这些结果表明人脐带间充质干细胞和人脐血间充质干细胞保留了不同的功能,显示了两种细胞的差异性,在治疗皮肤组织损伤前必须仔细考虑。LIU等[26]用人脐带间充质干细胞治疗大鼠严重烧伤,结果发现人脐带间充质干细胞迁移到伤口,显著减少局部炎性细胞的浸润和白细胞介素1、白细胞介素6、肿瘤坏死因子α的表达,并增加伤口中白细胞介素10和促甲状腺激素6的表达,此外人脐带间充质干细胞组血管内皮生长因子水平、新生血管形成、胶原合成明显高于其他对照组。人脐带间充质干细胞静脉注射到非灵长类动物体内后,目前暂无干细胞移植相关的毒性报道[27]。与其他来源间充质干细胞相比,人脐带间充质干细胞治疗人类疾病具有更加广泛的空间,是一种比较理想的干细胞[28],因此,开展人脐带间充质干细胞治疗皮肤损伤具有深远的意义和价值。 2.1.4 人脐血间充质干细胞 取自分娩孕妇的脐血,经酶提取分离纯化。Jin等[29]实验比较骨髓间充质干细胞、脂肪间充质干细胞和人脐血间充质干细胞,发现三者虽然具有相似的表面抗原表达水平、免疫抑制和分化能力,但是人脐血间充质干细胞具有较高的细胞增殖率和克隆性、衰老耐受性和旁分泌活性,人脐血间充质干细胞更具有天然优势。人脐血间充质干细胞发挥治疗作用在很大程度上是其向炎症部位的有效归巢,VELPULA等[30]发现肿瘤释放的可溶性因子、趋化因子和生长诱导剂如肿瘤坏死因子、肿瘤特异性生长因子,能提高人脐血间充质干细胞的靶向归巢能力,使得人脐血间充质干细胞定向迁移并抑制肿瘤的生长。程文广等[31]用BrdU标记的人脐血间充质干细胞治疗小鼠背部全层皮肤缺损,结果显示组织再上皮化加速,毛囊、汗腺和其他皮肤附属物数量增加。对于脐血中存在间充质干细胞已明确,但由于脐血中间充质干细胞数量较少,生长周期相对缓慢,培养时间较长,这些问题成为制约人脐血间充质干细胞应用的障碍。因此,如何从脐血中分离出更多数量的人脐血间充质干细胞,以及分离后如何体外培养和如何更好地保持人脐血间充质干细胞的增殖活性,有待于进一步的研究。 2.1.5 人羊膜间充质干细胞 人羊膜是母体与胎儿的一层隔膜,由5层组成,包括上皮层、基底膜、致密层、成纤维细胞层和海绵层,属于产后废弃物,存在较少伦理限制,具有较好伸展性、无血管、无神经和淋巴等特点。人羊膜间充质干细胞与骨髓间充质干细胞具有相似的干细胞特性及低免疫原性,但比骨髓间充质干细胞具有更强的体外扩增能力。人羊膜间充质干细胞主要通过分化成皮肤细胞,分泌不同的生长因子、血管调节细胞因子、抗菌肽和各种抗炎剂,促进皮肤伤口愈合[32]。除了可能通过旁分泌作用减轻创面炎症,人羊膜间充质干细胞还可以通过影响巨噬细胞的生物效应对创面炎症进行调节,SHI等[33]发现人羊膜间充质干细胞促进小鼠全层皮肤缺损创面M1型巨噬细胞向M2型巨噬细胞转化,上调抗炎及抗纤维化因子白细胞介素10的表达,下调重要的炎症反应介导因子巨噬细胞炎性蛋白1α和巨噬细胞炎性蛋白2的表达。此外,人羊膜间充质干细胞还可以分泌各种抗血管生成因子,如白细胞介素1受体拮抗剂、基质金属蛋白酶抑制剂4和基质金属蛋白酶抑制剂3,可用于治疗皮肤癌引起的伤口损伤。此外,羊膜基质通过各种类型的细胞外蛋白如胶原、层粘连蛋白和纤连蛋白,表现出理想的促进细胞黏附、增殖和分化的生物支架优势,广泛应用于组织工程,促进组织再生[34]。XIAO等[35]将过表达白细胞介素10基因的重组慢病毒修饰人羊膜间充质干细胞,其显著促进伤口愈合,增强血管生成,调节炎症和细胞外基质,通过多种协同效应促进皮肤再生。因此,修饰靶基因以增加间充质干细胞的生物学效应是治疗伤口损伤的有效策略之一。 2.1.6 人胎盘间充质干细胞 胎盘是胚胎发育中维系母体和胎儿氧气及物质交换的重要器官,由胚胎来源的叶状绒毛膜和母系的底蜕膜共同组成,来源于中、外胚层,含有丰富的间充质干细胞。人胎盘间充质干细胞除了基本表达典型的间充质干细胞表型,还特异性高水平表达白细胞分化抗原(CD200)和肝细胞生长因子。与肝细胞生长因子和CD200阴性的人胎盘间充质干细胞相比,肝细胞生长因子和CD200阳性的细胞在体外表现出促进血管生成的潜能[36]。因此,人胎盘间充质干细胞有望成为组织工程皮肤的细胞来源之一。 2.1.7 外周血间充质干细胞 是一种从外周血液中分离得到的成体干细胞,能够促进皮肤组织的愈合。ZVAIFLER等[37]在正常人血液中首次分离了贴壁生长且具有间充质干细胞形态的一类细胞,这类细胞能够分化为成纤维细胞、成骨细胞、脂肪细胞等,证实了外周血间充质干细胞的存在。多个实验证明外周血间充质干细胞与骨髓间充质干细胞具有相似的表型特征,且外周血间充质干细胞能够动态反映骨重建状 况[38-39],有研究认为外周血间充质干细胞是骨髓间充质干细胞的外周迁移,DALLE CARBONARE等[40]从正常和骨质疏松两类人群的外周血中分离培养间充质干细胞,发现骨质疏松患者外周血间充质干细胞的数量与骨密度呈反比。MARTINELLO 等[41]用同种异体外周血间充质干细胞处理绵羊全层皮肤伤口,能提高浅表损伤和深部损伤的伤口愈合质量,且不诱导炎症反应,并加速肉芽组织、新生血管形成。虽然外周血间充质干细胞比骨髓间充质干细胞(骨髓抽吸)、脂肪间充质干细胞(吸脂术)在获取方式上简便易行、且创伤小,但获得的外周血间充质干细胞数量较少。有研究显示采用粒细胞集落刺激因子动员可增加体外分离的外周血间充质干细胞数量[42]。 各类间充质干细胞的优缺点,见表1。"

2.2 生长因子 皮肤愈合是一个连续的过程,在整个愈合过程中,涉及到多种生长因子参与和多种细胞之间的相互协调作用。目前研究已证实在组织修复过程中,生长因子对种子细胞增殖、分化及趋化、胞外基质合成和血管化形成过程方面起着举足轻重的作用[43]。相关生长因子在皮肤组织愈合方面显示出较好的治疗前景,如转化生长因子β、表皮生长因子、血管内皮生长因子、血小板源性生长因子、碱性成纤维生长因子等,趋化和促进细胞有丝分裂,促进细胞增殖及新生血管,重塑组织,加快伤口愈合。 2.2.1 转化生长因子β 转化生长因子β是一种多功能细胞因子,包括转化生长因子β1、转化生长因子β2、转化生长因子β3亚型,参与细胞免疫调节、增生及分化、胞外基质合成,在创伤修复及瘢痕形成等方面有积极影响[44-45]。研究显示,转化生长因子β使正常的皮肤成纤维细胞表型发生转化以及促进细胞增殖生长,主要通过结合到特定细胞表面配体后增强宿主细胞迁移来促进再上皮化。尽管转化生长因子β家族中的3种亚型分子有着共同高达80%结构相似的氨基酸序列,但在执行功能上有所不同,甚至相反,对创面愈合产生不一样的影响[45]。转化生长因子β3在组织和细胞中的表达变化较大,能够在人皮肤的表皮角质细胞中持续表达。转化生长因子β1介导成人伤口纤维化,而转化生长因子β3促进 胎儿无瘢痕愈合和减少成人瘢痕[46]。同时BOCK等[47]发现:在生长较活跃的增生性瘢痕成纤维细胞中,转化生长因子β2的表达增加,转化生长因子β3的表达则较低;而在皮肤无瘢痕愈合时,转化生长因子β3的表达水平较高,故而推测转化生长因子β1和转化生长因子β2与瘢痕形成有关,而转化生长因子β3与之相反。不同亚型转化生长因子β在创面修复不同时期起着不同的作用,在急性损伤反应期,转化生长因子β1表达明显增加,趋化巨噬细胞和成纤维细胞向伤口迁徙,同时促进成纤维细胞转化为肌成纤维细胞,对于皮肤损伤区炎症反应、上皮再生、血管修复及增加局部血流具有特殊意义;在创伤后期转化生长因子β3表达量逐渐增高,这与创伤后期组织重建及减少瘢痕形成有关[48]。 骨形态发生蛋白也是转化生长因子β超家族成员之一,体外研究表明,骨形态发生蛋白也参与了角质细胞分化的生物学效应,KAISER等[49]发现在皮肤创面边缘角质形成细胞、新形成的上皮角质形成细胞以及创面成纤维细胞中骨形态发生蛋白大量产生,这提示骨形态发生蛋白在修复皮肤创面中发挥了重要的作用。 2.2.2 表皮生长因子 COHEN等[50]首次从小鼠颌下腺中发现表皮生长因子。表皮生长因子主要通过与细胞表面的受体结合,激发酪氨酸激酶活性,启动信号传递,导致多种生物化学变化,活化糖酵解,从而合成DNA、RNA和蛋白质,使细胞进入分裂周期,细胞增殖;同时表皮生长因子促进血管内皮细胞的迁移从而加快受损血管的再生修复。体外实验表明适当浓度的生长因子能够促进间充质干细胞在体外增殖,二者联合构建的组织工程皮肤有利于创面修复及减轻炎症,HUANG等[51]将负载表皮生长因子的骨髓间充质干细胞微球工程皮肤移植到小鼠后腿背部和爪部伤口,发现伤口附近汗腺样结构明显增加,与骨髓间充质干细胞工程皮肤(无表皮生长因子)治疗或仅骨髓间充质干细胞注射结果有所差异(未出现汗腺样结构),这说明生长因子能联合调控皮肤愈合及重建皮肤屏障功能。YOU等[52]将人表皮生长因子基因构建的过表达质粒转染至间充质干细胞内,使得间充质干细胞中高表达表皮生长因子基因,能够显著增加细胞存活率、迁移能力以及细胞黏附分子(catenin、N-cadherin)、细胞动力学分子(cofilin、ezrin)和激酶底物表达,这表明过表达表皮生长因子的间充质干细胞通过增加细胞黏附、动态效应、成纤维细胞迁移和增殖来促进伤口愈合效应,但是其内部的分子信号机制仍需要进一步研究探讨。 2.2.3 血管内皮生长因子 血管内皮生长因子是皮肤血管内最有效的促血管生成因子之一[53],包括血管内皮生长因子A、血管内皮生长因子B、血管内皮生长因子C、血管内皮生长因子D、血管内皮生长因子E和胎盘生长因子,由内皮细胞、角质细胞、成纤维细胞、平滑肌细胞、血小板、中性粒细胞和巨噬细胞产生。血管内皮生长因子结合酪氨酸激酶表面受体Flt-1和KDR,其中KDR是内皮细胞体外趋化和增殖的重要介质,可以刺激宿主内皮细胞的募集和增殖来促进血管形成[54]。血管生成是一个复杂步骤,包括内皮细胞增殖、迁徙、细胞外基质降解和多种生长因子相互配合[55],而血管内皮生长因子在整个过程中起关键作用,可以促进内皮细胞有丝分裂,诱导增殖和迁移。提高血管内皮生长因子持续利用率,是构建血管化组织工程皮肤重中之重,国内外学者提出血管内皮生长因子基因修饰等。ZHANG等[56]研究证实术前皮下注射血管内皮生长因子质粒基因可诱导血管生成,提高皮瓣存活率,这同GIUNTA等[57]研究结果一致。YU等[58]研究壳聚糖纳米粒子负载血管内皮生长因子165治疗大鼠放射性皮肤损伤,结果发现较于其他因子,血管内皮生长因子在抑制细胞凋亡和防止损伤进展方面更有效。转录因子FOXO1是维持心血管内稳态的关键因素,JEON等[59]在FOXO1谱系特异性缺失小鼠中发现,小鼠血管内皮生长因子A表达下降的同时伴随着内皮细胞增殖减少、血管生成减少、再上皮化和肉芽组织形成受损,说明 FOXO1可调节血管内皮生长因子的表达并促进愈合伤口的血管生成。 2.2.4 血小板衍生生长因子 血小板衍生生长因子是具有趋化性的生长因子,来源于脱颗粒血小板、巨噬细胞、血管内皮细胞、成纤维细胞和角质形成细胞等,包括血小板衍生生长因子AA、血小板衍生生长因子AB、血小板衍生生长因子BB、血小板衍生生长因子CC、血小板衍生生长因子DD[60]。皮肤组织损伤后血小板衍生生长因子从脱颗粒的血小板中释放出来,并存在于伤口渗液中,参与伤口愈合的几乎所有阶段。血小板衍生生长因子可以向毛细血管募集周细胞,增加血管的结构完整性;同时血小板衍生生长因子与缺氧诱导因子1α具有协同作用,刺激缺血性损伤部位血管内皮生长因子的表达。1997年美国食品和药物管理局批准贝卡普勒明凝胶(含重组人血小板衍生生长因子BB)治疗糖尿病伤口下肢溃疡。LEE等[61]研究表明负载抗生素/血小板衍生生长因子的聚乳酸-羟基乙酸共聚物纳米纤维可以提供一种非常有效的方法来帮助糖尿病感染创面的组织再生。PAVRAMASIVAM等[62]将过表达血小板衍生生长因子BB基因的质粒转染至骨髓间充质干细胞中,并接种到大鼠烧伤创面,加速了早期烧伤创面的血管生成和组织再生。DEPTULA等[63]从血小板衍生生长因子BB中提取新型肽(PDGF2),发现新型肽对人皮肤细胞有显著促增殖作用,且表现出较低的细胞毒性和低免疫性,因此新型肽是未来促进人类慢性伤口愈合的候选药物之一。 2.2.5 成纤维细胞生长因子 成纤维生长因子家族由23个成员组成,由角质形成细胞、成纤维细胞、内皮细胞、平滑肌细胞、软骨细胞和肥大细胞等释放。成纤维生长因子2、成纤维生长因子7和成纤维生长因子10是皮肤伤口愈合中3个最重要的成员。成纤维生长因子与肝素或硫酸乙酰肝素蛋白聚糖有着较高亲和力,这稳定了成纤维生长因子的热变性和蛋白水解,限制扩散。最重要的是,与肝素或硫酸乙酰肝素蛋白聚糖的相互作用对于信号受体的激活至关重要[64]。正常成纤维生长因子/成纤维生长因子受体信号有助于保护皮肤免受紫外线损伤以及伤口愈合期间皮肤表面的扩张。然而,成纤维细胞和角质形成细胞也可以通过这种方式以旁分泌的方式控制黑素细胞的增殖和存活,这意味着成纤维生长因 子/成纤维生长因子受体信号失衡将有可能导致皮肤癌[65]。成纤维生长因子2加速皮肤伤口中成纤维细胞和内皮细胞的生长,促进肉芽组织形成、再上皮化和组织重塑等, TAKABAYASHI等[66]将含成纤维生长因子2的达肝素/鱼精蛋白纳米粒子移植到紫外线诱导的无毛小鼠皮肤,与对照组比较,小鼠的成纤维细胞和表皮角质形成细胞凋亡比例明显降低,延缓无毛小鼠的皮肤光老化。ROBSON等[67]局部应用重组人角质细胞生长因子2治疗静脉溃疡伤口愈合。此外,成纤维生长因子7和成纤维生长因子10有很高相似的蛋白质序列且都是角质形成细胞的有丝分裂原,统称为角质形成细胞生长因子,作用于皮肤上皮化[68]。 单一运用生长因子疗效不强,且生长因子作用效果并非一成不变,具有协同性、时效性。BAKHSHAYESH等[69]联合使用转化生长因子β和碱性成纤维生长因子治疗伤口,发现外周血干细胞和骨髓间充质干细胞显著向伤口部位的迁移和募集。PEPLOW等[43]对角质细胞迁移进行划痕实验,同时测试单个或多个生长因子组合对伤口愈合效果,结果发现14种不同的生长因子和细胞因子在划痕损伤实验中均显示出促细胞迁移作用,能够加速上皮化和伤口愈合,尤其转化生长因子β1和肝细胞生长因子,胰岛素样生长因子1和表皮生长因子,两种因子组合比单独的任一种更能刺激细胞向外迁移,此外成纤维生长因子2和转化生长因子β1,肝细胞生长因子和转化生长因子β1,血小板衍生生长因子和表皮生长因子,血小板衍生生长因子和转化生长因子β,血小板衍生生长因子和胰岛素样生长因子1,成纤维生长因子2和胰岛素样生长因子2的联合在体内也显示出增强伤口愈合的效果[43]。 RINSCH等[70]采用了一种细胞包裹的体外基因治疗方法,以连续和局部的方式递送血管内皮生长因子和成纤维生长因子2,结果发现包封细胞递送成纤维生长因子2,但不递送血管内皮生长因子,在治疗急性皮肤缺血和改善皮瓣存活方面比成纤维生长因子2和血管内皮生长因子121或血管内皮生长因子165联合传递更有效,这可能是不同浓度成纤维生长因子和血管内皮生长因子联合使用存在拮抗作用。 不同生长因子在皮肤组织修复中的作用,见表2。 2.3 支架材料 构建组织工程化皮肤所选择的支架材料应拥有合理的机械强度和生物相容性,为种子细胞黏附、增殖及发挥功能提供场所,且增强组织工程皮肤与局部正常皮肤组织相整合,同时创造一种特定的微环境来控制和引导种子细胞与宿主皮肤组织形成新的组织形态,从而加速创面的再生修复。支架材料主要包括天然生物支架材料、合成生物支架材料、复合支架。 天然生物支架材料大部分与细胞外基质相似,细胞外基质调节细胞迁移、黏附、增殖、分化、存活、细胞间通讯等[71],其中胶原是细胞外基质的主要成分,胶原支架能够较好搭载成纤维细胞并保持细胞活性与增殖速率,刺激伤口愈合加快,更重要的是毒性较低,不同动物来源的胶原蛋白支架可以有效地将伤口修复至全层[72]。对急性损伤造成的伤口应优先考虑停止出血,天然止血活性材料引起人们关注,最近学者研究发现三丁基海藻酸铵(TBA-Alg)天然材料有着较佳的溶胀率和抗溶血性[73]。此外还有许多天然生物材料用于构建组织工程皮肤如壳聚糖、海藻酸盐、透明质酸、水凝胶等。 为进一步增强生物材料的生物稳定性,越来越多的人工合成生物材料在组织工程领域广泛应用。纳米材料支架具有较好的比表面积和三维微孔结构,多孔性质允许细胞生长和营养物质的适当交换,以模拟细胞外基质的构建[71]。将其植入宿主体内,具有较好的透气性,防止外源性细菌渗入伤口,允许伤口渗液的排出,保护伤口不脱水。ARASTEH等[74] 将静电纺丝素纳米纤维包裹人羊膜制备双层皮肤替代物,结果在小鼠伤口区域观察到表皮和真皮再生。此外,海绵状或泡沫状支架具有较大的孔隙率,为细胞提供较好的载体,NAMVIRIYACHOTE等[75]制备多种生物大分子聚氨酯组合泡沫敷料,在健康志愿者身上,此泡沫敷料不会引起皮肤刺激,在创伤性皮肤伤口患者中,聚氨酯泡沫敷料促进伤口闭合时间短、再上皮化快和疼痛评分低。细胞对支架的黏附和支架降解速率之间的平衡是促进新组织形成的关键因素,然而人工合成生物材料降解时往往产生酸性产物,对局部细胞造成损伤。 单一的材料难以同时满足力学强度与生物相容性方面的需求,综合天然材料与人工合成材料各自优点制备复合材料,为组织工程皮肤支架材料提供一个新的思路[71]。复合生物材料可以由不同的天然或合成聚合物组成,或者由二者组合而成,如聚乳酸-羟基乙酸共聚物支架[61]。CHEN等[76]研究表明与单一材料比较,透明质酸海藻酸盐复合粉末(RapidClot)显示出更优的体外止血活性和生物相容性。TORT等[77]研究认为纳米纤维负载胶原多西环素伤口敷料用于急性或慢性伤口治疗,创建两类伤口模型:正常血糖组(急性伤口)和高血糖组(慢性伤口),结果发现该敷料抗氧化能力增强和脂质过氧化降低,缩短炎症期和加速新血管形成,与市场销售的敷料具有相似的功能。 就构建组织工程化皮肤而言,理想的支架材料应有较好的组织相容性、机械强度和生物降解性[71]。组织工程化支架材料和新型创面敷料的开发对创面修复具有重要的研究价值和临床意义,其在组织修复过程中的分子机制和生物学过程仍需要进一步探讨和验证。 "

| [1] RANI S, RITTER T. The Exosome - A Naturally Secreted Nanoparticle and its Application to Wound Healing. Adv Mater. 2016;28(27):5542-5552. [2] TRICCO AC, COGO E, ISARANUWATCHAI W, et al. A systematic review of cost-effectiveness analyses of complex wound interventions reveals optimal treatments for specific wound types. BMC Med. 2015;13:90. [3] GUO S, DIPIETRO LA. Factors affecting wound healing. J Dent Res. 2010; 89(3):219-229. [4] MOON HS, BURM JS, YANG WY, et al. Prognosis of full-thickness skin defects in premature infants. Arch Plast Surg. 2012;39(5):463-468. [5] VIG K, CHAUDHARI A, TRIPATHI S, et al. Advances in Skin Regeneration Using Tissue Engineering. Int J Mol Sci. 2017;18(4):789. [6] 王新刚,吴攀,翁婷婷,等.浅议目前组织工程皮肤研发面临的关键问题[J].中华损伤与修复杂志,2017,12(3):164-168. [7] POOL M, LEUVENINK H, MOERS C. Reparative and Regenerative Effects of Mesenchymal Stromal Cells-Promising Potential for Kidney Transplantation? Int J Mol Sci. 2019;20(18):4614. [8] BADIAVAS EV. The potential of bone marrow cells to orchestrate homeostasis and healing in skin. Blood Cells Mol Dis. 2004;32(1):21-23. [9] BADIAVAS EV, ABEDI M, BUTMARC J, et al. Participation of bone marrow derived cells in cutaneous wound healing. J Cell Physiol. 2003;196(2):245-250. [10] 沈国良,苏本玄,林伟,等.β射线照射皮肤损伤创面注射骨髓间充质干细胞后的创面愈合[J].中国组织工程研究,2013,17(6):951-956. [11] FALANGA V, IWAMOTO S, CHARTIER M, et al.Autologous bone marrow-derived cultured mesenchymal stem cells delivered in a fibrin spray accelerate healing in murine and human cutaneous wounds. Tissue Eng. 2007;13(6):1299-1312. [12] DJOUAD F, PLENCE P, BONY C, et al. Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals. Blood. 2003;102(10):3837-3844. [13] RASULOV MF, VASILCHENKOV AV, ONISHCHENKO NA, et al. First experience of the use bone marrow mesenchymal stem cells for the treatment of a patient with deep skin burns. Bull Exp Biol Med. 2005;139(1):141-144. [14] GAMELLI RL, PAXTON TP, O’REILLY M. Bone marrow toxicity by silver sulfadiazine. Surg Gynecol Obstet. 1993;177(2):115-120. [15] ZUK PA, ZHU M, ASHJIAN P, et al. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell. 2002;13(12):4279-4295. [16] KIM WS, PARK BS, SUNG JH. Protective role of adipose-derived stem cells and their soluble factors in photoaging. Arch Dermatol Res. 2009;301(5): 329-336. [17] KIM WS, PARK BS, SUNG JH, et al. Wound healing effect of adipose-derived stem cells: a critical role of secretory factors on human dermal fibroblasts. J Dermatol Sci. 2007;48(1):15-24. [18] SYROMIATNIKOVA V, IDRISOVA K, MASGUTOVA G, et al. Analyzing the Effectiveness of Adipose Tissue Stem Cell and Microvesicle Therapy in Premature Skin Aging Caused by Chronic Exposure to Ultraviolet Radiation. BioNanoScience. 2020;10(4): 991-997. [19] SUARTZ CV, GAIBA S, FRANÇA JP, et al. Adipose-derived stem cells (ADSC) in the viability of random skin flap in rats. Acta Cir Bras. 2014;29 Suppl 2:6-9. [20] TYEB S, SHIEKH PA, VERMA V, et al. Adipose-Derived Stem Cells (ADSCs) Loaded Gelatin-Sericin-Laminin Cryogels for Tissue Regeneration in Diabetic Wounds. Biomacromolecules. 2020;21(2):294-304. [21] ENCISO N, AVEDILLO L, FERMÍN ML, et al. Regenerative potential of allogeneic adipose tissue-derived mesenchymal cells in canine cutaneous wounds. Acta Vet Scand. 2020;62(1):13. [22] 韩兵,范金财.脂肪间充质干细胞在抑制博来霉素诱导裸鼠皮肤纤维化方面的作用[J].中华整形外科杂志,2019,35(2):182-188. [23] CAN A, KARAHUSEYINOGLU S. Concise review: human umbilical cord stroma with regard to the source of fetus-derived stem cells. Stem Cells. 2007; 25(11):2886-2895. [24] MENG X, SUN B, XIAO Z. Comparison in transcriptome and cytokine profiles of mesenchymal stem cells from human umbilical cord and cord blood. Gene. 2019;696:10-20. [25] SUN L, ZHANG X, SONG Q, et al. IGFBP2 promotes tumor progression by inducing alternative polarization of macrophages in pancreatic ductal adenocarcinoma through the STAT3 pathway. Cancer Lett. 2021;500:132-146. [26] LIU L, YU Y, HOU Y, et al. Human umbilical cord mesenchymal stem cells transplantation promotes cutaneous wound healing of severe burned rats. PLoS One. 2014;9(2):e88348. [27] WANG Y, HAN ZB, MA J, et al. A toxicity study of multiple-administration human umbilical cord mesenchymal stem cells in cynomolgus monkeys. Stem Cells Dev. 2012;21(9):1401-1408. [28] DING DC, CHANG YH, SHYU WC, et al. Human umbilical cord mesenchymal stem cells: a new era for stem cell therapy. Cell Transplant. 2015;24(3):339-347. [29] JIN HJ, BAE YK, KIM M, et al. Comparative analysis of human mesenchymal stem cells from bone marrow, adipose tissue, and umbilical cord blood as sources of cell therapy. Int J Mol Sci. 2013;14(9):17986-18001. [30] VELPULA KK, DASARI VR, RAO JS. The homing of human cord blood stem cells to sites of inflammation: unfolding mysteries of a novel therapeutic paradigm for glioblastoma multiforme. Cell Cycle. 2012;11(12):2303-2313. [31] 程文广,黄正根,贺伟峰,等.应用人脐带血间充质干细胞修复小鼠皮肤缺损创面[J].中华创伤杂志,2008,24(4):298-301. [32] FARHADIHOSSEINABADI B, FARAHANI M, TAYEBI T, et al. Amniotic membrane and its epithelial and mesenchymal stem cells as an appropriate source for skin tissue engineering and regenerative medicine. Artif Cells Nanomed Biotechnol. 2018;46(sup2):431-440. [33] SHI CS, WANG DL, SUN J, et al. Influence of human amniotic mesenchymal stem cells on macrophage phenotypes and inflammatory factors in full-thickness skin wounds of mice. Zhonghua Shao Shang Za Zhi. 2020;36(4): 288-296. [34] TANG K, WU J, XIONG Z, et al. Human acellular amniotic membrane: A potential osteoinductive biomaterial for bone regeneration. J Biomater Appl. 2018;32(6):754-764. [35] XIAO S, HUANG G, WEI Z, et al. IL-10 Gene-Modified Human Amniotic Mesenchymal Stem Cells Augment Regenerative Wound Healing by Multiple Synergistic Effects. Stem Cells Int. 2019;2019:9158016. [36] ZHU Y, YANG Y, ZHANG Y, et al. Placental mesenchymal stem cells of fetal and maternal origins demonstrate different therapeutic potentials. Stem Cell Res Ther. 2014;5(2):48. [37] ZVAIFLER NJ, MARINOVA-MUTAFCHIEVA L, ADAMS G, et al. Mesenchymal precursor cells in the blood of normal individuals. Arthritis Res. 2000;2(6): 477-488. [38] LI S, HUANG KJ, WU JC, et al. Peripheral blood-derived mesenchymal stem cells: candidate cells responsible for healing critical-sized calvarial bone defects. Stem Cells Transl Med. 2015;4(4):359-368. [39] HE Q, WAN C, LI G. Concise review: multipotent mesenchymal stromal cells in blood. Stem Cells. 2007;25(1):69-77. [40] DALLE CARBONARE L, VALENTI MT, ZANATTA M, et al. Circulating mesenchymal stem cells with abnormal osteogenic differentiation in patients with osteoporosis. Arthritis Rheum. 2009;60(11):3356-3365. [41] MARTINELLO T, GOMIERO C, PERAZZI A, et al. Allogeneic mesenchymal stem cells improve the wound healing process of sheep skin. BMC Vet Res. 2018;14(1):202. [42] FU WL, ZHOU CY, YU JK. A new source of mesenchymal stem cells for articular cartilage repair: MSCs derived from mobilized peripheral blood share similar biological characteristics in vitro and chondrogenesis in vivo as MSCs from bone marrow in a rabbit model. Am J Sports Med. 2014; 42(3):592-601. [43] PEPLOW PV, CHATTERJEE MP. A review of the influence of growth factors and cytokines in in vitro human keratinocyte migration. Cytokine. 2013; 62(1):1-21. [44] MONTESANO R, ORCI L. Transforming growth factor beta stimulates collagen-matrix contraction by fibroblasts: implications for wound healing. Proc Natl Acad Sci U S A. 1988;85(13):4894-4897. [45] SHAH M, FOREMAN DM, FERGUSON MW. Neutralisation of TGF-beta 1 and TGF-beta 2 or exogenous addition of TGF-beta 3 to cutaneous rat wounds reduces scarring. J Cell Sci. 1995;108 ( Pt 3):985-1002. [46] LICHTMAN MK, OTERO-VINAS M, FALANGA V. Transforming growth factor beta (TGF-beta) isoforms in wound healing and fibrosis. Wound Repair Regen. 2016;24(2):215-222. [47] BOCK O, YU H, ZITRON S, et al. Studies of transforming growth factors beta 1-3 and their receptors I and II in fibroblast of keloids and hypertrophic scars. Acta Derm Venereol. 2005;85(3):216-220. [48] 赵佳佳,杨丕波,韩传火,等.大鼠皮肤创伤修复过程中转化生长因子β1和β3的表达[J].中国组织工程研究,2013,17(20):3643-3649. [49] KAISER S, SCHIRMACHER P, PHILIPP A, et al. Induction of bone morphogenetic protein-6 in skin wounds. Delayed reepitheliazation and scar formation in BMP-6 overexpressing transgenic mice. J Invest Dermatol. 1998;111(6):1145-1152. [50] COHEN S. Isolation of a mouse submaxillary gland protein accelerating incisor eruption and eyelid opening in the new-born animal. J Biol Chem. 1962;237:1555-1562. [51] HUANG S, LU G, WU Y, et al. Mesenchymal stem cells delivered in a microsphere-based engineered skin contribute to cutaneous wound healing and sweat gland repair. J Dermatol Sci. 2012;66(1):29-36. [52] YOU DH, NAM MJ. Effects of human epidermal growth factor gene-transfected mesenchymal stem cells on fibroblast migration and proliferation. Cell Prolif. 2013;46(4):408-415. [53] DETMAR M. The role of VEGF and thrombospondins in skin angiogenesis. J Dermatol Sci. 2000;24 Suppl 1:S78-84. [54] FONG GH, ROSSANT J, GERTSENSTEIN M, et al. Role of the Flt-1 receptor tyrosine kinase in regulating the assembly of vascular endothelium. Nature. 1995;376(6535):66-70. [55] TERMAN BI, DOUGHER-VERMAZEN M, CARRION ME, et al. Identification of the KDR tyrosine kinase as a receptor for vascular endothelial cell growth factor. Biochem Biophys Res Commun. 1992;187(3):1579-1586. [56] ZHANG F, YANG F, HU EC, et al. Vascular endothelial growth factor gene therapy in improvement of skin paddle survival in a rat TRAM flap model. J Reconstr Microsurg. 2005;21(6):391-396. [57] GIUNTA RE, HOLZBACH T, TASKOV C, et al. AdVEGF165 gene transfer increases survival in overdimensioned skin flaps. J Gene Med. 2005;7(3): 297-306. [58] YU D, LI S, WANG S, et al. Development and Characterization of VEGF165-Chitosan Nanoparticles for the Treatment of Radiation-Induced Skin Injury in Rats. Mar Drugs. 2016;14(10):182. [59] JEON HH, YU Q, LU Y, et al. FOXO1 regulates VEGFA expression and promotes angiogenesis in healing wounds. J Pathol. 2018;245(3):258-264. [60] BOWEN-POPE DF, RAINES EW. History of discovery: platelet-derived growth factor. Arterioscler Thromb Vasc Biol. 2011;31(11):2397-2401. [61] LEE CH, LIU KS, CHENG CW, et al. Codelivery of Sustainable Antimicrobial Agents and Platelet-Derived Growth Factor via Biodegradable Nanofibers for Repair of Diabetic Infectious Wounds. ACS Infect Dis. 2020;6(10):2688-2697. [62] PARAMASIVAM T, MAITI SK, PALAKKARA S, et al. Effect of PDGF-B Gene-Activated Acellular Matrix and Mesenchymal Stem Cell Transplantation on Full Thickness Skin Burn Wound in Rat Model. Tissue Eng Regen Med. 2020 Nov 3. doi: 10.1007/s13770-020-00302-3. Online ahead of print. [63] DEPTUŁA M, KARPOWICZ P, WARDOWSKA A, et al. Development of a Peptide Derived from Platelet-Derived Growth Factor (PDGF-BB) into a Potential Drug Candidate for the Treatment of Wounds. Adv Wound Care (New Rochelle). 2020;9(12):657-675. [64] POWERS CJ, MCLESKEY SW, WELLSTEIN A. Fibroblast growth factors, their receptors and signaling. Endocr Relat Cancer. 2000;7(3):165-197. [65] CZYZ M. Fibroblast Growth Factor Receptor Signaling in Skin Cancers. Cells. 2019;8(6):540. [66] TAKABAYASHI Y, KUWABARA M, SATO Y, et al. FGF-2-containing dalteparin/protamine nanoparticles (FGF-2&D/P NPs) ameliorate UV-induced skin photoaging in hairless mice. J Plast Surg Hand Surg. 2018;52(6):375-381. [67] ROBSON MC, PHILLIPS TJ, FALANGA V, et al. Randomized trial of topically applied repifermin (recombinant human keratinocyte growth factor-2) to accelerate wound healing in venous ulcers. Wound Repair Regen. 2001;9(5):347-352. [68] TAGASHIRA S, HARADA H, KATSUMATA T, et al. Cloning of mouse FGF10 and up-regulation of its gene expression during wound healing. Gene. 1997;197(1-2):399-404. [69] BAKHSHAYESH M, SOLEIMANI M, MEHDIZADEH M, et al. Effects of TGF-β and b-FGF on the potential of peripheral blood-borne stem cells and bone marrow-derived stem cells in wound healing in a murine model. Inflammation. 2012;35(1):138-142. [70] RINSCH C, QUINODOZ P, PITTET B, et al. Delivery of FGF-2 but not VEGF by encapsulated genetically engineered myoblasts improves survival and vascularization in a model of acute skin flap ischemia. Gene Ther. 2001;8(7): 523-533. [71] CHAUDHARI AA, VIG K, BAGANIZI DR, et al. Future Prospects for Scaffolding Methods and Biomaterials in Skin Tissue Engineering: A Review. Int J Mol Sci. 2016;17(12):1974. [72] GIL-CIFUENTES L, JIMÉNEZ RA, FONTANILLA MR. Evaluation of collagen type I scaffolds including gelatin-collagen microparticles and Aloe vera in a model of full-thickness skin wound. Drug Deliv Transl Res. 2019;9(1):25-36. [73] ZARE-GACHI M, DAEMI H, MOHAMMADI J, et al. Improving anti-hemolytic, antibacterial and wound healing properties of alginate fibrous wound dressings by exchanging counter-cation for infected full-thickness skin wounds. Mater Sci Eng C Mater Biol Appl. 2020;107:110321. [74] ARASTEH S, KHANJANI S, GOLSHAHI H, et al. Efficient Wound Healing Using a Synthetic Nanofibrous Bilayer Skin Substitute in Murine Model. J Surg Res. 2020;245:31-44. [75] NAMVIRIYACHOTE N, MUANGMAN P, CHINAROONCHAI K, et al. Polyurethane-biomacromolecule combined foam dressing containing asiaticoside: fabrication, characterization and clinical efficacy for traumatic dermal wound treatment. Int J Biol Macromol. 2020;143:510-520. [76] CHEN YW, LU CH, SHEN MH, et al. In vitro evaluation of the hyaluronic acid/alginate composite powder for topical haemostasis and wound healing. Int Wound J. 2020;17(2):394-404. [77] TORT S, DEMIRÖZ FT, COŞKUN CEVHER Ş, et al. The effect of a new wound dressing on wound healing: Biochemical and histopathological evaluation. Burns. 2020;46(1):143-155. [78] SHAKESPEARE PG. The role of skin substitutes in the treatment of burn injuries. Clin Dermatol. 2005;23(4):413-418. |
| [1] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1316-1322. |
| [2] | Xiao Hao, Liu Jing, Zhou Jun. Research progress of pulsed electromagnetic field in the treatment of postmenopausal osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1323-1329. |
| [3] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1330-1335. |
| [4] | Tian Chuan, Zhu Xiangqing, Yang Zailing, Yan Donghai, Li Ye, Wang Yanying, Yang Yukun, He Jie, Lü Guanke, Cai Xuemin, Shu Liping, He Zhixu, Pan Xinghua. Bone marrow mesenchymal stem cells regulate ovarian aging in macaques [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1033-1039. |
| [5] | Hou Jingying, Guo Tianzhu, Yu Menglei, Long Huibao, Wu Hao. Hypoxia preconditioning targets and downregulates miR-195 and promotes bone marrow mesenchymal stem cell survival and pro-angiogenic potential by activating MALAT1 [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1053-1059. |
| [6] | Zhou Ying, Zhang Huan, Liao Song, Hu Fanqi, Yi Jing, Liu Yubin, Jin Jide. Immunomodulatory effects of deferoxamine and interferon gamma on human dental pulp stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1060-1067. |
| [7] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1183-1190. |
| [8] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1191-1197. |
| [9] | Liang Xuezhen, Yang Xi, Li Jiacheng, Luo Di, Xu Bo, Li Gang. Bushen Huoxue capsule regulates osteogenic and adipogenic differentiation of rat bone marrow mesenchymal stem cells via Hedgehog signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1068-1074. |
| [10] | Fang Xiaolei, Leng Jun, Zhang Chen, Liu Huimin, Guo Wen. Systematic evaluation of different therapeutic effects of mesenchymal stem cell transplantation in the treatment of ischemic stroke [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1133-1140. |
| [11] | Guo Jia, Ding Qionghua, Liu Ze, Lü Siyi, Zhou Quancheng, Gao Yuhua, Bai Chunyu. Biological characteristics and immunoregulation of exosomes derived from mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1141-1150. |
| [12] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1151-1155. |
| [13] | Zhou Hongqin, Wu Dandan, Yang Kun, Liu Qi. Exosomes that deliver specific miRNAs can regulate osteogenesis and promote angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1156-1162. |
| [14] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1163-1169. |
| [15] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1170-1176. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||