Chinese Journal of Tissue Engineering Research ›› 2021, Vol. 25 ›› Issue (25): 4089-4094.doi: 10.12307/2021.025
Previous Articles Next Articles
Regulatory effect of exosomes on exercise-mediated insulin resistance diseases
Chen Ziyang1, Pu Rui1, Deng Shuang2, Yuan Lingyan1
- 1Institute of Physical Education, Shanghai Normal University, Shanghai 200234, China; 2Institute of Healthy, Shanghai Normal University Tianhua College, Shanghai 201815, China
-
Received:2020-09-05Revised:2020-09-08Accepted:2020-10-24Online:2021-09-08Published:2021-01-20 -
Contact:Yuan Lingyan, MD, Professor, Doctoral supervisor, Institute of Physical Education, Shanghai Normal University, Shanghai 200234, China -
About author:Chen Ziyang, Master candidate, Institute of Physical Education, Shanghai Normal University, Shanghai 200234, China Pu Rui, Master candidate, Institute of Physical Education, Shanghai Normal University, Shanghai 200234, China -
Supported by:the National Natural Science Foundation of China, No. 31371196
CLC Number:
Cite this article
Chen Ziyang, Pu Rui, Deng Shuang, Yuan Lingyan. Regulatory effect of exosomes on exercise-mediated insulin resistance diseases[J]. Chinese Journal of Tissue Engineering Research, 2021, 25(25): 4089-4094.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
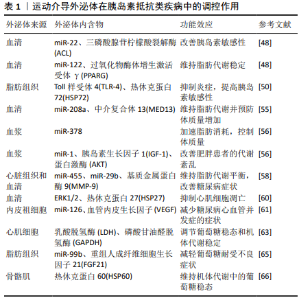
2.1 外泌体概述 外泌体是一类呈“碟状”特征形态并具有细胞特异性脂质双分子层亚细胞结构的囊泡[7]。外泌体最初被认为是从肿瘤细胞系中释放出来的含有5'核苷酸酶活性的微泡[8]。1983年PAN等[9]发现绵羊网织红细胞成熟过程中释放出微泡,这些微泡存在于大的多泡体中,此后又观察到此过程可能与转铁蛋白受体脱落以及胞体的胞吐作用有关,通过质膜内陷过程导致细胞内囊泡分泌到细胞外环境中[10]。 1987年JOHNSTONE等[11]首次将这种从细胞内分泌出来的囊泡命名为外泌体。 外泌体的形成始于质膜上蛋白质的内吞作用,这些蛋白质进入早期核内体,在早期核内体被回收到细胞表面或沿着核内体途径进一步加工形成晚期核内体,晚期核内体外膜内凹形成内囊泡和多泡体,最后多泡体与质膜融合,并将内囊泡释放到细胞外环境形成外泌体[12]。外泌体含大量丰富的活性物质如mRNA、miRNA和蛋白质等内含物[13]。目前能识别外泌体的最常见蛋白质包括:转膜蛋白、融合蛋白、热休克蛋白、多泡体生物合成的相关蛋白以及CD9、CD63、CD81、CD82等四次跨膜蛋白、磷脂酶和脂质相关蛋白以及与外泌体来源相关的细胞特异性蛋白[14]。研究表明许多细胞都有释放外泌体的能力,包括网织红细胞、树突状细胞、B细胞、T细胞、肥大细胞、上皮细胞和肿瘤细胞等细胞。此外在血液、尿液、羊水、恶性腹水、支气管肺泡灌洗液、滑膜液和母乳等体液中等也能发现外泌体[15-16],这使得外泌体在来源方面取得新进展[17],也为包括胰岛素抵抗在内许多疾病的诊断、治疗提供新的思路与解决方案。 2.2 外泌体在胰岛素抵抗类疾病中的诊断与治疗 外泌体已被证明是包括癌症、心血管疾病诊疗的新方向[18]。近些年有研究表明外泌体与胰岛素抵抗类疾病的发生发展关系密切,外泌体可携带其内含物通过细胞间通讯作用在肥胖和2型糖尿病等疾病的诊断与治疗中发挥重要作用,已成为胰岛素抵抗类疾病诊疗的新靶点。 2.2.1 外泌体在胰岛素抵抗类疾病中的诊断作用 外泌体广泛参与胰岛素抵抗类疾病的发生发展,并可作为生物标记物在胰岛素抵抗类疾病诊断中发挥重要作用,其中miRNA扮演重要角色。miRNA是自然产生的长度为21-25个核苷酸的非编码RNA,参与转录后基因表达调控[19],而外泌体miRNA对生物信息的调节发挥着相同作用[20],最初的研究主要集中在癌症方向,如外泌体miRNA用于早期胃癌的诊断[16]。由于外泌体在体液中的普遍性及其稳定性,最近已被研究作为肥胖、2型糖尿病诊断和预后的潜在生物标记物[21-22]。 (1)外泌体在肥胖中的诊断作用:肥胖患者血清外泌体及其miRNA变化在肥胖诊断中发挥重要作用。SONG等[23] 发现肥胖患者血液循环外泌体水平、运载物质和功能均发生改变,且胰岛素抵抗提高了进入血液循环中外泌体的分泌量。同样,在肥胖等病理条件下,脂肪细胞分泌的外泌体数量及功能均发生显著性变化,其miRNA在生物信息调控中发挥重要作用[24-25]。XU等[26]发现miR-26a在超重人群的血清外泌体中含量较低,并且与肥胖的临床特征呈负相关。此外,肥胖患者内脏脂肪细胞分泌的外泌体miRNA表达谱与健康对照具有显著差异,这些差异性表达miRNA通过调节其靶基因参与基因转录、胰岛素分泌和脂质代谢等过程,为肥胖及肥胖相关疾病的发病机制研究提供了新的视角[27]。另有研究发现,与健康个体相比,肥胖患者血清外泌体miRNA和蛋白表达发生显著性变化,使得特定的外泌体内含物有可能成为诊断肥胖的生物标志物[28]。 (2)外泌体在2型糖尿病中的诊断作用:最近研究发现,外泌体在2型糖尿病病理模型中数量发生了变化,在实验中也证明了外泌体分泌的miRNA和相关蛋白与健康个体存在显著差异。在2型糖尿病患者体内血液循环中miRNA浓度显著升高,表明这些产生显著性变化的循环外泌体miRNA可被视为2型糖尿病的预测因子。此后的研究也逐渐证明外泌体作为2型糖尿病的生物标记物发挥其早期诊断作用,如2型糖尿病患者血清外泌体miR-27a和miR-320表达显著降低[29]。此外,EISSA等[30]研究发现与胰岛素信号有关的磷酸胰岛素受体和瘦素受体等蛋白,在2型糖尿病患者血清外泌体中表达降低。这些研究表明,血清外泌体miRNA和相关蛋白的变化成为了2型糖尿病诊断的突破口。此外,除了血清外泌体,尿液外泌体也会在2型糖尿病中发生相应变化[22]。 综上所述,外泌体及其miRNA水平与胰岛素抵抗类疾病发生发展关系密切,可作为其诊断的生物标记物。同时外泌体miRNA水平变化也反映胰岛素抵抗类疾病的发展进程。但不同细胞来源外泌体其组成与功能不同,且研究主要局限于血清与尿液外泌体中,后续研究仍需对不同来源外泌体在疾病中的诊断作用进行验证,为胰岛素抵抗类疾病诊断提供多元化的选择。 2.2.2 外泌体在胰岛素抵抗类疾病中的治疗作用 研究发现,肝细胞、脂肪组织、血浆中的外泌体均可在肥胖中发挥治疗作用;而外泌体在2型糖尿病中发挥治疗作用,目前主要集中于脂肪组织来源外泌体。 (1)外泌体在肥胖中的治疗作用:肥胖是一种与胰岛素抵抗关系密切且病因复杂的代谢疾病,由个体的遗传、代谢或环境之间的相互作用引起,会导致人体代谢异常,增加心、肝脏等器官的负担[31]。 肥胖发生的主要机制与肝脏和脂肪组织的调节密切相关。肝脏外泌体miR-130a-3p可通过介导肝脏与脂肪组织之间的通讯来维持机体能量稳态。WU等[32]构建了miR-130a-3p 基因敲除和过表达小鼠,在高脂饮食喂养后,基因敲除小鼠尾静脉内注射过表达小鼠肝外泌体后,其胰岛素抵抗的恢复速度与注射量呈正相关。此外,体外实验显示,miR-130a-3p过表达小鼠肝外泌体干预3T3-L1细胞后,脂质生成减少,葡萄糖摄取增加,进一步研究发现肝外泌体miR-130a-3p可以通过抑制PHLPP2的表达,从而激活脂肪细胞中AKT/AS160/GLUT4信号通路来改善糖耐量受损。这一研究证实了肝外泌体来源miR-130a能调节脂肪组织的能量代谢,为肥胖的调节和治疗提供新的机制或药物靶标。 间充质干细胞外泌体可以以自分泌和旁分泌的方式整合到代谢组织中,以改善葡萄糖体内平衡并增加胰岛素敏感 性[33]。研究发现在肥胖小鼠血清外泌体和胰岛组织中miR-26a 表达下降,使用miR-26a敲入和敲除小鼠模型发现β细胞中的miR-26a可减轻肥胖引起的胰岛素抵抗和高胰岛素血症,其机制主要与miR-26a显著增强远端组织的胰岛素敏感性和代谢稳态有关;同时,miR-26a通过减少β细胞复制并阻止肌动蛋白重塑来抑制肥胖引起的β细胞增生和葡萄糖刺激胰岛素分泌,从而减轻高胰岛素血症[26]。 脂肪干细胞外泌体在控制与肥胖相关的炎症和代谢紊乱中起关键作用。研究发现,用脂肪干细胞外泌体治疗肥胖小鼠可维持其代谢稳态,包括减少肥胖、改善胰岛素敏感性和抑制肝脂肪变性。脂肪干细胞外泌体在饮食诱导的肥胖小鼠白色脂肪组织中激活M2巨噬细胞极化状态,从而减轻炎症,其机制可能为脂肪干细胞通过外泌体携带的活性信号传导及STAT3激活精氨酸酶1和白细胞介素10,从而进入巨噬细胞诱导其由M1促炎表型向M2抗炎表型转化。此外,脂肪干细胞外泌体诱导的M2巨噬细胞不仅提高了酪氨酸羟化酶的表达参与儿茶酚胺的释放,还促进了脂肪干细胞增殖和乳酸生成,从而有利于白色脂肪组织褐变与体内动态平衡,从而延缓肥胖的发展[34]。同样,在肥胖模型中,脂肪细胞来源外泌体通过激活Ptch/PI3K通路刺激巨噬细胞的活化并有助于改善胰岛素抵抗[23]。 综上所述,这些研究阐述了脂肪干细胞外泌体与巨噬细胞间信息交流的新机制,以促进白色脂肪组织的免疫与机体代谢稳定,从而为肥胖提供了潜在的治疗方法。各种细胞来源外泌体通过改变巨噬细胞极化状态、抑制肥胖相关炎症和改善胰岛素敏感性等过程抑制肥胖的发展。 (2)外泌体在2型糖尿病中的治疗作用:2型糖尿病受遗传和环境等多种因素影响,是以胰岛素抵抗和脂质代谢紊乱为特征的疾病。胰岛素抵抗的发生、胰腺β细胞衰竭和内皮细胞功能障碍是2型糖尿病发生的最主要因素[35]。诸多研究发现,脂肪组织来源外泌体治疗2型糖尿病具有重要意义。 脂肪组织巨噬细胞作为脂肪来源的基质细胞之一,在2型糖尿病的发病中起着重要的作用。脂肪组织巨噬细胞分泌含有miRNA的外泌体,可以调节机体胰岛素敏感性。有研究将肥胖小鼠脂肪组织巨噬细胞外泌体注射到健康小鼠体内,发现过氧化物酶体增殖物激活受体和葡萄糖转运蛋白4的表达都受到抑制,进而降低脂肪组织中的胰岛素敏感性[17]。miR-210在高糖诱导的巨噬细胞RAW264.7中高表达,通过抑制miR-210表达可减轻巨噬细胞外泌体对3T3-L1脂肪细胞中葡萄糖摄取和线粒体CIV活性的影响,NDUFA4过表达抵消巨噬细胞来源外泌体对葡萄糖摄取和CIV活性的抑制,此外,外泌体miR-210基因敲除也可抑制2型糖尿病的发展[36]。这项研究表明,来源于脂肪组织巨噬细胞的外泌体miR-210通过靶向NDUFA4基因表达,调节葡萄糖摄取和线粒体CIV活性,促进肥胖糖尿病的发生,而基因敲除外泌体miR-210也为2型糖尿病的治疗提供了新思路。 SIRT最近已成为葡萄糖代谢和胰岛素敏感性的关键调节剂,SIRT1与外泌体相互作用对控制与治疗肥胖具有重要意义[37]。LI等[38]通过对脂肪组织特异性SIRT1基因敲除 (Ad-Sirt1)小鼠研究,发现Ad-Sirt1小鼠表现出脂肪质量增加、糖耐量受损、胰岛素敏感性减弱和外泌体数量增加,而外泌体抑制剂的应用则有效地改善了Ad-Sirt1小鼠受损后体内代谢。此外,外泌体的增加被证明是Ad-Sirt1小鼠自噬活性缺陷的结果,而SIRT1活性的恢复能有效改善体外代谢状况,进一步研究发现,SIRT1的缺乏促进外泌体的释放,进而通过TLR4 /NF-κB信号通路调节胰岛素敏感性,这一结果表明SIRT1是代谢调节的关键因素,而脂肪Sirt1缺乏可能通过促进外泌体释放而对肥胖和胰岛素抵抗的发展产生影响。另有研究发现脂肪干细胞外泌体中Nrf2的过表达增强了糖尿病小鼠内皮祖细胞的增殖和血管生成,从而促进伤口的愈合[39]。THOMOU等[40]研究了棕色脂肪细胞来源外泌体在系统性胰岛素抵抗中的代谢效应,发现来自正常小鼠的棕色脂肪细胞来源外泌体可以被肝脏摄取,从而减轻2型糖尿病小鼠的葡萄糖不耐受和胰岛素抵抗。此外,PPAR-δ是核受体超家族成员,与脂质代谢关系密切。脂肪组织巨噬细胞外泌体通过调节miR-29a,可抑制PPAR-δ表达从而调节与肥胖相关的胰岛素抵抗[41]。除此之外,将脂肪组织中的巨噬细胞暴露于刺激下会释放含有高迁移率族蛋白B1和基质金属蛋白酶14的外泌体,这些外泌体有助于胰岛素抵抗以及脂肪细胞体积的扩大,而胰高血糖素刺激的内皮细胞可以将与外泌体相关的CAV1转移到脂肪细胞中,以调节脂肪稳态[42]。 综上所述,这些研究不仅表明脂肪来源外泌体通过内分泌途径参与2型糖尿病的发生发展,还表明了脂肪来源外泌体治疗2型糖尿病的潜力,但受制于外泌体提取技术的限制,目前研究主要集中于脂肪组织,还应逐步提高外泌体提取分离技术,从而对不同细胞来源外泌体在2型糖尿病中的治疗作用进行深入研究。 2.3 运动介导外泌体在胰岛素抵抗类疾病中的调控作用 流行病学数据表明,运动不仅仅是一种积极健康的生活方式,也是非药物预防和治疗肥胖、2型糖尿病等胰岛素抵抗类疾病的有效手段,但其机制尚未完全阐明[43]。新近的研究表明,运动介导外泌体在防治胰岛素抵抗类疾病中发挥关键作用,见表1。在运动介导下外泌体的数量与成分发生相应的变化,外泌体中含有如蛋白质、脂质、核酸等各种丰富的组成成分,在运动介导下可促进骨骼肌、脂肪组织和血清等组织或体液来源外泌体的释放,使得外泌体数量增加,并调节外泌体中的核酸、蛋白、脂质的表达,进而在运动改善机体代谢中发挥重要作用。此外,已有研究证实,外泌体对于运动应激具有较高的敏感性,使得外泌体在有氧运动初期已开始释放,且较肾上腺素等激素更快进入循环或组织中,进一步维持细胞内环境的稳态,参与机体代谢等各种生理功能的调节[44]。 2.3.1 运动介导外泌体改善胰岛素敏感性 胰岛素敏感性与机体代谢调控关系密切,胰岛素敏感性的改善是延缓肥胖和2型糖尿病等胰岛素抵抗类疾病重要特征[45]。DE MENDON?A等[46]发现为期8周的有氧运动促进肥胖小鼠血清外泌体的释放,外泌体miR-22抑制白色脂肪组织中CEBPA、PPARG和FABP4基因的表达和三磷酸腺苷柠檬酸裂解酶的活性,外泌体miR-122在有氧运动介导下抑制肝脏脂肪变性和过氧化物酶体增生激活受体γ的表达,从而改善胰岛素敏感性并延缓肥胖性脂肪肝炎的发生。因此,有氧运动对肥胖的促进代谢作用涉及到外泌体miRNA,可能参与肝脏和白色脂肪组织之间的细胞间通讯,从而产生运动介导外泌体对胰岛素敏感性的有益影响。脂肪组织炎症反应与2型糖尿病中胰岛素抵抗和葡萄糖耐受不良密切相关[47]。KAWANISHI等[48]观察到慢性运动通过调节外泌体表达,防止脂肪组织中的巨噬细胞浸润,并下调Toll样受体4表达来调节巨噬细胞从M1促炎表型向M2抗炎表型转换,从而抑制炎症,进而改善胰岛素敏感性。此外,HSP72作为热休克蛋白的一种,在暴露于应激条件下时可以被包装在血清外泌体中以减轻炎症[49]。据报道,运动可以诱导细胞外HSP72的表达,从而增强血管功能并改善胰岛素敏感性[50]。LI等[51]提示HSP72可能在运动中通过外泌体提供这些有益效应,但还需进一步研究。 2.3.2 运动介导外泌体维持脂肪代谢平衡 脂肪代谢紊乱会引起肥胖和2型糖尿病等胰岛素抵抗类疾病的发生,维持脂肪代谢平衡是改善胰岛素抵抗类疾病的主要方式[52]。不同运动方式可介导外泌体对机体脂肪代谢维持和体质量控制产生益处,而MED13和IGF-1则是发挥这些有益效应的突破口。miR-208a是一种心脏特异性miRNA,可通过MED13调控主要组织相容性复合体含量并参与体内脂肪代谢。有氧运动通过调控血清外泌体miR-208a,增加心脏中MED13的表达,以维持脂肪代谢并预防体质量增加和病毒性心肌肥厚[53],因此miR-208a可作为肥胖等疾病的潜在治疗靶点。在抗阻运动中,外泌体miR-378的高表达促进成肌细胞生成,从而达到加速脂肪消耗和控制体质量的效果;同时,抗阻运动还调节外泌体miR-1的表达,通过抑制IGF-1/AKT信号进而改善肥胖患者代谢紊乱[54]。此外,基质金属蛋白酶9可通过降解细胞外基质,在维持脂肪代谢平衡中扮演重要角色[55]。 CHATURVEDI 等[56]建立2型糖尿病模型并进行为期8周的有氧运动,发现小鼠心脏组织和血清外泌体中 miR-455和 miR-29b表达上调,并通过结合基质金属蛋白酶9的3'非翻译区域下调其表达,减轻基质金属蛋白酶9的有害作用,引起细胞外基质重塑,从而抑制了心肌细胞解偶联和心肌纤维化的发展,维持机体脂肪代谢平衡并改善糖尿病症状,这也表明有氧运动介导外泌体改善糖尿病心血管并发症与促进外泌体释放和体内基质金属蛋白酶9的清除有关。这些研究表明,外泌体在不同运动方式的调节下诱导其miRNA或相关蛋白的变化以维持脂肪代谢平衡和控制体质量。 2.3.3 运动介导外泌体调节内皮细胞功能 内皮细胞功能障碍是引发肥胖和2型糖尿病等胰岛素抵抗类疾病的主要病因之一,而内皮细胞功能的改善有助于增加血管对机体的适应能力,并减轻胰岛素抵抗类疾病并发症症状,因此内皮细胞功能的改善对于胰岛素抵抗类疾病的治疗具有重要意义[57]。外泌体可在有氧运动诱导下改善内皮细胞功能障碍,从而延缓2型糖尿病的进程。BEI 等[58]对小鼠进行3周游泳训练,发现小鼠血清外泌体释放明显增加,将运动小鼠外泌体注射入对照小鼠左心室后,能通过激活ERK1/2信号并提高HSP27介导的H9C2心肌细胞的抗凋亡作用,发挥内皮细胞的保护功能。MA等[59]在缺氧诱导的内皮细胞损伤模型中发现,有氧运动可以增加内皮祖细胞来源外泌体的释放并促进外泌体miR-126表达,通过调节SPRED1/VEGF信号通路减少内皮细胞凋亡,以增强对内皮细胞的保护作用,从而减轻糖尿病心血管并发症症状。除有氧运动外,抗阻运动也能通过外泌体增加血液循环内皮祖细胞对血管的适应和保护能力,进而改善胰岛素抵抗[60]。这些研究表明,血清与内皮细胞来源外泌体通过激活ERK1/2和miR-126表达,在有氧运动介导下发挥调节内皮细胞功能的作用,进而改善肥胖与2型糖尿病等症状。 2.3.4 运动介导外泌体改善机体葡萄糖稳态 葡萄糖稳态是反映肥胖和2型糖尿病等胰岛素抵抗类疾病治疗进程的重要标志,心肌细胞、脂肪组织以及骨骼肌来源外泌体在有氧运动介导下改善机体葡糖糖稳态。SAFDAR等[61]发现在有氧运动作用下心肌细胞释放含有乳酸脱氢酶和甘油醛-3-磷酸脱氢酶的外泌体,这些外泌体被邻近的内皮细胞吸收,促进葡萄糖摄取、糖酵解和丙酮酸生成,从而直接调节葡萄糖稳态和机体代谢健康。成纤维细胞生长因子21一种脂肪来源的细胞因子,在脂肪、肝脏和胰腺组织中调控物质代谢中发挥重要作用[62]。另有研究发现,有氧运动中脂肪组织外泌体miR-99b在肝脏中被吸收,miR-99b抑制肝细胞中成纤维细胞生长因子21的表达,减轻葡萄糖耐受不良症状,维持体内葡萄糖稳态[63]。此外,线粒体也在系统性血糖控制中起到了至关重要的作用。LASSER等[64]发现耐力运动可诱导含有HSP60的外泌体快速释放到循环中,以刺激过氧化物酶体增殖物激活受体γ及其共激活子1α的表达,并增加线粒体DNA拷贝数,从而保持机体代谢中的葡萄糖稳态,这表明HSP60可作为葡萄糖稳态的调节因子,参与运动介导外泌体改善胰岛素抵抗类疾病的过程。 "

| [1] BANNIGIDA DM, NAYAK BS, VIJAYARAGHAVAN R. Insulin resistance and oxidative marker in women with PCOS. Arch Physiol Biochem. 2020;126(2):183-186. [2] NAKAMURA M, SADOSHIMA J. Cardiomyopathy in obesity, insulin resistance and diabetes. J Physiol. 2020;598(14):2977-2993. [3] VISHVANATH L, GUPTA RK. Contribution of adipogenesis to healthy adipose tissue expansion in obesity. J Clin Invest. 2019;129(10):4022-4031. [4] 刘卒,韩燊,李亚雄,等.不同干细胞来源外泌体在心血管疾病治疗中的应用、作用及问题[J].中国组织工程研究,2020,24(19):3063-3070. [5] CASTAÑO C, NOVIALS A, PÁRRIZAS M. Exosomes and diabetes. Diabetes Metab Res Rev. 2019;35(3):e3107. [6] 李伟,Sang Ki Lee,朱启娥.外泌体——糖尿病发生及其心血管并发症的重要信号分子及运动干预的潜在靶点[J].中国糖尿病杂志,2018,26(10):875-880. [7] ZITVOGEL L, REGNAULT A, LOZIER A, et al. Eradication of established murine tumors using a novel cell-free vaccine: dendritic cell-derived exosomes. Nat Med. 1998;4(5):594-600. [8] TRAMS EG, LAUTER CJ, SALEM N JR, et al. Exfoliation of membrane ecto-enzymes in the form of micro-vesicles. Biochim Biophys Acta. 1981;645(1):63-70. [9] PAN BT, JOHNSTONE RM. Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor. Cell. 1983;33(3):967-978. [10] PAN BT, TENG K, WU C, et al. Electron microscopic evidence for externalization of the transferrin receptor in vesicular form in sheep reticulocytes. J Cell Biol. 1985;101(3):942-948. [11] JOHNSTONE RM, ADAM M, HAMMOND JR, et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J Biol Chem. 1987;262(19):9412-9420. [12] JOHNSTONE RM, BIANCHINI A, TENG K. Reticulocyte maturation and exosome release: transferrin receptor containing exosomes shows multiple plasma membrane functions. Blood. 1989;74(5):1844-1851. [13] WUBBOLTS R, LECKIE RS, VEENHUIZEN PT, et al. Proteomic and biochemical analyses of human B cell-derived exosomes. Potential implications for their function and multivesicular body formation. J Biol Chem. 2003;278(13):10963-10972. [14] BLANCHARD N, LANKAR D, FAURE F, et al. TCR activation of human T cells induces the production of exosomes bearing the TCR/CD3/zeta complex. J Immunol. 2002;168(7):3235-3241. [15] SAPP RM, SHILL DD, ROTH SM, et al. Circulating microRNAs in acute and chronic exercise: more than mere biomarkers. J Appl Physiol (1985). 2017;122(3):702-717. [16] HUANG X, YUAN T, LIANG M, et al. Exosomal miR-1290 and miR-375 as prognostic markers in castration-resistant prostate cancer. Eur Urol. 2015;67(1):33-41. [17] YING W, RIOPEL M, BANDYOPADHYAY G, et al. Adipose Tissue Macrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro Insulin Sensitivity. Cell. 2017;171(2):372-384.e12. [18] 郭健民,陈熙,邹军,等.肿瘤细胞外泌体对肿瘤血管新生的调控作用[J].中国细胞生物学报,2019,41(2):297-303. [19] MICHLEWSKI G, CÁCERES JF. Post-transcriptional control of miRNA biogenesis. RNA. 2019;25(1):1-16. [20] VALADI H, EKSTRÖM K, BOSSIOS A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 2007;9(6):654-659. [21] DENG G, QU J, ZHANG Y, et al. Gastric cancer-derived exosomes promote peritoneal metastasis by destroying the mesothelial barrier. FEBS Lett. 2017; 591(14):2167-2179. [22] DIVAKARAN V, MANN DL. The emerging role of microRNAs in cardiac remodeling and heart failure. Circ Res. 2008;103(10):1072-1083. [23] SONG M, HAN L, CHEN FF, et al. Adipocyte-Derived Exosomes Carrying Sonic Hedgehog Mediate M1 Macrophage Polarization-Induced Insulin Resistance via Ptch and PI3K Pathways. Cell Physiol Biochem. 2018;48(4):1416-1432. [24] FREEMAN DW, NOREN HOOTEN N, EITAN E, et al. Altered Extracellular Vesicle Concentration, Cargo, and Function in Diabetes. Diabetes. 2018;67(11):2377-2388. [25] BAE YU, KIM Y, LEE H, et al. Bariatric Surgery Alters microRNA Content of Circulating Exosomes in Patients with Obesity. Obesity (Silver Spring). 2019;27(2):264-271. [26] XU H, DU X, XU J, et al. Pancreatic β cell microRNA-26a alleviates type 2 diabetes by improving peripheral insulin sensitivity and preserving β cell function. PLoS Biol. 2020;18(2):e3000603. [27] 郭磊,吕静,刘继军,等.肥胖患者内脏脂肪细胞来源的外泌体miRNAs表达谱分析[J].国际检验医学杂志,2018,39(21):2604-2609. [28] SANTOVITO D, DE NARDIS V, MARCANTONIO P, et al. Plasma exosome microRNA profiling unravels a new potential modulator of adiponectin pathway in diabetes: effect of glycemic control. J Clin Endocrinol Metab. 2014;99(9):E1681-E1685. [29] KAROLINA DS, TAVINTHARAN S, ARMUGAM A, et al. Circulating miRNA profiles in patients with metabolic syndrome. J Clin Endocrinol Metab. 2012;97(12): E2271-E2276. [30] EISSA S, MATBOLI M, ABOUSHAHBA R, et al. Urinary exosomal microRNA panel unravels novel biomarkers for diagnosis of type 2 diabetic kidney disease. J Diabetes Complications. 2016;30(8):1585-1592. [31] 顾东风,翁建平,鲁向锋.中国健康生活方式预防心血管代谢疾病指南[J].中国循环杂志,2020,35(3):209-230. [32] WU J, DONG T, CHEN T, et al. Hepatic exosome-derived miR-130a-3p attenuates glucose intolerance via suppressing PHLPP2 gene in adipocyte. Metabolism. 2020;103:154006. [33] SU T, XIAO Y, XIAO Y, et al. Bone Marrow Mesenchymal Stem Cells-Derived Exosomal MiR-29b-3p Regulates Aging-Associated Insulin Resistance. ACS Nano. 2019;13(2):2450-2462. [34] ZHAO H, SHANG Q, PAN Z, et al. Exosomes From Adipose-Derived Stem Cells Attenuate Adipose Inflammation and Obesity Through Polarizing M2 Macrophages and Beiging in White Adipose Tissue. Diabetes. 2018;67(2):235-247. [35] PIGMAN HT, GAN DX, KROUSEL-WOOD MA. Role of exercise for type 2 diabetic patient management. South Med J. 2002;95(1):72-77. [36] TIAN F, TANG P, SUN Z, et al. miR-210 in Exosomes Derived from Macrophages under High Glucose Promotes Mouse Diabetic Obesity Pathogenesis by Suppressing NDUFA4 Expression. J Diabetes Res. 2020;2020:6894684. [37] 胡甜,石晶晶,章时杰,等.槲皮素通过SIRT1/NLRP3通路改善db/db糖尿病模型小鼠的认知功能障碍[J].中国药理学与毒理学杂志,2019,33(6):435-436. [38] LI F, LI H, JIN X, et al. Adipose-specific knockdown of Sirt1 results in obesity and insulin resistance by promoting exosomes release. Cell Cycle. 2019;18(17): 2067-2082. [39] LI X, XIE X, LIAN W, et al. Exosomes from adipose-derived stem cells overexpressing Nrf2 accelerate cutaneous wound healing by promoting vascularization in a diabetic foot ulcer rat model. Exp Mol Med. 2018;50(4):29. [40] THOMOU T, MORI MA, DREYFUSS JM, et al. Adipose-derived circulating miRNAs regulate gene expression in other tissues. Nature. 2017;542(7642):450-455. [41] LIU T, SUN YC, CHENG P, et al. Adipose tissue macrophage-derived exosomal miR-29a regulates obesity-associated insulin resistance. Biochem Biophys Res Commun. 2019;515(2):352-358. [42] LI CJ, FANG QH, LIU ML, et al. Current understanding of the role of Adipose-derived Extracellular Vesicles in Metabolic Homeostasis and Diseases: Communication from the distance between cells/tissues. Theranostics. 2020; 10(16):7422-7435. [43] 张静,陈佩杰,肖卫华.肥胖导致骨骼肌胰岛素抵抗——炎症因子的介导作用及运动的改善效应[J].中国运动医学杂志,2020,39(3):226-231. [44] FRÜHBEIS C, HELMIG S, TUG S, et al. Physical exercise induces rapid release of small extracellular vesicles into the circulation. J Extracell Vesicles. 2015;4:28239. [45] ROMACHO T, SELL H, INDRAKUSUMA I, et al. DPP4 deletion in adipose tissue improves hepatic insulin sensitivity in diet-induced obesity. Am J Physiol Endocrinol Metab. 2020;318(5):E590-E599. [46] DE MENDONÇA M, ROCHA KC, DE SOUSA É, et al. Aerobic exercise training regulates serum extracellular vesicle miRNAs linked to obesity to promote their beneficial effects in mice. Am J Physiol Endocrinol Metab. 2020;319(3):E579-E591. [47] 朱翠松,杨瑜,刘明斌,等.脂肪组织巨噬细胞在肥胖诱导的炎症和胰岛素抵抗中的作用[J].复旦学报(医学版),2019,46(5):681-686. [48] KAWANISHI N, YANO H, YOKOGAWA Y, et al. Exercise training inhibits inflammation in adipose tissue via both suppression of macrophage infiltration and acceleration of phenotypic switching from M1 to M2 macrophages in high-fat-diet-induced obese mice. Exerc Immunol Rev. 2010;16:105-118. [49] BENINSON LA, BROWN PN, LOUGHRIDGE AB, et al. Acute stressor exposure modifies plasma exosome-associated heat shock protein 72 (Hsp72) and microRNA (miR-142-5p and miR-203). PLoS One. 2014;9(9):e108748. [50] GHOLITABAR S, ROSHAN VD. Effect of treadmill exercise and Ferula gummosa on myocardial HSP72, vascular function, and antioxidant defenses in spontaneously hypertensive rats. Clin Exp Hypertens. 2013;35(5):347-354. [51] LI G, LIU H, MA C, et al. Exosomes are the novel players involved in the beneficial effects of exercise on type 2 diabetes. J Cell Physiol. 2019 Feb 12. doi: 10.1002/jcp.28319. Online ahead of print. [52] KIM KM, LEE HS, YUN MK, et al. Fermented Castanea crenata Inner Shell Extract Increases Fat Metabolism and Decreases Obesity in High-Fat Diet-Induced Obese Mice. J Med Food. 2019;22(3):264-270. [53] FERNANDES T, BARRETTI DL, PHILLIPS MI, et al. Exercise training prevents obesity-associated disorders: Role of miRNA-208a and MED13. Mol Cell Endocrinol. 2018;476:148-154. [54] KIRBY TJ, MCCARTHY JJ. MicroRNAs in skeletal muscle biology and exercise adaptation. Free Radic Biol Med. 2013;64:95-105. [55] YADAV SK, KAMBIS TN, KAR S, et al. MMP9 mediates acute hyperglycemia-induced human cardiac stem cell death by upregulating apoptosis and pyroptosis in vitro. Cell Death Dis. 2020;11(3):186. [56] CHATURVEDI P, KALANI A, MEDINA I, et al. Cardiosome mediated regulation of MMP9 in diabetic heart: role of mir29b and mir455 in exercise. J Cell Mol Med. 2015;19(9):2153-2161. [57] EL ASSAR M, RUIZ DE ADANA JC, ANGULO J, et al. Preserved endothelial function in human obesity in the absence of insulin resistance. J Transl Med. 2013;11:263. [58] BEI Y, XU T, LV D, et al. Exercise-induced circulating extracellular vesicles protect against cardiac ischemia-reperfusion injury. Basic Res Cardiol. 2017;112(4):38. [59] MA C, WANG J, LIU H, et al. Moderate Exercise Enhances Endothelial Progenitor Cell Exosomes Release and Function. Med Sci Sports Exerc. 2018;50(10): 2024-2032. [60] 朱启娥,叶啟发,杨翼.外泌体的心血管保护作用及其在运动领域的研究进展[J].中国运动医学杂志,2016,35(11):1067-1073. [61] SAFDAR A, SALEEM A, TARNOPOLSKY MA. The potential of endurance exercise- derived exosomes to treat metabolic diseases. Nat Rev Endocrinol. 2016;12(9): 504-517. [62] 王璐,于亮.成纤维生长因子21调控白色脂肪棕色化:运动的作用[J].中国组织工程研究,2020,24(20):3275-3280. [63] GENG L, LIAO B, JIN L, et al. Exercise Alleviates Obesity-Induced Metabolic Dysfunction via Enhancing FGF21 Sensitivity in Adipose Tissues. Cell Rep. 2019; 26(10):2738-2752. [64] LÄSSER C. Exosomal RNA as biomarkers and the therapeutic potential of exosome vectors. Expert Opin Biol Ther. 2012;12 Suppl 1:S189-197. |
| [1] | Pu Rui, Chen Ziyang, Yuan Lingyan. Characteristics and effects of exosomes from different cell sources in cardioprotection [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(在线): 1-. |
| [2] | Zhang Chao, Lü Xin. Heterotopic ossification after acetabular fracture fixation: risk factors, prevention and treatment progress [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1434-1439. |
| [3] | Zhou Jihui, Li Xinzhi, Zhou You, Huang Wei, Chen Wenyao. Multiple problems in the selection of implants for patellar fracture [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1440-1445. |
| [4] | Wang Debin, Bi Zhenggang. Related problems in anatomy mechanics, injury characteristics, fixed repair and three-dimensional technology application for olecranon fracture-dislocations [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1446-1451. |
| [5] | Ji Zhixiang, Lan Changgong. Polymorphism of urate transporter in gout and its correlation with gout treatment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1290-1298. |
| [6] | Yuan Mei, Zhang Xinxin, Guo Yisha, Bi Xia. Diagnostic potential of circulating microRNA in vascular cognitive impairment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1299-1304. |
| [7] | Wang Yongsheng, Wu Yang, Li Yanchun. Effect of acute high-intensity exercise on appetite hormones in adults: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1305-1312. |
| [8] | Shen Jinbo, Zhang Lin. Micro-injury of the Achilles tendon caused by acute exhaustive exercise in rats: ultrastructural changes and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1190-1195. |
| [9] | Wang Mengting, Gu Yanping, Ren Wenbo, Qin Qian, Bai Bingyi, Liao Yuanpeng. Research hotspots of blood flow restriction training for dyskinesia based on visualization analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1264-1269. |
| [10] | Wang Xianyao, Guan Yalin, Liu Zhongshan. Strategies for improving the therapeutic efficacy of mesenchymal stem cells in the treatment of nonhealing wounds [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1081-1087. |
| [11] | Wan Ran, Shi Xu, Liu Jingsong, Wang Yansong. Research progress in the treatment of spinal cord injury with mesenchymal stem cell secretome [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1088-1095. |
| [12] | Liao Chengcheng, An Jiaxing, Tan Zhangxue, Wang Qian, Liu Jianguo. Therapeutic target and application prospects of oral squamous cell carcinoma stem cells [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1096-1103. |
| [13] | Zhao Min, Feng Liuxiang, Chen Yao, Gu Xia, Wang Pingyi, Li Yimei, Li Wenhua. Exosomes as a disease marker under hypoxic conditions [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1104-1108. |
| [14] | Xie Wenjia, Xia Tianjiao, Zhou Qingyun, Liu Yujia, Gu Xiaoping. Role of microglia-mediated neuronal injury in neurodegenerative diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1109-1115. |
| [15] | Li Shanshan, Guo Xiaoxiao, You Ran, Yang Xiufen, Zhao Lu, Chen Xi, Wang Yanling. Photoreceptor cell replacement therapy for retinal degeneration diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1116-1121. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||