中国组织工程研究 ›› 2026, Vol. 30 ›› Issue (11): 2691-2701.doi: 10.12307/2026.129
• 骨组织构建 bone tissue construction • 上一篇 下一篇
异甘草素抑制磨损颗粒诱导体内外破骨细胞的形成与分化
谭 飞1,2,曾健康1,2,王 静1,2,刘 健1,2,李嘉欢1,2,李培杰1,2,乔永杰1,周胜虎1
- 1解放军联勤保障部队第九四〇医院关节外科,甘肃省兰州市 730050;2甘肃中医药大学第一临床医学院,甘肃省兰州市 730030
Isoliquiritigenin inhibits wear particle-induced formation and differentiation of osteoblasts in vitro and in vivo
Tan Fei1, 2, Zeng Jiankang1, 2, Wang Jing1, 2, Liu Jian1, 2, Li Jiahuan1, 2, Li Peijie1, 2, Qiao Yongjie1, Zhou Shenghu1
- 1Department of Joint Surgery, The 940th Hospital of Joint Logistics Support Force of Chinese People’s Liberation Army, Lanzhou 730050, Gansu Province, China; 2First School of Clinical Medicine, Gansu University of Chinese Medicine, Lanzhou 730030, Gansu Province, China
摘要:
文题释义:
异甘草素:一种从甘草中提取的黄酮类化合物,化学名称为2’,4’,4’-三羟基查尔酮,具备抗炎、抗肿瘤和抗氧化等多重功效,已在心血管系统、消化系统等多领域应用。
假体周围骨溶解:全关节置换术后,假体与骨界面长期磨损产生微米级别的磨损颗粒,磨损颗粒被巨噬细胞吞噬,启动炎性反应,局部炎性因子浸润致破骨细胞大量生成,导致骨吸收大于骨生成,引发骨溶解。
背景:磨损颗粒引起破骨细胞分化是导致假体周围骨溶解的主要原因之一,抑制破骨细胞的分化及吸收功能是治疗假体周围骨溶解的重要研究方向。研究显示,异甘草素可促进成骨细胞的成熟、抑制破骨细胞的骨吸收作用。
目的:探讨异甘草素对磨损颗粒诱导破骨细胞形成与分化的影响。
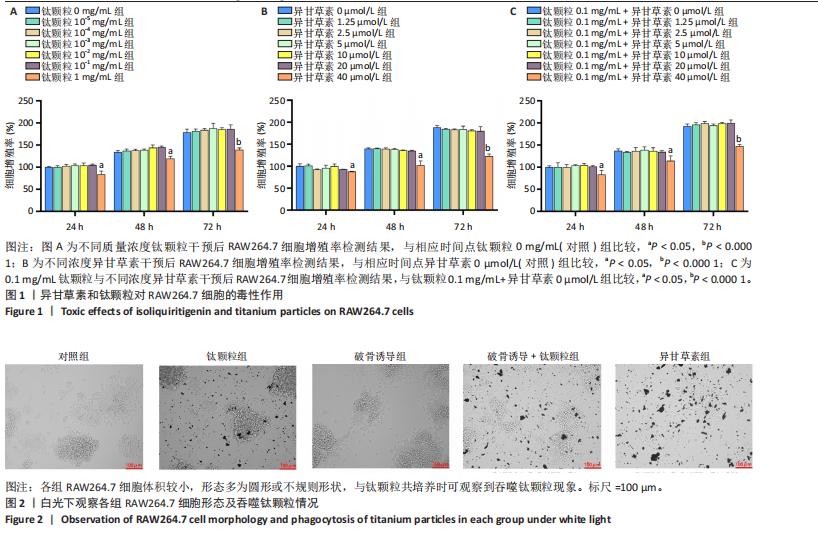
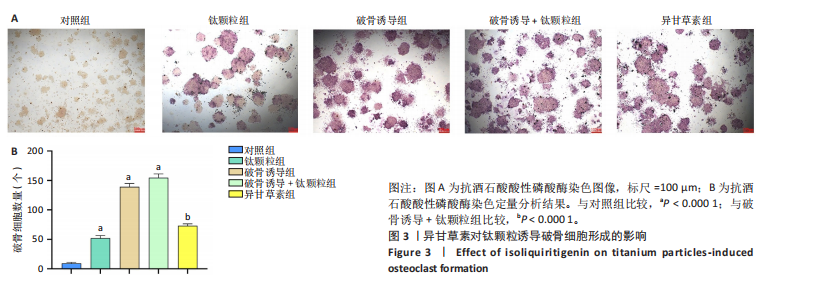
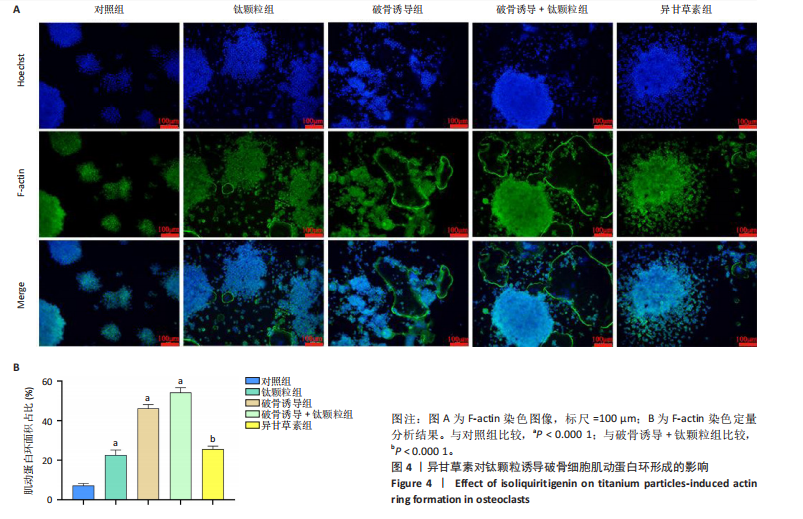
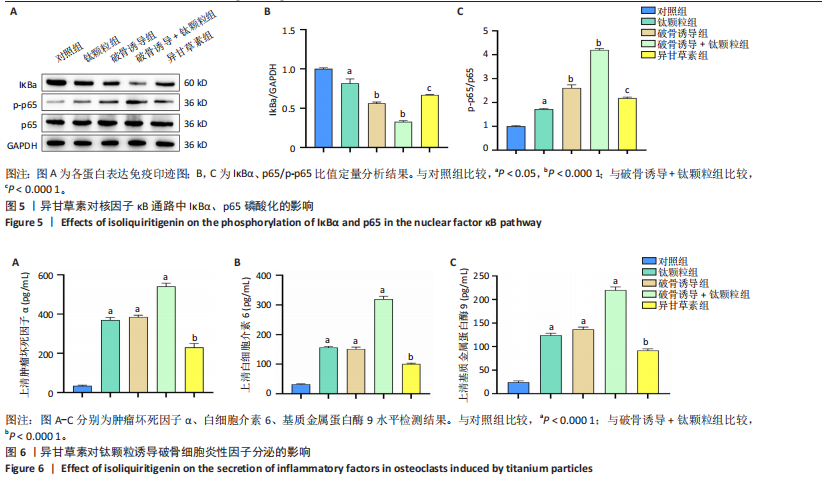
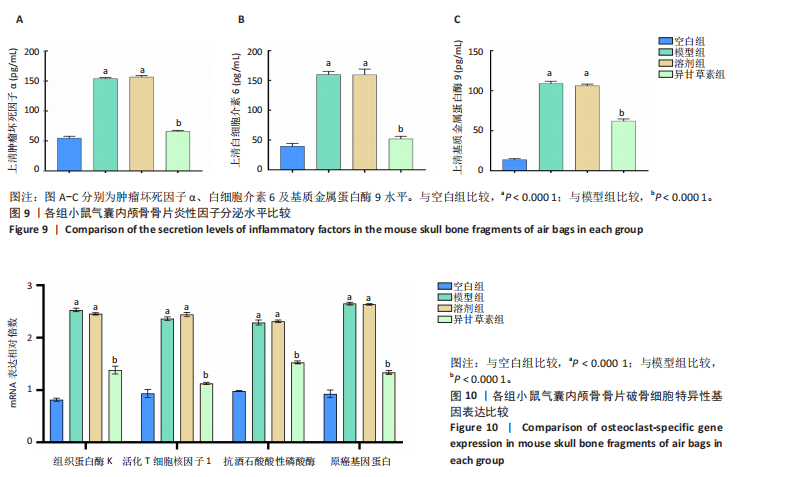
方法:①细胞实验:将第3代RAW264.7细胞分5组处理:对照组不进行任何处理,钛颗粒组加入钛颗粒,破骨诱导组加入核因子κB受体活化因子配体诱导破骨细胞分化,破骨诱导+钛颗粒组同时加入核因子κB受体活化因子配体与钛颗粒,异甘草素组加入核因子κB受体活化因子配体与钛颗粒处理第2天加入20 μmol/L异甘草素。核因子κB受体活化因子配体诱导处理5 d后,抗酒石酸酸性磷酸酶、F-actin染色评估破骨细胞形成与骨吸收功能,Western Blot检测异甘草素对核因子κB通路中IκBα、p-65磷酸化的影响,ELISA法检测细胞上清液中炎症因子(肿瘤坏死因子α、白细胞介素6和基质金属蛋白酶9)水平,RT-PCR技术检测破骨细胞相关基因(组织蛋白酶K、活化T细胞核因子1、原癌基因蛋白及抗酒石酸酸性磷酸酶)表达。②动物实验:取32只BALB/c小鼠构建背部气囊植骨模型,随机分4组干预:空白组(n=8)气囊内注射PBS,模型组(n=8)、溶剂组(n=8)、异甘草素组(n=8)气囊内注射钛颗粒悬浮液,钛颗粒悬浮液注射第2天,空白组、模型组、溶剂组和异甘草素组分别腹腔注射PBS、PBS、DMSO+玉米油、40 mg/kg异甘草素,隔天注射1次,连续注射2周。干预结束后,抗酒石酸酸性磷酸酶染色检测气囊中骨片破骨细胞数量,ELISA法检测气囊中骨片研磨液中炎症因子水平,RT-PCR检测气囊中骨片研磨液中破骨细胞相关基因表达。
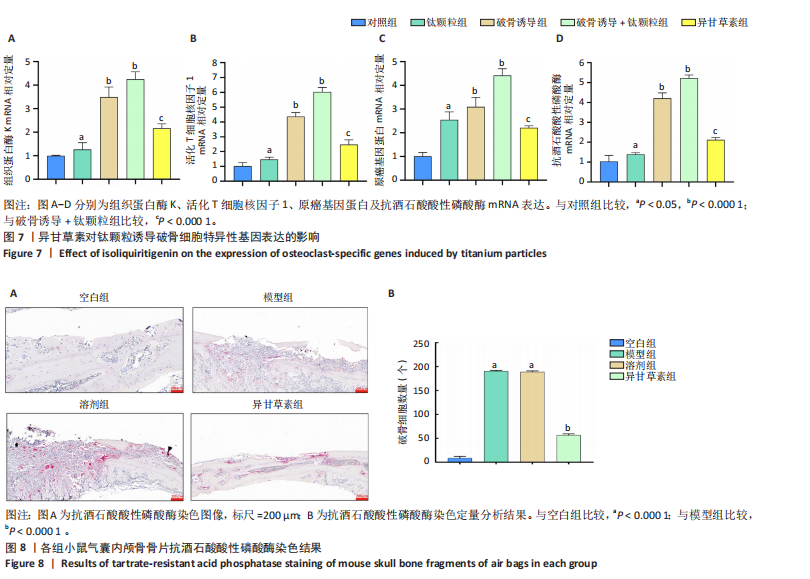
结论与结果:①细胞实验:与对照组相比,其他4组破骨细胞形成数量增加、骨吸收能力增强,其中以破骨诱导+钛颗粒组破骨细胞形成数量最多、骨吸收能力最强;与破骨诱导+钛颗粒组相比,异甘草素组破骨细胞形成数量减少、骨吸收能力降低。与对照组相比,其余4组IκBα、p65磷酸化增加,提示破骨细胞数量增加,其中破骨诱导+钛颗粒组IκBα、p65磷酸化表达最多,异甘草素处理后明显降低。与对照组相比,其他4组炎症因子水平与破骨细胞相关基因表达均升高,其中以破骨诱导+钛颗粒组最高;与破骨诱导+钛颗粒组相比,异甘草素组炎症因子水平与破骨细胞相关基因表达均降低。②动物实验:与空白组相比,其他3组破骨细胞数量、炎症因子水平与破骨细胞相关基因表达均增加;与模型组相比,异甘草素组破骨细胞数量、炎症因子水平与破骨细胞相关基因表达均减少。③结果表明,异甘草素能够抑制磨损颗粒引发的体内外破骨细胞的形成与分化。
https://orcid.org/0009-0004-0203-3241 (谭飞)
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程
中图分类号: