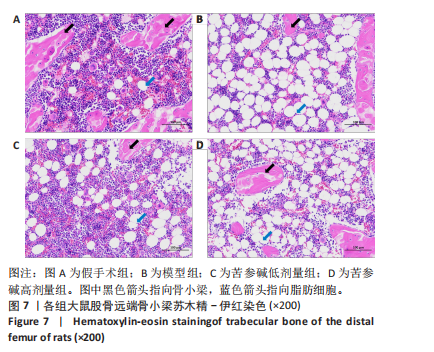
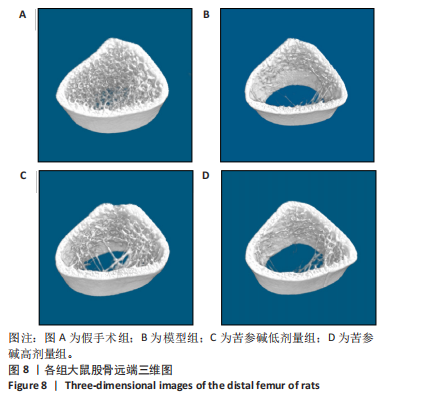
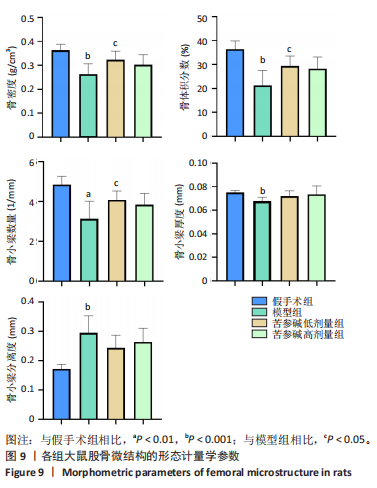
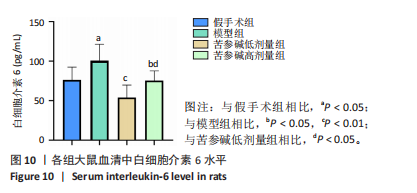
[1] RAMCHAND SK, LEDER BZ. Sequential Therapy for the Long-Term Treatment of Postmenopausal Osteoporosis. J Clin Endocrinol Metab. 2024;109(2):303-311.
[2] SUBARAJAN P, ARCEO-MENDOZA RM, CAMACHO PM. Postmenopausal Osteoporosis: A Review of Latest Guidelines. Endocrinol Metab Clin North Am. 2024 Dec;53(4):497-512.
[3] SALARI N, DARVISHI N, BARTINA Y, et al. Global prevalence of osteoporosis among the world older adults: a comprehensive systematic review and meta-analysis. J Orthop Surg Res. 2021;16(1):669.
[4] 中华医学会骨质疏松和骨矿盐疾病分会,章振林.原发性骨质疏松症诊疗指南(2022)[J].中国全科医学,2023,26(14):1671-1691.
[5] YANG K, WANG X, ZHANG C, et al. Metformin improves HPRT1-targeted purine metabolism and repairs NR4A1-mediated autophagic flux by modulating FoxO1 nucleocytoplasmic shuttling to treat postmenopausal osteoporosis. Cell Death Dis. 2024;15(11):795.
[6] AYERS C, KANSAGARA D, LAZUR B, et al. Effectiveness and Safety of Treatments to Prevent Fractures in People With Low Bone Mass or Primary Osteoporosis: A Living Systematic Review and Network Meta-analysis for the American College of Physicians. Ann Intern Med. 2023;176(2):182-195.
[7] LEBOFF MS, GREENSPAN SL, INSOGNA KL, et al. The clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022;33(10): 2049-2102.
[8] FOESSL I, DIMAI HP, OBERMAYER-PIETSCH B. Long-term and sequential treatment for osteoporosis. Nat Rev Endocrinol. 2023;19(9):520-533.
[9] SPÅNGEUS A, RYDETUN J, WOISETSCHLÄGER M. Prevalence of denosumab-induced hypocalcemia: a retrospective observational study of patients routinely monitored with ionized calcium post-injection. Osteoporos Int. 2024;35(1):173-180.
[10] QI L, GUO WW, DONG HX, et al. Narrative Review of Traditional Chinese Medicine in the Treatment of Postmenopausal Osteoporosis. Comb Chem High Throughput Screen. 2024;27(15):2162-2169.
[11] 陈鲁宁,胡扬,辛国松,等.菟丝子化学成分、药理作用研究进展及其质量标志物(Q-Marker)预测[J].中草药,2024,55(15):5298-5314.
[12] 郭晓彤,宋俊丽,韦秋,等.菟丝子丸调控BMP2/RUNX2信号通路抗绝经后骨质疏松研究[J].天津中医药,2024,41(12):1599-1604.
[13] 孟卓然,赵梓铭,贾壮壮,等.菟丝子乙醇提取物灌胃对大鼠绝经后骨质疏松症的改善作用及其机制[J].山东医药,2024,64(17):29-32.
[14] SONG C, YAN Q, MA Y, et al. Modified Zuo Gui Wan Ameliorates Ovariectomy-Induced Osteoporosis in Rats by Regulating the SCFA-GPR41-p38MAPK Signaling Pathway. Drug Des Devel Ther. 2024;18:6359-6377.
[15] 林楚彬,何兴鹏,丘育辉,等.病证结合骨质疏松模型大鼠骨骼的生物力学性能分析[J].中国组织工程研究,2024,28(23):3636-3641.
[16] 赵琦明,龚婉,刘梦琴,等.三子丸有效成分群对去卵巢骨质疏松大鼠骨代谢的影响[J].中国药学杂志,2021,56(8):640-646.
[17] 贾艳萍,张国明.补肾壮骨汤联合西药治疗围绝经期骨质疏松症的临床疗效及对骨代谢、炎症因子的影响[J].中医研究,2021,34(12): 37-40.
[18] 赵宝宝,李兴勇,董万涛,等.中药菟丝子防治骨质疏松症的研究进展[J].中国骨质疏松杂志,2023,29(7):1089-1092.
[19] HU X, WANG W, CHEN X, et al. Trehalose Rescues Postmenopausal Osteoporosis Induced by Ovariectomy through Alleviating Osteoblast Pyroptosis via Promoting Autophagy. Biomedicines. 2024;12(10):2224.
[20] JIN J, FAN Z, LONG Y, et al. Matrine induces ferroptosis in cervical cancer through activation of piezo1 channel. Phytomedicine. 2024;122:155165.
[21] SUN Z, WANG Y, PANG X, et al. Mechanisms of polydatin against spinal cord ischemia-reperfusion injury based on network pharmacology, molecular docking and molecular dynamics simulation. Bioorg Chem. 2023;140:106840.
[22] ZHANG C, LI H, LI J, et al. Oxidative stress: A common pathological state in a high-risk population for osteoporosis. Biomed Pharmacother. 2023;163:114834.
[23] ZOU J, CHEN H, FAN X, et al. Garcinol prevents oxidative stress-induced bone loss and dysfunction of BMSCs through NRF2-antioxidant signaling. Cell Death Discov. 2024;10(1):82.
[24] WANG LT, CHEN LR, CHEN KH. Hormone-Related and Drug-Induced Osteoporosis: A Cellular and Molecular Overview. Int J Mol Sci. 2023; 24(6):5814.
[25] CHEN X, ZHI X, PAN P, et al. Matrine prevents bone loss in ovariectomized mice by inhibiting RANKL-induced osteoclastogenesis. FASEB J. 2017; 31(11):4855-4865.
[26] XIN Z, JIN C, CHAO L, et al. A Matrine Derivative M54 Suppresses Osteoclastogenesis and Prevents Ovariectomy-Induced Bone Loss by Targeting Ribosomal Protein S5. Front Pharmacol. 2018;9:22.
[27] ZHOU P, XIA D, WANG Y, et al. Matrine derivate MASM protects murine MC3T3-E1 osteoblastic cells against dexamethasone-induced apoptosis via the regulation of USP14/p53. Artif Cells Nanomed Biotechnol. 2019; 47(1):3720-3728.
[28] HUANG X, NI B, LI Q, et al. Association between Postmenopausal Osteoporosis and IL-6、TNF-α: A Systematic Review and A Meta-analysis. Comb Chem High Throughput Screen. 2024;27(15):2260-2266.
[29] FISCHER V, HAFFNER-LUNTZER M. Interaction between bone and immune cells: Implications for postmenopausal osteoporosis. Semin Cell Dev Biol. 2022;123:14-21.
[30] YOKOTA K, SATO K, MIYAZAKI T, et al. Characterization and Function of Tumor Necrosis Factor and Interleukin-6-Induced Osteoclasts in Rheumatoid Arthritis. Arthritis Rheumatol. 2021;73(7):1145-1154.
[31] CHEN Y, ZHENG J, MO L, et al. Oroxylin A suppresses breast cancer-induced osteoclastogenesis and osteolysis as a natural RON inhibitor. Phytomedicine. 2024;129:155688.
[32] FENG W, LIU H, LUO T, et al. Combination of IL-6 and sIL-6R differentially regulate varying levels of RANKL-induced osteoclastogenesis through NF-κB, ERK and JNK signaling pathways. Sci Rep. 2017;7:41411.
[33] CHEN K, QIU P, YUAN Y, et al. Pseurotin A Inhibits Osteoclastogenesis and Prevents Ovariectomized-Induced Bone Loss by Suppressing Reactive Oxygen Species. Theranostics. 2019;9(6):1634-1650.
[34] LIU T, JIANG L, XIANG Z, et al. Tereticornate A suppresses RANKL-induced osteoclastogenesis via the downregulation of c-Src and TRAF6 and the inhibition of RANK signaling pathways. Biomed Pharmacother. 2022;151:113140.
[35] HUANG W, GONG Y, YAN L. ER Stress, the Unfolded Protein Response and Osteoclastogenesis: A Review. Biomolecules. 2023;13(7):1050.
|