1.1 设计 体外细胞实验、体内动物实验,组间比较进行t检验或单因素方差分析。
1.2 时间及地点 实验于2022年8月至2024年2月在西安交通大学附属第一医院实验室完成。
1.3 材料
1.3.1 细胞与菌种 兔骨髓间充质干细胞购自苏州赛业公司;大肠杆菌(E.coli,ATCC25922)和金黄色葡萄球菌(S.aureus,ATCC25923)均购自上海市鲁微科技有限公司。
1.3.2 主要试剂 低糖DMEM培养基和胎牛血清购自Gibco公司;万古霉素购自西格玛奥尔德里奇(上海);青霉素链霉素双抗和胰蛋白酶-EDTA(0.05%胰蛋白酶和0.02%EDTA)溶液购自Sigma-Aldrich公司;CCK-8、钙黄绿素-AM-PI 染色试剂盒、RIPA裂解缓冲液、BCIP/NBT碱性磷酸酶显色试剂盒和碱性磷酸酶检测试剂盒均购自碧云天有限公司(中国上海);PBS、DAPI溶液、TRITC类淀粉样蛋白和40 g/L多聚甲醛购自Solarbio公司(中国北京);兔骨髓间充质干细胞成骨诱导培养基和茜素红染色剂购自Cyagen公司(美国圣克拉拉);FastPure Cell/Tissue Total RNA Isolation Kit、ABScript Ⅱ RT Master Mix for qPCR with gDNA Remover 和
Universal SYBR Green Fast qPCR Mix购自Abclonal Co.(中国武汉);氯化十六烷基吡啶溶液(索莱宝,北京);RUNX2和骨钙素抗体购自博奥森生物技术有限公司(北京);异硫氰酸荧光素(麦克斯玛生物科技有限公司,中国)。
1.3.3 主要仪器 紫外可见分光光度计(Shimadzu Company,Japan);扫描电子显微镜(Zeiss Sigma 300);流变仪(Anton Paar);荧光显微镜(Olympus FV 1000);Micro-CT扫描仪(比利时,孔蒂奇SkyScan 1076扫描仪)。
1.3.4 实验动物 8周龄雄性家兔33只,体质量2.5-3.0 kg,购自西安市中心医院动物实验中心,许可证号:SYXK(陕)2021-005。2只1周龄新西兰乳兔购自西安市坊洲动物实验室。动物实验已获得西安市中心医院动物伦理委员会批准(批准号:院医伦[2021]52号)。
1.4 实验方法
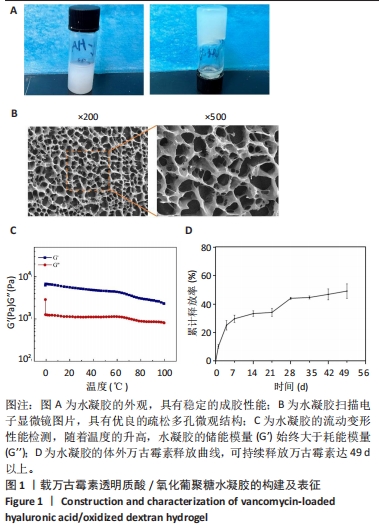
1.4.1 载万古霉素透明质酸/氧化葡聚糖水凝胶的合成 将50 mg透明质酸溶于去离子水中,制备500 mg/mL的透明质酸溶液。将氧化葡聚糖溶于氢氧化钠溶液(100 mg/mL)中,制备最终质量浓度为20 mg/mL的氧化葡聚糖溶液。将透明质酸溶液和氧化葡聚糖溶液以体积比1∶1混合,将溶液的最终pH值调节为7.2,随后将万古霉素加入到混合溶液中,最终万古霉素的质量浓度为10 mg/mL[21]。以同样的方法制备不含有万古霉素的透明质酸/氧化葡聚糖水凝胶,作为对照组。
1.4.2 载万古霉素透明质酸/氧化葡聚糖水凝胶的药物释放 将载万古霉素透明质酸/氧化葡聚糖水凝胶与PBS(pH=7.4)以1∶4的体积比一起注入离心管中,置于恒温培养箱中振荡(37 ℃、100 r/min)。在预定好的间隔时间点,收集1 mL PBS,并加入等量全新的无菌PBS。使用紫外可见分光光度计在280 nm波长处测量收集PBS的吸光度值,计算药物累计释放率。
1.4.3 载万古霉素透明质酸/氧化葡聚糖水凝胶的表征 将载万古霉素的透明质酸/氧化葡聚糖水凝胶在-80 ℃下冷冻6 h,然后在-70 ℃下冻干 48 h,以确保水凝胶中的水分充分排出,对样品进行喷金溅射涂层处理,通过扫描电子显微镜观察载万古霉素透明质酸/氧化葡聚糖水凝胶的表面形态。使用流变仪测定水凝胶的流动变形特性。在 25 ℃下将载万古霉素的透明质酸/氧化葡聚糖水凝胶涂抹到流变仪板上,然后以0.5 ℃/min的速度加热,温度范围为0-100 ℃,在恒定应变(0.1%)和频率(1 Hz)条件下,使用流变仪测量水凝胶存储模量(G′)和损耗模量(G′′)的变化。
1.4.4 载万古霉素透明质酸/氧化葡聚糖水凝胶的生物相容性
兔骨髓间充质干细胞的分离培养:取新西兰乳兔,脱颈处死后暴露四肢骨,用装有1 mL低糖DMEM培养基的注射器对四肢骨髓腔反复冲洗,直至骨髓腔冲洗液变清亮,收集骨髓清洗液至培养皿中,反复吹打骨髓清洗液以消除细胞团,获得细胞悬液[22]。将细胞悬浮在含有体积分数10%胎牛血清和1%青霉素-链霉素的低糖DMEM培养基中,置于37 ℃、体积分数5%CO2培养箱中孵育。传至第3代时用于后续细胞实验。
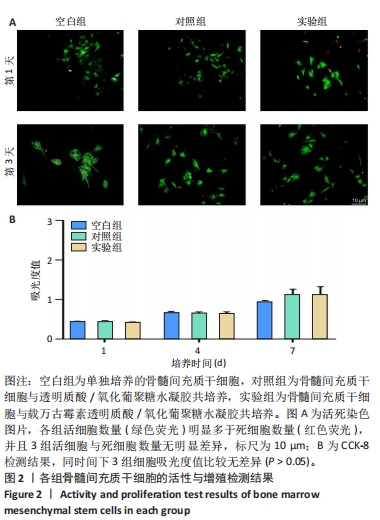
细胞与水凝胶共培养:将兔骨髓间充质干细胞接种于48孔板中,细胞密度为8×103/孔,分3组处理:空白组不进行任何处理,对照组加入200 μL透明质酸/氧化葡聚糖水凝胶,实验组加入200 μL载万古霉素透明质酸/氧化葡聚糖水凝胶,每组3复孔。
活死染色:培养第1,3天,去除培养基,将活/死染色液加入到孔板中,室温避光条件下孵育30 min,去除染色液,用PBS冲洗2次以去除多余的染色液,置于荧光显微镜下观察并拍照。
细胞增殖检测:培养1,4,7 d,每孔中加入CCK-8染色液,置于37 ℃、体积分数5%CO2培养箱中避光孵育3 h,使用紫外可见分光光度计在450 nm处测量吸光度值。
1.4.5 载万古霉素透明质酸/氧化葡聚糖水凝胶的体外促成骨性能
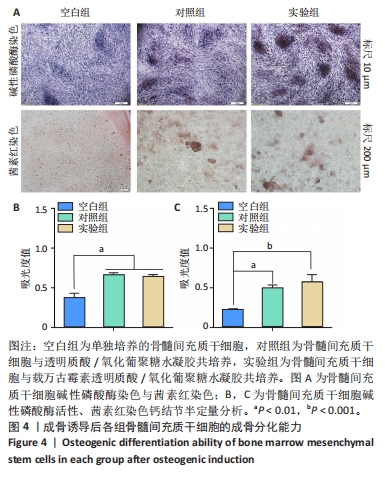
碱性磷酸酶染色:将兔骨髓间充质干细胞接种到6孔板中,细胞密度为 8×104/孔,在培养 24 h后观察到80%以上的细胞贴壁,更换为成骨诱导培养基,分3组处理:空白组不进行任何处理,对照组加入1 mL透明质酸/氧化葡聚糖水凝胶,实验组加入1 mL载万古霉素透明质酸/氧化葡聚糖水凝胶,每组3复孔。成骨诱导培养7 d后,40 g/L多聚甲醛固定细胞30 min,室温下加入 BCIP/NBT碱性磷酸酶显色试避光孵育1 h,置于显微镜下观察并拍照。同时,用RIPA裂解缓冲液充分裂解各组细胞,12 000×g离心1 min,收集上清液于 96孔板中,依次加入显色底物和二乙醇胺缓冲液于37 ℃孵育30 min,加入反应终止液,使用紫外可见分光光度计在405 nm波长处测量吸光度值。
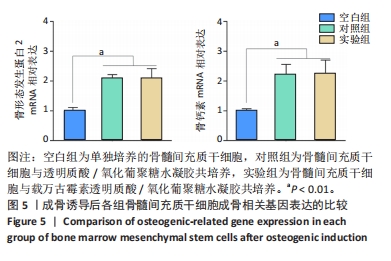
茜素红染色:将兔骨髓间充质干细胞接种到24孔板中,细胞密度为2×104/孔,在培养 24 h后观察到80%以上的细胞贴壁,更换为成骨诱导培养基,分3组处理:空白组不进行任何处理,对照组加入0.2 mL透明质酸/氧化葡聚糖水凝胶,实验组加入0.2 mL载万古霉素透明质酸/氧化葡聚糖水凝胶,每组3复孔。成骨诱导培养14 d后,用PBS洗涤细胞2次,40 g/L多聚甲醛固定细胞30 min,每孔加入茜素红染液孵育1 h,用PBS漂洗样品2次以除去过量的染色液,置于显微镜观察下观察钙结节数量。同时,使用10%氯化十六烷基吡啶溶液溶解所有钙结节,使用紫外可见分光光度计在540 nm处测量吸光度值。
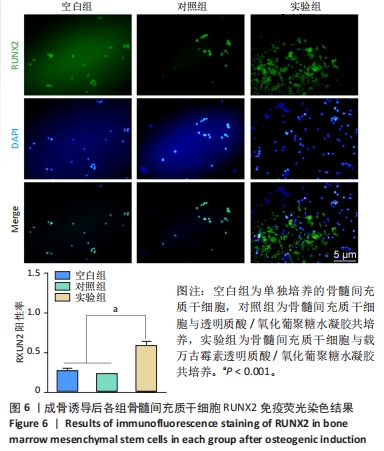
RUNX2免疫荧光染色:细胞接种与分组处理同茜素红染色。成骨诱导培养14 d后,40 g/L多聚甲醛固定细胞30 min,用PBS润洗3次;用0.1%TritonX-100透化细胞15 min,用体积分数10%山羊血清封闭细胞1 h;加入RUNX2抗体(稀释比1∶200)4 ℃下孵育过夜,加入山羊抗兔二抗(稀释比1∶500)于37 ℃下孵育1 h;加入DAPI染液对细胞核染色5 min,置于荧光显微镜下观察并拍照,使用Image J软件统计阳性细胞数量。
RT-qPCR检测:细胞接种与分组处理同茜素红染色。成骨诱导培养14 d后,使用快速提取法提取细胞总RNA,对RNA的纯度进行检测。使用反转录试剂盒将RNA反转录为cDNA,随后使用2×Fast SYBR Green Master Mix在LightCycler 480上进行qPCR扩增,检测骨形态发生蛋白2与骨钙素mNRA表达。特异基因引物序列见表1。以标准化GAPDH作为管家基因,使用2-ΔΔCt法计算目的基因的表达。
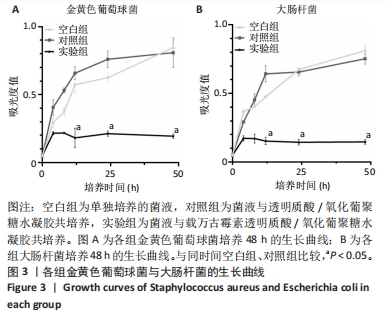
1.4.6 载万古霉素透明质酸/氧化葡聚糖水凝胶的体外抗菌性能 将大肠杆菌(或金黄色葡萄球菌)放入LB培养基中,菌液浓度1×107 CFU/mL,置于37 ℃恒温振荡培养箱(振荡频率120 r/min)中孵育过夜,分3组处理:空白组不进行任何处理,对照组加入0.2 mL透明质酸/氧化葡聚糖水凝胶,实验组加入0.2 mL载万古霉素透明质酸/氧化葡聚糖水凝胶,每组设置3个平行对照。培养12,24,48 h,吸取100 μL细菌悬浮液到96孔培养板中,使用紫外可见分光光度计在 600 nm 波长处检测吸光度值,绘制细菌生长曲线。
1.4.7 载万古霉素透明质酸/氧化葡聚糖水凝胶的体内实验
感染性骨缺损动物模型的建立与分组干预:取33只家兔,腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉后暴露左前臂桡骨,在桡骨中段截取长度为 1.5 cm的骨缺损,然后将浸泡在金黄色葡萄球菌悬浮液(1×107 CFU/mL)中的可吸收明胶海绵植入缺损部位以诱导感染,逐层缝合切口。术后不进行抗生素治疗。2周后随机挑取3只家兔,观察创面是否有窦道形成并获取桡骨标本,进行Giemsa染色和苏木精-伊红染色,以进一步验证感染性骨缺损模型的建立。验证造模成功后,腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉剩余30只家兔,暴露感染性骨缺损区后进行简单清创和冲洗,采用随机数字表法分3组干预:空白组(n=10)不做任何处理,对照组(n=10)骨缺损区注射0.5 mL透明质酸/氧化葡聚糖水凝胶,实验组(n=10)骨缺损区注射0.5 mL载万古霉素透明质酸/氧化葡聚糖水凝胶,逐层缝合切口。术后允许家兔自由活动。注射12周后,麻醉后处死所有家兔,获取左前臂桡骨标本并保存在40 g/L多聚甲醛溶液中,以进行后续相关检测。
Micro-CT扫描:获取桡骨标本后,通过Micro-CT扫描分析骨再生情况,使用多模态三维可视化软件重建每个样本的三维图像,对缺损部位指定感兴趣区域内的骨体积分数和骨密度进行分析,以定量分析新骨形成。
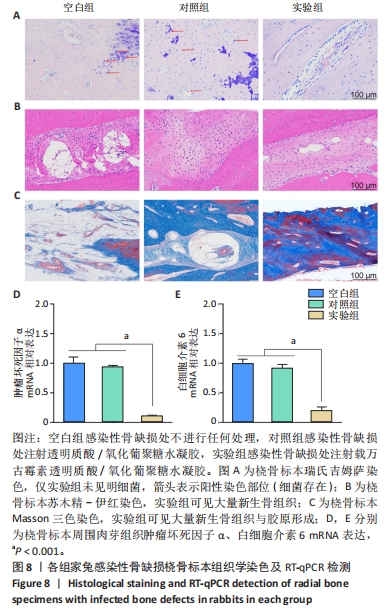
组织形态观察:桡骨样本在Micro-CT扫描后进行分级乙醇系列脱水和脱钙处理,然后将样本固定在石蜡中,切成3.0-4.0 μm厚的切片,分别进行苏木精-伊红、Masson三色与吉姆萨染色,置于显微镜下观察并拍照。
RT-qPCR检测:提取切口处的肉芽组织,使用快速提取法提取组织总RNA,采用RT-qPCR检测肿瘤坏死因子α、白细胞介素6 mNRA表达。检测方法同上。基因引物设计见表1。

免疫组化染色:将脱钙后的骨组织包埋于石蜡中,然后切成5 μm大小的薄片,将切好的薄片分别与RUNX2和骨钙素抗体在4 ℃下孵育过夜,与异硫氰酸荧光素缀合的山羊抗兔疫球蛋白IgG抗体孵育1 h,置于显微镜下观察图像并拍照,使用Image J软件计算RUNX2和骨钙素阳性细胞数量。
1.5 主要观察指标 载万古霉素透明质酸/氧化葡聚糖水凝胶的形貌、力学性能及体外药物释放、生物相容性、抗菌、促成骨分化性能,以及体内修复感染性骨缺损的效果。
1.6 统计学分析 所有实验数据均从3个独立实验中获得,并以x±s格式表示。使用SPSS 19.0软件进行统计分析,组间比较进行t检验或单因素方差分析。P < 0.05为组间差异有显著性意义。该文统计学方法已经西安市中心医院生物统计学专家审核。