2.1 软骨润滑机制
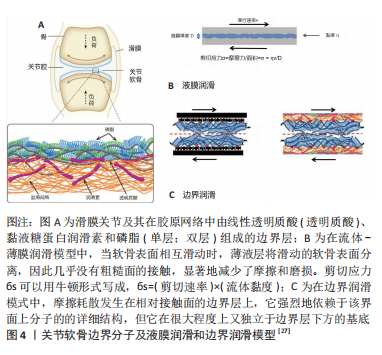
2.1.1 液膜润滑 液膜润滑是指软骨在受到压缩时,在关节表面之间组织液渗出形成流体薄膜,而这种薄膜在关节之间起到支撑负荷和润滑的作用。早在16世纪内科医生Paracelsus就创造了“synovia”一词来表示关节内的流体,并且在早期出版物上最早描述了关节间隙中液体的油性特征。20世纪30年代开始,许多关节润滑理论开始被提出,其中便包括液膜润滑理论。关于软骨润滑的许多早期工作都与流体膜模型有关,而这种模型是由Osborn Reynolds和其他人在机器摩擦学中对滑动轴承的流体动力润滑研究所推动的[9]。1932年,解剖学家MacConaill首次尝试基于流体动力学理论开发出一个关于关节润滑的连贯理论;不久之后,JONES[10]通过在摆锤机上安装一个马膝关节作为支点,对关节摩擦进行了首次详细的实验研究,他们发现干燥关节的摩擦几乎是用滑液或生理盐水润滑时的14倍,并且关节在不润滑时,表面即使负荷很轻也很快就发生损坏,提示关节表面之间存在着一种“流体薄膜”。
弹性流体动力润滑:1960年代,考虑到关节软骨相对于刚性表面的可变形性。软骨表面在接触较大负载时,像齿轮、滚动轴承这些,它们所承受的平均压力都很高,因而在这样的高压之下,润滑剂表现出黏度增加,相互接触的两个表面之间发生弹性变形,所以流体动压理论在这种情况下已经不适用。随着相关研究的不断进展,研究者发现覆盖在关节表面的软骨拥有相对而言较低的弹性模量,所以软骨在很小的负载下就会产生较大的形变,因此随着弹性流体动力润滑理论不断丰富完善,研究者猜想关节面之间的这种润滑机制可能是弹性流体动力润滑。有学者研究了几种力学相关方程,从理论上将压黏方程、弹性方程和Reynolds方程综合求解,这种方程在考虑流体动压润滑的相关问题时,充分关注了弹性变形及压黏变化,因此他们所研究的这种方程也叫作弹性流动方程,简称弹流(Elasto-Hydrodynamic Lubrication,EHL) [11],结果发现,微弹性流体动力润滑作用能够有效消除单面横向粗糙模型的表面粗糙度,这种作用贯穿于稳定行走中所遇到的动态负荷和夹带速度循环中,因此,证实了微弹性流体对滑膜关节润滑的主要作用。
挤压膜理论:在承受较重负载时,关节的相对运动速度一般比较低,有的时候能够接近零,所以此时在关节之间往往难以形成厚的润滑膜;相反,如果关节承受的负载较轻,其相对运动速度也会较大,此时便可以形成较大的厚润滑膜。同时,在关节运动之中,其形成的润滑膜厚度发生变化也需要时间,所以在高速轻载时,关节之间形成的较厚的膜建对于其在由于重载而速度较低时的润滑有着帮助作用,这就是挤压膜润滑的概念。UNSWORTH[12]发现这种挤压膜拥有着极佳的负荷承载能力,因此他猜想在关节承受较重负荷而速度很小时,这时关节内的润滑便由挤压膜发挥主要作用。他设计了一个以关节为枢轴的摆式试验台,来研究并验证这种润滑机制,结果表明当关节突然受到增加的载荷作用时,关节表面处于这种挤压膜的润滑状态;当关节所受载荷较轻时,关节表面产生流体膜以保护表面减少摩擦;而当关节受重载作用时,关节表面的膜厚度变薄甚至消失,致使表面处于边界润滑状态。
渗出润滑与挤压润滑:关节软骨是一种特殊的多孔物质,并且这些孔洞之内都充满着液体。在承受负载时,这些液体受到压力影响开始向关节表面移动并渗透至关节外表面,来减缓这种压力影响,从而充当润滑剂的角色,这种润滑机制称为渗出润滑。同时,这种液体在软骨内外的流动,形成关节之间由流体构成的薄膜,对于关节来说也是有益的。当关节没有承担负荷时,液体储存在多孔的软骨之中;而当有压力负荷作用于软骨时,储存液体就不断从孔洞之中流出,部分抵消端泄的作用,通过增加关节之间膜厚而起到改善润滑作用。
有研究认为在关节软骨之间受力而相互挤压时,软骨间的液体也会随之移动,其中分子质量较低的液体如水等,就会通过软骨中的小孔进入软骨,但一些大分子物质由于无法通过这些小孔而停留在软骨之间,导致软骨间液体成分中水逐渐变少,而这类大分子物质逐渐变多。由于滑液的黏度主要取决于滑液之中透明质酸含量,因此关节受压后经过一系列变化,滑液的黏度将增加,然后关节表面之间形成的流体膜厚度也随之增加。而通过大胆假设,在极端情况下,软骨的水全部进入软骨,滑液之中全都是以透明质酸为主的大分子物质,最终变成一种胶状物质,使得这种边界膜的承载能力大为提高,这种润滑机制即为挤压润滑[13]。
2.1.2 边界润滑 由于关节软骨表面之间的压力较高,而这种高压之下,任何液体都会被挤出,软骨之间的流体膜便会部分或全部消失,形成软骨间局部或全分子接触。当仅有局部分子接触时,软骨之间的液膜和边界润滑都会激活,而摩擦力不管速率如何变化都不会发生改变[14],这也提示形成一种混合润滑机制。而当全分子接触时,关节软骨之间起着主要润滑作用的即为边界润滑机制。
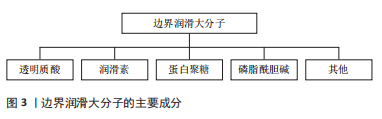
边界润滑是指关节软骨接触表面形成一层薄薄的黏附层(1-10 nm),以维持表面分离和防止负载下的黏着[15]。边界摩擦发生在边界层之间的滑动接触面,而不是滑动层的底层基板,这样摩擦在很大程度上独立于底层基板,主要取决于接触边界层的物理化学性质。常见的边界物质包括透明质酸、蛋白聚糖和润滑素等,见图3。在过去的几十年里,为了理解边界润滑的机制,许多研究都致力于确定分子边界层的性质,下面的内容也主要围绕常见边界层物质展开。
透明质酸是一种长的线性聚合物,广泛存在于滑膜液和关节软骨中,是滑液中在低剪切率时产生高黏性作用的主要分子。透明质酸最初被认为是软骨表面润滑的分子,直至随后的一项实验证明,滑膜液中透明质酸酶消化后对于软骨润滑能力几乎没有影响[16]。尽管如此,透明质酸在临床上也经常作为黏性补充剂注射,来缓解骨关节炎患者症状。由于剪切稀化,这些补充剂以及滑液本身的黏度,在软骨表面的相关剪切速率下变得与水的黏度相当[17]。而一些直接测量表面覆盖有透明质酸涂层模型摩擦系数的实验表明,在生理压力下,透明质酸本身是一种较差的边界润滑剂,μ为0.2-0.5[6]。有研究发现无论是表面吸收的透明质酸或者是共价嫁接的透明质酸,其摩擦系数μ为0.15-0.3,远高于软骨表面的测量值,因此透明质酸不能被认为是软骨表面的显著润滑分子。有实验表明,将蛋白聚糖分子连接到表面附着的透明质酸上,可改善润滑,摩擦系数μ≈0.01,但是仅限于压力在几个大气压之内,若压力超过这个值,μ值会急剧增加。同时,透明质酸能够促进软骨表面的磨损保护[18]。
润滑素是一种长约200 nm、宽约几纳米的细长的黏液糖蛋白。润滑素在人体内由PRG4编码,存在于滑膜液和软骨外浅表区中。在1968年,有学者证明从狗关节表面消化透明质酸并不会影响润滑,相比之下,使用胰蛋白酶消化分解关节表面蛋白质后,得到的摩擦系数增加[19]。于是他们推断某种蛋白质是润滑剂的必要成分,并且猜测这种蛋白质可能与透明质酸一起工作,将透明质酸与软骨连接起来,来促进软骨表面润滑。而之后的几项研究也直接证实了这种联系。有研究提出滑膜液中不含透明质酸的部分含有实际的润滑剂[20],后来RADIN等[16]确定这种物质为糖蛋白,并将其命名为润滑素。早期的实验表明,相对于不含润滑素的盐溶液或含透明质酸的溶液,含有润滑素的溶液摩擦力降低了约2倍。随后许多研究显示,在缺乏润滑素的老鼠软骨关节中,摩擦和磨损有所增加,证明了润滑素在软骨润滑中起着非常重要的作用。然而,一些直接测量的实验证明,润滑素不是一种特别有效的润滑剂,尤其是在关节软骨的高压下,而且润滑素在关节软骨表面润滑中的确切润滑机制仍是不确定的[21]。
ZAPPONE等[22]使用表面力平衡(Surface force balance,SFB)方法发现,仅在低压时在两个含有润滑素的亲水表面之间的摩擦系数相对较低,μ为0.02-0.04;而当压力增加到关节软骨相对应的压力时,摩擦系数μ明显升高,μ值约为0.2。有研究使用胶体探针摩擦力显微镜显示在润滑素边界层的摩擦系数约为0.1,远高于正常软骨表面摩擦系数的值。而其他的研究也表明,润滑素和其他大分子组成的边界层(包括透明质酸和纤维连接蛋白),在生理压力下摩擦系数比正常关节高出一两个数量级。最近的许多研究也关注黏蛋白模型的边界润滑特性[23],因为黏蛋白是一种糖蛋白,它的中心区域具有典型的黏蛋白结构。而这种模型黏蛋白的边界润滑特性与润滑素非常相似,即在低压时摩擦系数为0.02-0.04,而在高压下,摩擦系数急剧增加。总的来说,润滑素在软骨边界润滑中扮演着重要角色,并且润滑素还通过阻止软骨表面滑液细胞生长和蛋白黏附来保护软骨[6]。
磷脂酰胆碱是由2条疏水尾和一个亲水的磷胆碱基团组成的两性分子,广泛存在于滑膜液和软骨中,也被认为是边界润滑中重要的润滑剂。有研究将关节负荷提高至90 kg,关节表面之间的摩擦系数不随滑动速率的变化而变化,在测量的30 min内,摩擦系数仅在0.003-0.007发生了轻微的改变[24]。然而,他们使用了一种良好的溶剂(氯仿/甲醇)清洗关节表面以去除表面脂肪时,摩擦系数增加了约300%,于是他们认为关节软骨的润滑本质上是边界的,而一种“脂类”物质在这个过程中起到非常重要的作用。随后,有研究在1984年提出了关节软骨润滑的另一个概念——表面活性磷脂,这类表面活性磷脂一般指磷脂酰胆碱,具有二酰基尾和磷酸胆碱头基,是滑膜液和关节软骨表面上主要的脂质成分[25]。由于软骨表面基质带负电,他们猜想附着于其上的磷脂酰胆碱应是磷酸胆碱头连接在软骨基质上,露出疏水的酰基尾,在相对滑动平面,两层疏水尾之间相互滑动,来实现软骨表面之间的润滑和磨损的减少。然而,这种摩擦耗散的机制是通过疏水尾接触面之间相对较弱的范德华力的断裂和重塑产生的,这种摩擦系数为0.05-0.10[6],远远高于健康人关节软骨之间的摩擦系数,因而这种模型可能是不正确的。有研究发现,当将透明质酸和二棕榈酰磷脂胆碱的混合物,以多层囊泡形式加入到盐水之中时,在石英表面之间滑动时摩擦系数相当低,约为0.004[25];而当只添加二棕榈酰磷脂时,润滑效果一般,μ值为0.01-0.1。在另一项表面平衡力实验实验中,YU等[26]发现,在含透明质酸的水介质表面加入二油酰磷脂酰胆碱脂质会导致相当高的摩擦系数(μ > 0.5)。总体来说,在这些研究之中,未见一种一致的机制或理论来恰当地解释软骨表面不同的润滑。
2.1.3 水合润滑 水分子的生物学作用主要来源于其分子偶极性质及其结合能力(氢键),而它在润滑之中究竟如何发挥作用?即当2个界面相互滑动时,其中的水分子是如何调控两表面之间的摩擦耗散。水具有持久的流动性——当被限制于分子层厚度的薄膜之中时,其黏度也与正常水相当;而大多数有机溶剂和油被限制于这种类似厚度的薄膜上时,它们的黏度便会发生变化,呈现出一种固体状态。有一项研究也说明了在这种类似薄膜厚度时,不同液体呈现出的不同状态的原因:封闭表面吸引封闭液体,从而使其致密。然而,由于水的固相冰的密度是低于水的,所以致密化抑制了其固化的趋势,而对于大多数非水液体,则是固相密度更大,导致了限制诱导的固化[27]。
RAVIV等[28]首次利用表面力平衡实验来研究云母表面在相对高浓度盐溶液中的摩擦,发现了这种称为水合润滑的机制。水分子总体呈中性,然而由于氢原子和氧原子吸引电子能力不同,导致水分子形成了相对大的电偶极子,在水溶液之中,水分子通过偶极子-电荷相互作用被吸引到电荷周围,水分子通常非常顽强地附着在封闭的电荷上,形成疏松的水合层(壳层)。这种水合层显著降低了封闭电荷的自能(或玻恩能),水化层的水分子需要大量能量才能从水化层中除去,这意味着水化层能够承受较大的法向应力。与此同时,这种水合作用使得水分子与周围自由水分子的交换可以非常迅速,交换速率可达109 s?1(取决于封闭电荷的性质)。这种快速的交换速率意味着水合壳本身相对较快地松弛,因此具有较高的流动性。因此,在载荷作用下,水化层的电荷或离子周围的水合壳具有较强的抗压能力,即水化层中的水不会被挤压出来,而被压缩的水化层在剪切时表现为流态。这种支撑大于压缩负荷的组合,以及流体对剪切的响应,促成了水环境中显著的润滑性能。在一项最近的表面力平衡实验中,有学者直接测量了亲水表面(单晶云母)和旋转浇铸氟聚合物膜的稳定、分子光滑、高度疏水表面之间的水环境中的法向应力和滑动摩擦,结果表明,在水或生理盐水溶液中,接触压达到至少5 065 kPa时,压缩表面滑动时的摩擦系数为0.003-0.009,这很有可能是由于被困在压缩滑动表面之间的薄界面膜中的水合反离子(质子和钠离子) [27]。
水合润滑通过形成亚纳米水合壳来实现润滑,在滑行过程中显著减少摩擦耗散,这种机制已经在其他系统中得到证明,从压缩的带电表面捕获滑过的水合反离子到更加复杂的边界润滑系统,其中包括两性离子聚合物刷、磷脂酰胆碱、水合表面活性剂、生物大分子、仿生聚合物组成的表面边界层。尤其是磷酸胆碱基团,无论是作为聚合物刷上的单体,还是作为表面附着的磷脂酰胆碱脂质或脂质双层,都能提供及其有效的润滑μ≤10-4[27]。当磷脂酰胆碱脂质成分相互滑动时,它们之间的润滑发生在水合磷胆碱头基团层之间的界面上,而水合润滑正是通过在软骨边界层的磷脂酰胆碱脂质来减少摩擦,见图4。
在一项最近的表面力平衡实验中[6],研究从人和牛滑膜液和软骨中提取的边界层磷脂的摩擦表明,在高压下(≥10 132 kPa),它们依旧能够提供极其有效的润滑(μ < 0.001)。因此即使是在高压之下,水合润滑的接触面之间仍存在着一种黏度很低的水合层,它们由磷脂酰胆碱头组固定的,而由于脂质尾部之间的强相互作用,磷脂酰胆碱双分子层能够对高压有很强的抗压能力。
2.1.4 软骨润滑中的超分子协同作用 由先前所述可知,透明质酸、润滑素和磷脂这些在滑膜液和软骨中普遍存在的分子均在软骨润滑中发挥着重要的作用,但是它们中的每一种均不能在关节承受的高压之下,单独提供近乎关节般的有效润滑,而也有许多研究已经发现,它们中的多种分子相互协同,产生及其有效的润滑。
早期的实验表明,单独承载透明质酸的云母表面之间存在的摩擦较高(μ≈0.3),可能是由于透明质酸单体之间较弱的水合作用,这种较弱的水合作用降低了在高压之下水合润滑的效率,导致了更高的能量耗散[3]。有研究者在一项实验中,将透明质酸附着在一个类似于外软骨的表面,发现透明质酸与滑膜关节之中的磷脂酰胆碱复合,形成坚固的边界层,这些边界层即使在最高的生理压力下,也能提供类似于软骨的极低摩擦的特性(μ≈0.001) [3]。LIN等[29]在一项实验中,通过构建滑膜内屈肌腱鞘内滑动的模型,他们发现用透明质酸或单独的磷脂酰胆碱脂质体处理后,相对于盐水对照组肌腱/鞘摩擦系数降低为40%-50%,但它们的组合使用将摩擦系数降低了整整5倍,该结果表明,滑动的生物组织可以通过这种透明质酸与磷脂酰胆碱脂质结合边界润滑层来实现有效的润滑。ZHU等[30]使用表面力平衡方法,在附着了透明质酸的表面之间进行边界润滑的相关研究,并且这些表面以单层囊泡的形式加入了不同的磷脂酰胆碱脂质,结果表明,透明质酸-氢化大豆磷脂酰胆碱复合物润滑非常有效,在生理压力下的摩擦系数值约为0.001,表明了透明质酸和磷脂酰胆碱脂质的协同作用实现了高效的润滑。从不同的研究中发现,磷脂酰胆碱脂质和透明质酸的相互作用可能是磷脂酰基链上的烃类与透明质酸分子上的疏水斑块之间的疏水相互作用;或由两性离子磷胆碱头基团和透明质酸的负电荷羧基之间的偶极电荷相互作用驱动,或由两种作用结合驱动[6]。
润滑素已经被证实是一种非常重要的边界润滑剂,而许多研究也着重关注于它在软骨润滑中的协同润滑作用。在表面通过嫁接的方法加入润滑素与透明质酸,发现不仅可以防止软骨表面的磨损,也可以减少摩擦。有研究将软骨寡聚基质蛋白锚定在中等疏水的聚甲基丙烯酸甲酯表面上并增强了润滑素的润滑能力[31]。
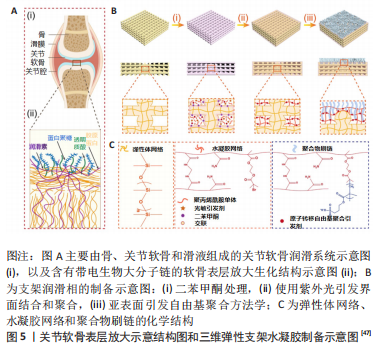
2.2 仿生软骨材料及其摩擦学性能 水凝胶是一种类似于生物组织的、高含水量和低模量的水渗透的三维网状聚合物,它可吸收并存储大量的水,但其本身不溶于水,广泛应用于生物医学设备和再生医学领域。然而,普通的水凝胶与天然软骨相比存在着显著差距,其机械性能较差,并且能量耗散的机制也比较单一,因此只有提高水凝胶的综合性能,才能更好地将水凝胶应用于软骨润滑。合成水凝胶的聚合物来源有很多种,如聚乙二醇、聚乙烯醇和聚丙烯酰胺等,已经广泛用于组织工程水凝胶的制备,然而这些材料由于生物相容性问题使得它们在水凝胶中的应用受限,因此一些天然的大分子在组织工程水凝胶中由于其良好的生物相容性而展现了巨大应用潜力。同时已有研究显示,间充质干细胞对于软骨修复存在有益影响,因此将间充质干细胞结合水凝胶也是水凝胶制备的方向之一。
对于应用于软骨再生和替代的水凝胶材料,应该符合以下几种标准或特性:第一,水凝胶材料必须拥有良好的细胞相容性,因为这些材料最终应用于关节腔内,应避免产生引起免疫反应或炎症;第二,应注意水凝胶和组织之间的连接问题[32],避免由于连接不稳而造成相对位移之后引发相对位移进而导致治疗失败;第三,水凝胶材料应注意细胞亲和力,可以嵌入或附着外源性细胞促进软骨修复[33],另一种是形成诱导内源性间充质干细胞向受伤部位迁移的机制为环境;第四,水凝胶材料应该注意其临床可行性,总体方向是可注射水凝胶和一些喷雾透皮水凝胶等。
而不同水凝胶材料在软骨修复和替代方面的应用潜力究竟如何?研究者应该如何去评价现有水凝胶材料?经查阅相关文献,文章将一些可评价的相关指标作一归纳总结:①机械性能:包括的主要参数为杨氏模量、断裂应力与应变、水凝胶韧性和溶胀比,除此之外,还包括流变性能和抗疲劳性能等指标[34-35],这些性能对于水凝胶能否应用于临床至关重要。②摩擦和抗磨损性能。人正常关节软骨在日常高关节活动中载荷较大,而优异的摩擦性能及抗损耗能力便决定了水凝胶能否维持正常软骨功能并持续较长一段时间。③可降解性:水凝胶过快的降解会影响其在对于软骨的持续修复或缩短材料应用时间。④体内成骨能力[36]:优异的成骨能力对于水凝胶来说尤为重要,能够评价其治疗疗效。⑤药物负载能力:近年来拥有药物负载能力的水凝胶展现出对骨关节炎治疗的巨大潜力,因此可以作为仿生材料的一个极具潜力的方向。
该综述接下来从3种改变水凝胶性能的不同策略入手,总结归纳了使用每种策略的经典仿生软骨材料及当今的研究热点,重点介绍材料的制作方法及其重要的评价性能,主要包括机械性能及润滑性能,除此之外,其必须符合生物相容性。
2.2.1 高性能本体水凝胶软骨材料 研究人员已经开发出许多高强度的、有效的水凝胶,如双网格水凝胶、纳米复合水凝胶和离子交联水凝胶等。双网格水凝胶是一类坚硬的水凝胶,由相对刚性的聚电解质组成主网络,由互穿的、疏松交联的及自由的中性聚合物作为第二网络[27],由GONG等[37]首次聚合形成,通过改变双网格水凝胶网络结构而提升水凝胶综合强度。然而,双网格水凝胶的能量耗散几乎全依赖于第一网格断裂,而在实际应用之中,第一网格断裂之后,由第二网格主导的力学性能将显著降低。而双网格水凝胶的摩擦系数也相对较大,μ≈0.1。KANEKO等[38]通过加入第3个弱交联网络(带负电),并且在双网格水凝胶中加入相同的线性、非交联的、带负电链的聚合物作为原始双网格水凝胶的主要网络,这样的三网络水凝胶在同样的速率之下,摩擦系数值显著低于双网格水凝胶。MILNER
等[39]将仿生边界润滑剂聚(2-甲基丙烯酰氧基乙基磷酸胆碱)的聚合物加入到水凝胶之中,形成了具有边界和双相润滑能力的(2-甲基丙烯酰氧基乙基磷酸胆碱)三网络水凝胶,这种水凝胶在相同的速率之下,摩擦力仅为双网格水凝胶的一半,并且它的屈服应力为26 MPa,比人天然膝关节的峰值应力高一个数量级,这种方法也可为用于生物组织中以提高耐磨性。
研究者根据软骨的层状结构设计了新型双层水凝胶,他们通过将聚乙烯醇和β-磷酸三钙混合,构建了一种新型的一体化双层水凝胶,使用超声分离研磨的分离纳米球制备的β-磷酸三钙使得新型水凝胶的机械性能显著提高,并且提供了类似软骨的润滑效果(μ≈0.05)和高生物相容性,并且这两层与软骨细胞和滑膜间充质干细胞共培养提供了强大的生物功能,能够促进上层的黏附和下层的成骨,有望用于软骨再生[40]。
由于软骨内包含许多小孔结构,许多水凝胶基于此设计成多孔填充式,有研究将大孔水凝胶浸泡在含有可移动聚合物链的水溶液之中,放在玻璃上滑动,与没有聚合物填充的水凝胶相比,摩擦力低了1个数量级[8]。LIN等[41]在水凝胶之中,以多层囊泡的形式加入磷酸酰胆碱脂质,聚合交联形成水凝胶,这些脂质在水凝胶内形成脂质微储层,在表面损耗时微储层中的脂质便能不断释放,重塑软骨表面形成自我润滑水凝胶。同时这种水凝胶与无脂水凝胶相比,表现出持续的低摩擦和极低的磨损,并且加入的脂质体积占比约为1%甚至更低,所以对水凝胶的机械性能几乎没有影响。
因此,通过添加多网络构建水凝胶而不是单一网络,来提升水凝胶本体综合性能是未来高性能水凝胶设计的一个总体方向;并且用于软骨代替的水凝胶除了润滑作用之外,其作为载药载体在关节内释放药物的潜力有待进一步开发,这也大大增加了水凝胶用于软骨替代乃至整个生物医学领域的前景。
2.2.2 水凝胶软骨材料表面润滑改性 人体关节软骨表面含有许多带电大分子,如透明质酸、聚蛋白聚糖和润滑素等,它们在表面延伸形成带电刷状层,增强表面的水化能力,从而实现关节高载荷下的低摩擦[42],于是许多研究者开始研究将一些亲水聚合物刷嫁接到水凝胶表层,以提高界面水化能力来减少摩擦。最开始时,聚合物的固定采用的是物理接枝,但是由于空间位阻的影响,这种接枝方法的接枝率较低,使得表面聚合分子含量较低,水化程度不足以实现有效润滑。与此同时,这种接枝方法在受剪切时,聚合物刷往往会受力脱落而不能产生有效的润滑。因此,各项指标更优的化学接枝法逐渐被广泛采用,研究者开始在聚合物网络中采用化学相互渗透的合成方法。RONG等[43]开发了一种新型水凝胶,该仿生水凝胶通过将亲水性聚电解质接枝至坚硬水凝胶表面以获得双层结构,并且聚合物床层与水凝胶接触区域共价缠绕,两层连续而不易分层,及其类似软骨本身性质。上层的聚合物刷表现出及其优异的性能而底层坚硬的水凝胶基底则提供较强的承载能力。实验表明,这种材料能够在水环境的重载条件下(约10 MPa的接触压力)保持极低的摩擦系数(μ≈0.010),同时其也具备优秀的抗磨损能力。这种构造仿生软骨材料的方法路极具创新性,为之后的材料设计提供了新思路;但其目前还是停留在理论阶段,模型的诸多条件及设计都十分简单,因此要经过进一步研究检验,才能说明其真正的应用潜力。同时,相关研究除了不断提升接触面的润滑性能之外,这种不同性能的分层之间的连接稳固性也值得深入研究。
QU等[44]通过采用碱诱导的网络离解策略,开发了一种层状水凝胶材料,其表层柔软并含有大量孔隙,用以储存润滑剂,而底层非常坚固,表层中的润滑剂能够在滑动过程中释放,从而保证了滑动过程中极其有效的润滑,这种水凝胶也是依靠润滑层与载荷层的结合,从而实现有效的润滑与机械性能。此外,LIU等[45]利用亚表面引发自由基聚合方法学化学反应将聚合物刷接枝到引发剂包埋的温敏性水凝胶基底上,底部的水凝胶基底能够根据温度的变化自动调控载荷承载能力,实现了制备基于温度调控润滑性能的高强度水凝胶。
有研究在水介质中通过一步接枝法制备出刷状的壳聚糖-g-聚[2-(甲基丙烯酰氧基)乙基磷酰胆碱共聚物,这种刷状共聚物具有高效的生物润滑和良好的生物相容性[46],由于聚[2-(甲基丙烯酰氧基)乙基磷酰胆碱侧链的水合特性、共聚物界面的吸附以及流体动力学,该聚合物的润滑性能十分优秀(μ≤0.01),同时体内实验也证明了它减轻关节炎肿胀症状的作用,有望用于关节炎治疗与人工关节润滑。有研究还将三维弹性支架水凝胶基质的承载相和聚电解质刷的表面润滑层组合在一起,亲水聚合物刷是通过化学接枝到三维弹性支架-水凝胶次表面上,而由于三维弹性支架可以分散应力并储存施加在样品上的弹性能量,所以能量的耗散不需要利用牺牲网络或破坏键来完成[47],而这种耗散机制和界面润滑相结合的方式使得复合物在动态剪切下具有出色的减磨功能和耐磨性,使用传统的往复式摩擦学仪器测得的复合材料润滑相的平均摩擦系数约为0.1,因此及其有望用于人工关节仿生材料领域,见图5。
有研究制造了一种水凝胶-弹性体混合表面,水凝胶作为过渡和黏合区渗透到聚合物弹性体基底中,形成的互穿区域保证了混合表面的稳定性和机械强度,在高负荷下这种表面表现出低摩擦系数和耐磨性[48]。他们将二苯甲酮嵌入聚合物基材(如聚二甲基硅氧烷,聚氯乙烯和聚氨酯)的表面,然后通过紫外线照射在聚合物表面引发丙烯酰胺单体的聚合来实现杂化表面,这样的杂化表面即使在很高的负载下(> 10 132 kPa)下也显示出低摩擦系数(μ≈0.05);这种杂化表面在10.9 MPa的压力下依旧能保持超过100 000次循环的润滑性能,所表现出的磨损也十分轻微。有研究通过微流控技术和光聚合工艺制造了一种基于透明质酸的雷帕霉素脂质体(RAPA@Lipo@HMs),这种脂质体通过使用一种光滑的滚动机制和在外表面因磨损而持续释放脂质体以形成自我再生的水合层来改善关节润滑[49]。同时,RAPA@Lipo@HMs可以减轻关节磨损并延缓骨关节炎的进展,为关节提供有效润滑,该脂质体的初始摩擦系数μ值为0.04,在3 600 s摩擦测试中它能在极短的时间内直接将摩擦系数μ降至0.03,并在之后的测试中维持这个低值不变。
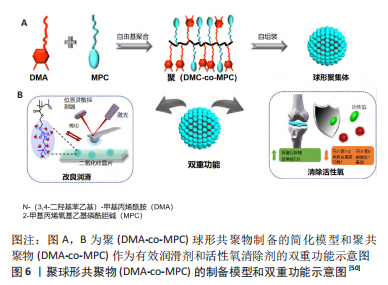
ZHAO等[50]使用2-甲基丙烯酰氧基乙基磷酰胆碱(2-methacryloyloxyethyl phosphorylcholine,MPC)和N-(3,4-二羟基苯乙基)甲基丙烯酰胺(methacrylamide,DMA)通过一系列合成出共聚物P(DMA-co-MPC),见图6。这种共聚物在氧化基的清除和润滑性能方面都有着良好的表现,这主要归功于DMA中氢醌部分的抗氧化功能和MPC中两性离子磷酸胆碱基团的水合润滑作用;他们通过聚[2-(甲基丙烯酰氧基)乙基磷酰胆碱方法对实验中的聚苯乙烯微球和二氧化硅晶片进行改性以模拟关节处摩擦,实验中应用的最大接触压在33-35 MPa,实验表明,摩擦系数μ值随着共聚物浓度的增加而减小(质量浓度为0.1 mg/mL时,μ≈0.018;质量浓度为1 mg/mL时,μ≈0.009),并且共聚物P(DMA-co-MPC)的成份摩尔比为1∶4时润滑性能最佳,这种共聚物在骨关节炎的治疗方面极具潜力。