Chinese Journal of Tissue Engineering Research ›› 2023, Vol. 27 ›› Issue (17): 2729-2737.doi: 10.12307/2023.402
Previous Articles Next Articles
Exercise intervention improves hippocampal cognitive function by regulating insulin-like growth factor 1
Peng Zifu, Guo Xiangying, Fang Hongbo, He Yimin, Jiang Ning
- Institute of Sports and Health, Tianjin Key Laboratory of Exercise Physiology and Sports Medicine, Tianjin University of Sport, Tianjin 301617, China
-
Received:2022-05-21Accepted:2022-06-29Online:2023-06-18Published:2022-10-25 -
Contact:Jiang Ning, PhD, Associate professor, Institute of Sports and Health, Tianjin Key Laboratory of Exercise Physiology and Sports Medicine, Tianjin University of Sport, Tianjin 301617, China -
About author:Peng Zifu, Master candidate, Institute of Sports and Health, Tianjin Key Laboratory of Exercise Physiology and Sports Medicine, Tianjin University of Sport, Tianjin 301617, China -
Supported by:the National Natural Science Foundation of China (General Program), No. 31370021 (to JN)
CLC Number:
Cite this article
Peng Zifu, Guo Xiangying, Fang Hongbo, He Yimin, Jiang Ning. Exercise intervention improves hippocampal cognitive function by regulating insulin-like growth factor 1[J]. Chinese Journal of Tissue Engineering Research, 2023, 27(17): 2729-2737.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
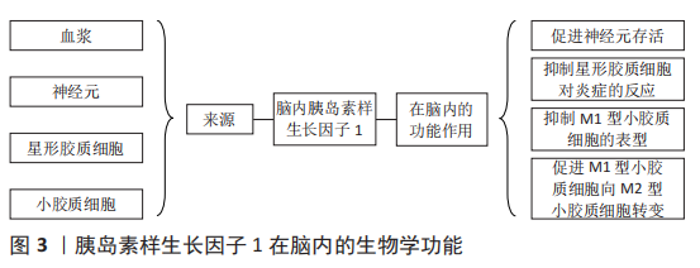
2 结果 Results 2.1 胰岛素样生长因子1概述 胰岛素样生长因子家族于1957年首次被发现,该家族存在2种低分子多肽、2种特异性受体和6种胰岛素样生长因子结合蛋白[9]。机体许多组织细胞均能自分泌和旁分泌胰岛素样生长因子1。外周循环中的胰岛素样生长因子1主要由肝脏分泌,受到垂体生长激素的调控。大脑和其他肝外组织器官分泌的胰岛素样生长因子1不受生长激素调控,但主要在局部发挥生物学作用[10]。外周循环和局部组织的胰岛素样生长因子1均不是以游离的形式存在,而是与胰岛素样生长因子结合蛋白结合,形成复合物,以防止其降解,延长半衰期。在发挥生物学作用时,胰岛素样生长因子1会与胰岛素样生长因子结合蛋白解离,并与胰岛素样生长因子1受体特异性结合,激发后者的酪氨酸活性,活化下游信号通路,发挥相应的生物学作用[11]。 胰岛素样生长因子1在维持大脑功能中发挥着重要作用[12],见图3。"
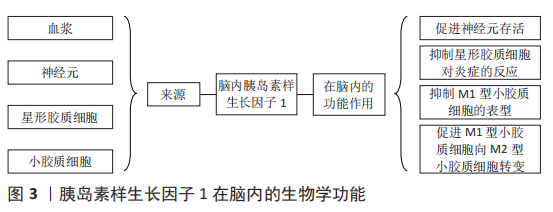

在胎儿时期,胰岛素样生长因子1可影响胎儿脑细胞增殖、凋亡、髓鞘形成、神经发生与成熟,包括脉管系统在内的大多数器官的生长与分化也受胰岛素样生长因子1的影响[13]。在成人大脑中,胰岛素样生长因子1受体的密度会有一定程度的增加,但胰岛素样生长因子1受体的表达只会在特定的功能区域升高,包括海马、杏仁核、丘脑、下丘脑、脉络丛和海马旁回[14],这些大脑区域与情绪、认知和记忆有关,表明胰岛素样生长因子1的表达降低可导致记忆和认知能力的下降[15]。 2.2 运动通过调控胰岛素样生长因子1改善海马认知功能的机制 近年来,关于运动通过调控胰岛素样生长因子1改善海马认知功能的相关研究成果较多[16-21],见图4。"

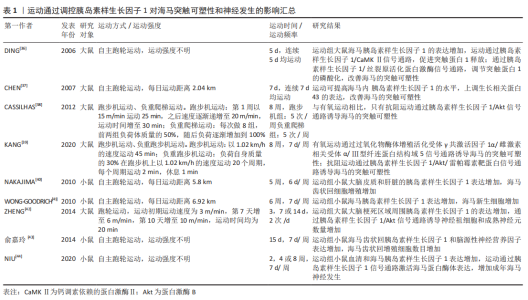
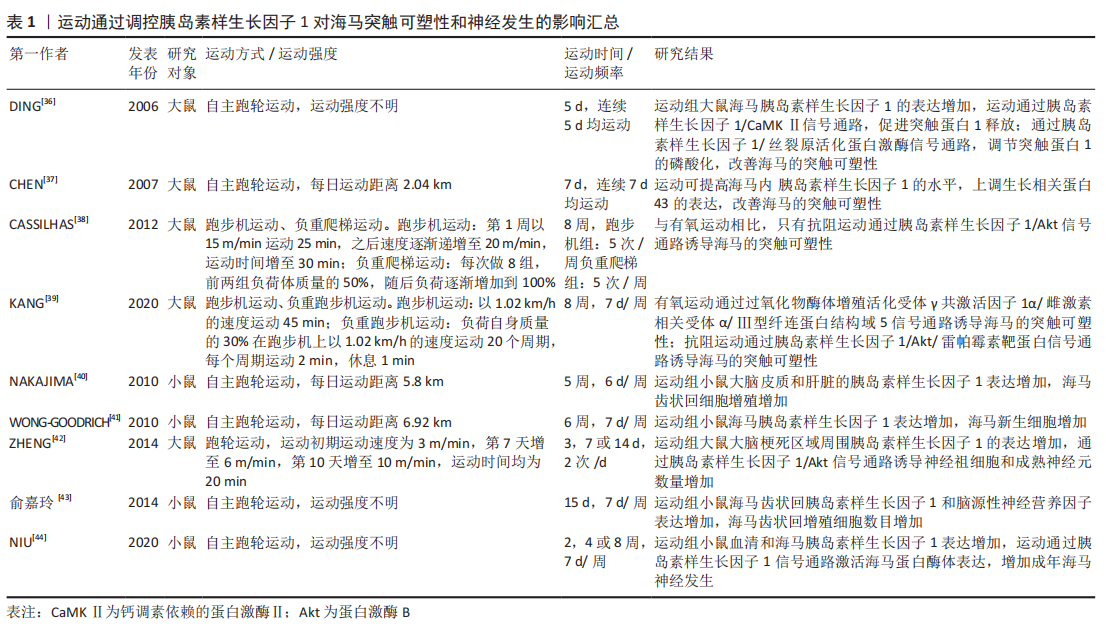
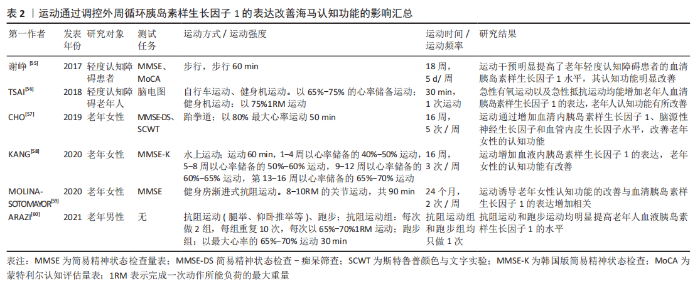
2.2.1 运动通过调控胰岛素样生长因子1抑制海马神经细胞凋亡 凋亡是细胞特有的有序且主动的死亡方式,这种死亡方式受基因所调控。虽然凋亡可防止海马齿状回颗粒细胞的过度生长,但是神经元过度凋亡可影响学习和记忆能力,导致中枢神经系统功能障碍,因此,如何减少神经细胞凋亡的发生显得尤为重要。有研究发现,胰岛素样生长因子1在多种类型的细胞中都具有很强的抗凋亡活性,它可以保护细胞免受各种调亡刺激的影响[22]。胰岛素样生长因子1与胰岛素样生长因子1受体的结合可激活其下游信号通路磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinases B,Akt)/雷帕霉素靶蛋白的表达,该信号通路可通过招募Akt诱导雷帕霉素靶蛋白的上调,进而诱导下游效应子核糖体蛋白S6激酶1和真核翻译起始因子4E结合蛋白1启动蛋白翻译,调节细胞存活、基因表达和细胞骨架重塑[23-24]。Akt通路的激活还可以抑制叉头框蛋白O凋亡通路的表达,并使促凋亡c-Jun氨基末端激酶通路失活,抑制凋亡反应。此外,胰岛素样生长因子1也可以通过丝裂原活化蛋白激酶/细胞外信号调节蛋白激酶通路发挥抗凋亡作用[25]。因此,胰岛素样生长因子1具有较强的抗凋亡活性,其发挥抗凋亡的功能主要通过激活PI3K/Akt以及丝裂原活化蛋白激酶/细胞外信号调节蛋白激酶信号通路来实现,并且在这两条信号通路之间存在一定的交叉激活与抑制反应,表明胰岛素样生长因子1的抗凋亡机制以及相关的信号网络较为复杂,体现了胰岛素样生长因子1在抑制海马神经细胞凋亡中占据重要地位 [23]。 研究发现,规律的体育锻炼可以抑制海马神经元的凋亡,增强学习和记忆能力[26]。然而,有趣的是,在其发挥抗凋亡的过程中,胰岛素样生长因子1的表达水平明显升高,胰岛素样生长因子1/PI3K/Akt信号通路的活性明显上调。在软骨藻酸诱导的脑损伤中,运动可明显提高胰岛素样生长因子1的表达,抑制海马神经元的损伤与死亡,恢复小鼠的空间记忆能力[27]。在脑出血大鼠模型中,7 d的跑台运动可使脑出血大鼠大脑皮质内胰岛素样生长因子1 mRNA水平升高,预防神经元死亡和皮质萎缩[28]。此外,在胰岛素样生长因子1/PI3K/Akt信号通路方面,为期 8周的游泳训练可激活衰老大鼠海马内胰岛素样生长因子1/PI3K/Akt信号通路的表达,抑制海马神经细胞的凋亡,改善海马的功能[21]。与此相似的是,12周的跑步机运动可上调高血压大鼠大脑皮质胰岛素样生长因子1/PI3K/Akt信号通路的表达,抑制大鼠大脑皮质凋亡因子的水平[29]。由此可见,在一系列与脑部损伤相关的疾病中均存在凋亡因子增多的现象,而凋亡细胞因子的增加对于大脑的正常功能是一种潜在威胁,但是运动训练可上调脑内胰岛素样生长因子1的表达以及胰岛素样生长因子1/PI3K/Akt信号通路的活性,降低凋亡因子的水平,保护神经元细胞免受凋亡因子的威胁,改善大脑的健康水平。 2.2.2 运动通过调控胰岛素样生长因子1改善海马突触可塑性 突触可塑性是指新突触的形成和传递功能的建立,分为突触结构的可塑性和传递功能的可塑性。在中枢神经系统中,突触的结构、数量和功能状态与学习和记忆密切相关[30],突触功能的受损可导致海马认知功能障碍,而胰岛素样生长因子1对突触功能的改善具有一定的积极作用。胰岛素样生长因子1的表达升高可诱导突触数量的增加,也可恢复与突触功能相关蛋白的正常功能。在散发性阿尔茨海默病大鼠模型中,向脑室内注射腺病毒介导的胰岛素样生长因子1基因,可明显改善突触标记物的水平,增强海马突触可塑性,改善大鼠的记忆能力[31]。在老年转基因小鼠模型中,小鼠海马齿状回神经干细胞胰岛素样生长因子1特异性过表达可通过钙调素依赖的蛋白激酶Ⅱ/细胞外信号调节蛋白激酶信号通路改善老年小鼠海马认知能力[32]。由此可见,胰岛素样生长因子1对改善突触的结构与功能具有重要的意义,脑内胰岛素样生长因子1水平的升高以及胰岛素样生长因子1相关信号通路的激活可通过改善突触可塑性进而逐渐恢复海马的认知功能,维持海马的健康状态。 关于啮齿动物和人类的研究表明,运动有益于大脑健康 [33-34], 这其中一部分效应归因于运动诱导胰岛素样生长因子1对突触可塑性的改善[35]。研究发现,运动可激活胰岛素样生长因子1/钙调素依赖的蛋白激酶Ⅱ信号通路,调节突触蛋白1释放,改善突触可塑性,并且运动可以通过激活胰岛素样生长因子1/丝裂原活化蛋白激酶信号通路,调节突触蛋白1的磷酸化,促进神经递质的释放[36]。运动也可以通过提高海马内胰岛素样生长因子1的水平,上调生长相关蛋白43的表达,改善海马的突触可塑性[37]。但是,不同的运动方式对海马突触可塑性调控的分子机制不同。在为期8周的有氧运动和抗阻运动中,只有抗阻运动通过上调胰岛素样生长因子1/Akt信号通路的表达,改善海马的突触可塑性[38]。与此相似的是,在抑郁症大鼠模型中,相较于有氧运动而言,抗阻训练倾向于调控胰岛素样生长因子1/Akt/雷帕霉素靶蛋白信号通路的表达,改善海马的突触可塑 性[39]。以上研究显示,胰岛素样生长因子1在调控突触可塑性的过程中具备多条信号通路,并且不同的信号通路之间功能略有不同,其中有的信号通路负责调节突触蛋白的释放,而有的信号通路则负责调节突触蛋白的磷酸化,但是不排除多条信号通路之间共同合作的可能。另外,运动改善海马突触可塑性的过程较为复杂,不同的运动方式在调控海马突触可塑性的过程中经由不同的信号通路,似乎抗阻运动对胰岛素样生长因子1/Akt这一信号通路的表达具有更好的调控作用,但是其具体的机制尚不明确[36-44],相关研究见表1 。"
2.2.3 运动通过调控胰岛素样生长因子1改善海马神经发生 长期以来,人们一直认为中枢神经系统的再生和大脑神经元的更替并不存在,尽管这一说法仍然适用于大多数大脑区域,但是现在研究者们知道,成人大脑中至少存在2个神经发生的区域:侧脑室的脑室下区和海马齿状回的颗粒下区。在海马中,成年海马神经发生是大脑结构可塑性的一种显著表现形式,维持成年海马神经发生的正常功能对于学习和记忆具有重要意义[6]。一些内源性生长因子(如胰岛素样生长因子1)可以直接或间接改善成年哺乳动物侧脑室脑室下区和海马齿状回颗粒下区的神经干细胞的增殖、分化和存活。在神经干细胞过表达胰岛素样生长因子1的转基因小鼠中,胰岛素样生长因子1可通过促分裂原活化蛋白激酶/细胞外信号调节激酶信号通路以及PI3K/Akt信号通路诱导齿状回颗粒下区和侧脑室脑室下区中神经干细胞的增殖和分化。进一步的研究确定,当应用抑制剂抑制细胞外信号调节激酶1/2的磷酸化后,侧脑室的脑室下区和齿状回的颗粒下区中神经干细胞的增殖受到抑制;而当应用抑制剂抑制Akt的磷酸化后,侧脑室的脑室下区和齿状回的颗粒下区中神经干细胞的分化受到抑制[24]。这种现象说明胰岛素样生长因子1在调控神经发生的过程中可经由不同的信号通路,并且不同的信号通路担任的主要功能不同,有的信号通路在神经干细胞的增殖中发挥作用,而有的则在神经干细胞的分化中发挥主要作用,但是不排除在海马神经发生过程中两条信号通路同时激活的可能。 衰老、慢性应激或其他因素可能会阻碍神经发生,而体育锻炼会增强新的神经元的合成。在慢性束缚应激小鼠模型中,自主运动可通过上调大脑胰岛素样生长因子1的表达,增加齿状回的细胞增殖,改善小鼠的认知功能[40]。此外,在各种脑损伤的动物模型中,运动也可以通过调节胰岛素样生长因子1和胰岛素样生长因子1相关信号通路的表达提高海马的神经发生。在全脑照射诱导的脑损伤模型中,小鼠海马齿状回的神经发生减少,而运动可增加海马胰岛素样生长因子1的表达,诱导齿状回神经元的增殖,改善小鼠的记忆能力[41]。此外,在脑缺血大鼠模型中,体育锻炼可激活梗死区域周围胰岛素样生长因子1/AKT信号通路的表达,诱导神经祖细胞以及神经元增殖,改善神经元的功能[42]。自主运动对胰岛素样生长因子1的影响具有脑区特异性,其增加胰岛素样生长因子1等神经发生相关因子的作用仅局限于齿状回区,在其他区域,如阿蒙角以及海马背侧的部分视觉皮质,胰岛素样生长因子1的表达反而下降[43]。有研究发现,在成年和中年小鼠中,自主跑轮运动改善海马神经发生的进展与成年神经祖细胞中的蛋白酶体活性相关[44]。总之,这些研究提示,运动诱导海马胰岛素样生长因子1水平的提高以及胰岛素样生长因子1相关信号通路的激活对于海马神经发生的改善具有重要意义。但是,自主运动对大脑不同部位胰岛素样生长因子1表达的影响似乎存在差异,其对胰岛素样生长因子1水平的提升仅局限于海马的齿状回区,然而这需要更多的研究去验证这一点。部分研究见表1。 从表1中可以看出,运动可通过调控胰岛素样生长因子1的表达改善海马的突触可塑性和神经发生,进而改善海马的认知功能。在运动调控胰岛素样生长因子1改善海马突触可塑性的过程中存在多条信号通路,并且每条通路发挥的作用不同,但不排除多条信号通路协同作用的可能。在运动调控胰岛素样生长因子1改善海马神经发生的过程中,关于自主运动的研究较多,表明自主运动在运动调控胰岛素样生长因子1改善海马神经发生中具有一定的优势,但是关于导致这种情况的原因尚不明确。 2.2.4 运动通过调控胰岛素样生长因子1抑制大脑炎症 海马是认知功能的重要脑区,过度激活的小胶质细胞和神经炎症会诱导神经毒性反应,致使认知功能损伤。然而,有研究显示胰岛素样生长因子1在机体的各个部位均有一定的抗炎功能。在胰腺炎大鼠模型中,通过腹腔注射胰岛素样生长因子1可抑制胰腺大鼠Toll样受体4、核因子κBp65 mRNA的表达,降低白细胞介素6的水平[45]。同样,在肝硬化大鼠模型中,胰岛素样生长因子1治疗可通过抑制Toll样受体4/髓样分化因子88/核因子κB信号通路的表达,降低白细胞介素1β和肿瘤坏死因子α炎症因子水平[46]。在星形胶质细胞中也发现,胰岛素样生长因子1对Toll样受体4信号通路的表达具有一定的调控作用。综上,这些研究提示,胰岛素样生长因子1对Toll样受体4/髓样分化因子88/核因子κB信号通路的表达具有一定的调控作用,胰岛素样生长因子1可通过抑制Toll样受体4信号通路的表达发挥一定抗炎功能[47]。 体育锻炼作为一种维持机体健康的手段,在预防多种生理病理、急性或持续免疫系统激活有关的疾病中发挥着重要作用。研究发现,运动可以通过调控胰岛素样生长因子1的表达抑制脑内的炎症反应,改善大脑的功能[48]。在D-半乳糖诱导的衰老大鼠中,为期8周的游泳运动可促进海马胰岛素样生长因子1的表达,抑制海马内肿瘤坏死因子α和磷酸化核因子κB的表达,改善海马的功能状态[21]。此外,在各种与脑部功能相关的疾病中,运动同样可以通过调控胰岛素样生长因子1的表达改善大脑功能。在脂多糖诱导的轻度认知障碍大鼠模型中,为期6周的抗阻训练可通过激活胰岛素样生长因子1信号通路的表达,降低齿状回的炎症反应,改善大鼠的轻度认知障碍[20]。在创伤性脑损伤小鼠模型中,小鼠脑内白细胞介素1β的表达明显升高,而4周的自主运动可显著提高胰岛素样生长因子1的表达,抑制炎症因子白细胞介素1β的表达,增加齿状回神经发生和神经元的存活率,改善创伤性脑损伤小鼠的认知损伤[49]。以上研究显示,在衰老以及各种脑部疾病中均存在炎症因子表达升高的现象,而炎症因子水平的升高可进一步损害大脑的正常功能,长此以往造成恶性循环,严重威胁机体的健康。但是,运动可提高胰岛素样生长因子1的表达水平,抑制脑内炎症因子的表达,并且不同类型的运动均可产生这种积极效应,例如:有氧运动和抗阻运动。关于运动通过调控胰岛素样生长因子1降低大脑炎症的过程是否与Toll样受体4信号通路的抑制相关还不明确,仍需进一步的研究探索。 2.2.5 运动通过调控外周循环胰岛素样生长因子1的表达改善海马认知功能 研究发现,胰岛素样生长因子1可由多个器官产生,其中肝脏产生大约70%的循环胰岛素样生长因子1[50-51]。外周循环的胰岛素样生长因子1可通过血脑屏障进入脑内,体现了外周循环胰岛素样生长因子1在维持大脑正常功能中发挥着重要作用。研究发现,在小鼠5个月时特异性敲除肝脏胰岛素样生长因子1基因的表达,可使小鼠外周循环中的胰岛素样生长因子1水平显著降低;待小鼠鼠龄18个月时,敲除肝脏胰岛素样生长因子1基因的小鼠学习记忆以及反转学习的能力严重受损,并且这些行为变化与脑三磷酸腺苷水平和海马线粒体氧化磷酸化的效率降低相关[52]。在处于青春期的大鼠中,利用DNA微阵列以及反转录-聚合酶链式反应对基因表达的分析表明,虽然循环中的胰岛素样生长因子1并未改变海马胰岛素样生长因子1或其受体的转录水平,但它会调节涉及微血管结构和功能、大脑发育和突触可塑性相关基因的表达,这对与认知功能相关的大脑结构的发育至关重要[53]。由此可见,外周循环的胰岛素样生长因子1是调控海马认知功能的重要环节。一方面,胰岛素样生长因子1可通过血脑屏障进入脑内,在脑内可发挥相应的生物学功能;另一方面,血液中的胰岛素样生长因子1可影响与海马能量代谢以及海马结构相关的基因的表达,这些过程进一步突出外周循环胰岛素样生长因子1在维持海马正常功能中的重要作用。 有研究发现,运动对外周循环的胰岛素样生长因子1具有一定的调控作用[54]。在患有轻度认知障碍的患者中,有氧运动或抗阻运动也可以通过调节血清胰岛素样生长因子1的表达,减缓这些负面现象[55-56]。在对老年女性的研究中,无论是16周的跆拳道练习、16周的水上运动还是24个月的渐进式抗阻训 练[57-59],都可以提高血液胰岛素样生长因子1水平,改善老年女性的认知功能。同样,在老年男性中,运动也可以通过调控血液胰岛素样生长因子1的表达改善其海马的认知功能。在30名老年男性的研究中,无论是力量训练还是耐力训练,均提高了老年人血液中胰岛素样生长因子1的水平,其认知功能也有一定的改善[60]。除此之外,运动还可以促进外周循环中胰岛素样生长因子1更多的通过血脑屏障进入脑内。在一次性跑台运动实验中,1 h的跑台运动诱导脑内胰岛素样生长因子1水平升高;通过进一步实验发现,脑内胰岛素样生长因子1 mRNA水平并没有显著性变化。因此,脑内胰岛素样生长因子1水平的升高是由于运动增加大脑对外周循环胰岛素样生长因子1的摄取所致[61]。这些研究提示,运动对外周循环胰岛素样生长因子1的表达具有一定的调控作用,并且不同类型的运动都可以对血液胰岛素样生长因子1的水平产生一定的影响,运动对促进外周循环的胰岛素样生长因子1进入脑内同样具有一定的积极作用。在老年人,尤其是轻度认知障碍的患者,运动后血液胰岛素样生长因子1水平的升高对于其海马认知功能的改善具有重要意义。但是,运动改善血液胰岛素样生长因子1水平的运动周期较长,在安排运动处方时除了需要考虑运动时间的安排外,还需特别注意运动强度的调控(尤其是抗阻运动),避免老年人或患者在运动过程中发生运动损伤,相关研究见表2。"
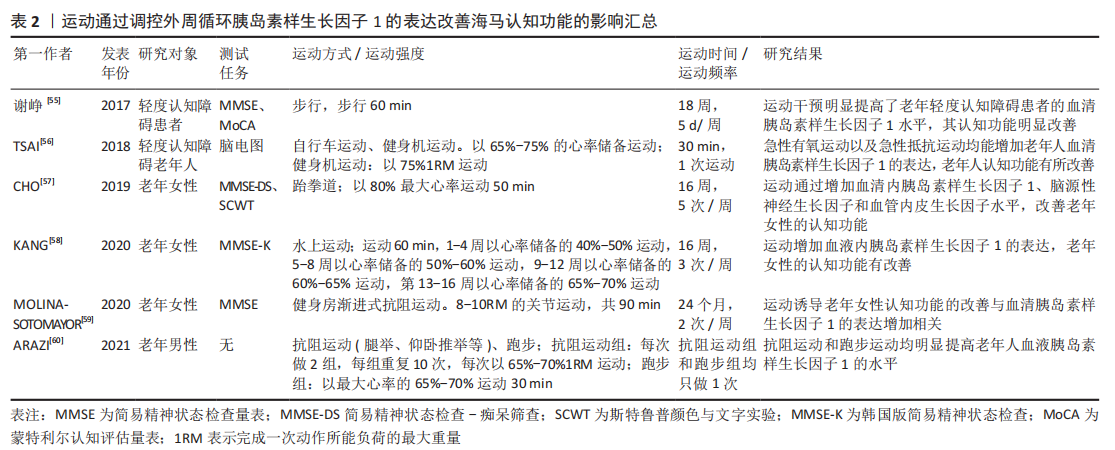

从表2中可以看出,各种形式的运动对老年人以及轻度认知障碍患者的认知功能均有一定的益处,并且这种积极作用均由胰岛素样生长因子1介导。但是,从表中可以看出,通过运动调控血液胰岛素样生长因子1水平改善认知功能的运动周期普遍较长,且运动强度较大。在为老年人以及轻度认知障碍患者安排运动方案时,较为安全的方式是安排逐渐递增的运动负荷,避免运动损伤的发生。 2.3 运动对胰岛素样生长因子1的影响 2.3.1 抗阻运动对胰岛素样生长因子1的影响 抗阻运动是肌肉在克服外来阻力时进行的主动运动,抗阻运动对胰岛素样生长因子1的表达具有重要作用。在Cassilhas等[62]的研究中,为期24周的高强度抗阻运动可明显改善老年男性血液胰岛素样生长因子1水平。但是在Taylor等[63]的研究中,让未进行过抗阻训练的男性分别在65%最大肌力和85%最大肌力下各完成1次抗阻运动,结果发现这两种运动强度均未改变受试者血液胰岛素样生长因子1的水平[63]。导致这种差异的原因可能是运动时间,即在较长时间下进行高强度抗阻运动才可能使血液胰岛素样生长因子1水平发生明显变化。与此相似的是,海马内胰岛素样生长因子1的表达变化可能与抗阻运动的运动时间同样相关。为期8周的渐进性抗阻运动则可明显提高大鼠海马内胰岛素样生长因子1的水平[64],而单次抵抗运动并没有改变大鼠海马内胰岛素样生长因子1的表达[65]。在一项关于抗阻运动后胰岛素样生长因子1水平的性别差异研究中,虽然运动都增加了男性和女性胰岛素样生长因子1的表达,但是只有女性的胰岛素样生长因子1的水平在运动后4 h后仍高于静息水平,男性的胰岛素样生长因子1水平已恢复到静息水平,导致这种现象的原因尚不明确[66]。以上研究提示,抗阻运动对胰岛素样生长因子1的影响同样存在诸多影响因素,主要包括运动时间,运动强度以及性别,其中较为关键的因素可能是运动时间。在高强度下进行中长期的抗阻运动可能对胰岛素样生长因子1表达的影响更为明显。在性别方面,抗阻运动后胰岛素样生长因子1的高水平在女性中维持的时间较长,而在男性中则较短,导致这种差异的原因尚不明确。另外,外周循环以及脑内胰岛素样生长因子1的表达对运动的反应相似,当血液胰岛素样生长因子1表达升高的同时脑内胰岛素样生长因子1的表达也升高,其部分原因可能是由于血液中的胰岛素样生长因子1可通过血脑屏障进入脑内。 2.3.2 有氧运动对胰岛素样生长因子1的影响 有氧运动是体育运动中的一个分支,主要是在氧气供应充足的情况下进行的一系列活动,常见的有氧运动主要包括步行、跑步及游泳等。大量研究证实,有氧运动对胰岛素样生长因子1的表达同样具有一定的调控作用,但是性别不同运动后血清胰岛素样生长因子1的变化不同。在雄性和雌性大鼠中的研究发现,尽管运动后雄性和雌性大鼠海马内胰岛素样生长因子1水平均明显升高,但是血液内胰岛素样生长因子1的水平仅在雄性大鼠中明显升高,雌性大鼠血液中胰岛素样生长因子1水平未发生明显变化[67]。此外,随着年龄的增长,老年人血液内胰岛素样生长因子1的浓度呈现逐渐降低的趋势,而运动可明显提高老年人血液中胰岛素样生长因子1的水平[68]。不同强度的有氧运动对血液胰岛素样生长因子1的影响也存在一定差异。在慢性脑卒中患者的研究中,高强度间歇运动可明显提高患者血液胰岛素样生长因子1的水平,而中等强度运动对患者血液胰岛素样生长因子1的水平未有显著影响[69]。另外,不同的人群在运动后血清胰岛素样生长因子1的变化不同。在急性有氧运动后,阿尔茨海默病患者血液中胰岛素样生长因子1水平明显升高,但无痴呆的老年人血液中胰岛素样生长因子1的水平却未发生变化[70]。以上研究显示,有氧运动对胰岛素样生长因子1的表达具有一定的调控作用,但是有氧运动对胰岛素样生长因子1的表达调控受到一定因素的干扰,例如:受试者类型、受试者性别和运动强度,表明有氧运动这一干预手段对机体的影响较为复杂,且运动后胰岛素样生长因子1的水平变化存在较大个体差异。但是,目前关于导致这些情况发生的原因尚不明确,在往后的实验研究中可着重探讨这类情况。不同运动类型对胰岛素样生长因子1表达的影响相关研究成果见表3。 从表3中可以看出,不同类型的运动均可以对胰岛素样生长因子1的表达产生一定的影响,其中包括有氧运动和抗阻运动。但是二者对胰岛素样生长因子1的调控均受到一定因素的干扰,例如运动强度和运动时间。相较于抗阻运动,胰岛素样生长因子1对有氧运动的反应更敏感。在进行短期的中等强度有氧运动或急性高强度有氧运动后胰岛素样生长因子1可发生明显变化,而抗阻运动只有在短期高等强度运动后才会对胰岛素样生长因子1的表达产生明显影响。"

| [1] 何万利,黄刚,赵莲萍.认知障碍的海马多模态MRI研究进展[J].磁共振成像,2021,12(4):111-114. [2] GU X, ZHAO M, HAN X, et al. Presenilin-1 mutation is associated with a hippocampus defect in alzheimer’s disease: meta-analysis for neuroimaging research. Clin Neurol Neurosurg. 2020;191:105679. [3] NAZIFI M, ORYAN S, ESFAHANI D, et al. The functional effects of piperine and piperine plus donepezil on hippocampal synaptic plasticity impairment in rat model of Alzheimer’s disease. Life Sci. 2021;265:118802. [4] WANG Y, FENG L, LIU S, et al. Transcranial magneto-acoustic stimulation improves neuroplasticity in hippocampus of parkinson’s disease model mice. Neurotherapeutics. 2019;16(4):1210-1224. [5] DYER A, VAHDATPOUR C, SANFELIU A, et al. The role of insulin-like growth factor 1 (IGF-1) in brain development,maturation and neuroplasticity. Neuroscience. 2016;325:89-99. [6] ABBOTT L, NIGUSSIE F. Adult neurogenesis in the mammalian dentate gyrus. Anat Histol Embryol. 2020;49(1):3-16. [7] SELLES M, FORTUNA J, ZAPPA-VILLAR M, et al. Adenovirus-mediated transduction of insulin-like growth factor 1 protects hippocampal neurons from the toxicity of aβ oligomers and prevents memory loss in an alzheimer mouse model. Mol Neurobiol. 2020;57(3):1473-1483. [8] TAI F, WANG C, DENG X, et al. Treadmill exercise ameliorates chronic REM sleep deprivation-induced anxiety-like behavior and cognitive impairment in C57BL/6J mice. Brain Res Bull. 2020;164:198-207. [9] 任瑞瑞,李文艳,王冬梅.胰岛素样生长因子1在病理性疼痛中的作用机制[J].中国生物化学与分子生物学报,2021,37(7):856-862. [10] SHEARIN S, BRAITSCH M, QUERRY R. The effect of a multi-modal boxing exercise program on cognitive locomotor tasks and gait in persons with Parkinson disease. NeuroRehabilitation. 2021;49(4):619-627. [11] 翟丽倩,陈晓芬,卢思彤,等.胰岛素样生长因子1(IGF-1)通过激活PI3K/AKT信号通路增强小鼠BV-2小胶质细胞的吞噬功能[J].细胞与分子免疫学杂志,2021,37(3):199-204. [12] 张玥熠,杨青,冯莉娟,等.胰岛素样生长因子1在中枢神经系统疾病发生发展中的作用及机制研究进展[J].山东医药,2022,62(2):100-103. [13] HELLSTRöM A, LEY D, HANSEN-PUPP I, et al. Insulin-like growth factor 1 has multisystem effects on foetal and preterm infant development. Acta Paediatr. 2016;105(6):576-586. [14] SONNTAG W, DEAK F, ASHPOLE N, et al. Insulin-like growth factor-1 in CNS and cerebrovascular aging. Front Aging Neurosci. 2013;5:27. [15] FORBES B. Two years in IGF research. Growth Horm IGF Res. 2016;30-31: 70-74. [16] POEHLMAN E, ROSEN C, COPELAND K. The influence of endurance training on insulin-like growth factor-1 in older individuals. Metabolism. 1994; 43(11):1401-1405. [17] TREJO J, CARRO E, TORRES-ALEMAN I. Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. J Neurosci. 2001;21(5):1628-1634. [18] PLOUGHMAN M, GRANTER-BUTTON S, CHERNENKO G, et al. Endurance exercise regimens induce differential effects on brain-derived neurotrophic factor, synapsin-I and insulin-like growth factor I after focal ischemia. Neuroscience. 2005;136(4):991-1001. [19] LLORENS-MARTíN M, TORRES-ALEMáN I, TREJO J. Exercise modulates insulin-like growth factor 1-dependent and -independent effects on adult hippocampal neurogenesis and behaviour. Mol Cell Neurosci. 2010;44(2): 109-117. [20] KELTY T, SCHACHTMAN T, MAO X, et al. Resistance-exercise training ameliorates LPS-induced cognitive impairment concurrent with molecular signaling changes in the rat dentate gyrus. J Appl Physiol (1985). 2019; 127(1):254-263. [21] LIN J, KUO W, BASKARAN R, et al. Swimming exercise stimulates IGF1/ PI3K/Akt and AMPK/SIRT1/PGC1α survival signaling to suppress apoptosis and inflammation in aging hippocampus. Aging (Albany NY). 2020;12(8): 6852-6864. [22] LI H, KONG R, WAN B, et al. Initiation of PI3K/AKT pathway by IGF-1 decreases spinal cord injury-induced endothelial apoptosis and microvascular damage. Life Sci. 2020;263:118572. [23] COSTALES J, KOLEVZON A. The therapeutic potential of insulin-like growth factor-1 in central nervous system disorders. Neurosci Biobehav Rev. 2016; 63:207-222. [24] YUAN H, CHEN R, WU L, et al. The regulatory mechanism of neurogenesis by 胰岛素样生长因子1 in adult mice. Mol Neurobiol. 2015;51(2):512-522. [25] WEN X, JIAO L, TAN H. MAPK/ERK pathway as a central regulator in vertebrate organ regeneration. Int J Mol Sci. 2022;23(3):1464. [26] 朱洪竹,朱梅菊.有氧运动联合螺旋藻营养补充对2型糖尿病大鼠学习记忆的影响及其机制[J].天然产物研究与开发,2021,33(11):1845-1853. [27] CARRO E, TREJO J, BUSIGUINA S, et al. Circulating insulin-like growth factor I mediates the protective effects of physical exercise against brain insults of different etiology and anatomy. J Neurosci. 2001;21(15):5678-5684. [28] TAMAKOSHI K, HAYAO K, TAKAHASHI H. Early exercise after intracerebral hemorrhage inhibits inflammation and promotes neuroprotection in the sensorimotor cortex in rats. Neuroscience. 2020;438:86-99. [29] LIU Y, CUI Z, YANG A, et al. Anti-apoptotic and pro-survival effect of exercise training on early aged hypertensive rat cerebral cortex. Aging (Albany NY). 2021;13(16):20495-20510. [30] YU L, DUAN Y, ZHAO Z, et al. Hydroxysafflor Yellow A (HSYA) improves learning and memory in cerebral ischemia reperfusion-injured rats via recovering synaptic plasticity in the hippocampus. Front Cell Neurosci. 2018;12:371. [31] ZAPPA VILLAR M, LóPEZ HANOTTE J, CRESPO R, et al. Insulin-like growth factor 1 gene transfer for sporadic Alzheimer’s disease: new evidence for trophic factor mediated hippocampal neuronal and synaptic recovery-based behavior improvement. Hippocampus. 2021;31(10):1137-1153. [32] HU A, YUAN H, WU L, et al. The effect of constitutive over-expression of insulin-like growth factor 1 on the cognitive function in aged mice. Brain Res. 2016;1631:204-213. [33] HENDRIKSE J, CHYE Y, THOMPSON S, et al. Regular aerobic exercise is positively associated with hippocampal structure and function in young and middle-aged adults. Hippocampus. 2022;32(3):137-152. [34] KIM T, BAEK K, YU H, et al. High-intensity exercise improves cognitive function and hippocampal brain-derived neurotrophic factor expression in obese mice maintained on high-fat diet. J Exerc Rehabil. 2020;16(2):124-131. [35] NIE J, YANG X. Modulation of Synaptic Plasticity by Exercise Training as a Basis for Ischemic Stroke Rehabilitation. Cell Mol Neurobiol. 2017;37(1):5-16. [36] DING Q, VAYNMAN S, AKHAVAN M, et al. Insulin-like growth factor I interfaces with brain-derived neurotrophic factor-mediated synaptic plasticity to modulate aspects of exercise-induced cognitive function. Neuroscience. 2006;140(3):823-833. [37] CHEN M, RUSSO-NEUSTADT A. Running exercise-and antidepressant-induced increases in growth and survival-associated signaling molecules are IGF-dependent. Growth Factors. 2007;25(2):118-131. [38] CASSILHAS R, LEE K, FERNANDES J, et al. Spatial memory is improved by aerobic and resistance exercise through divergent molecular mechanisms. Neuroscience. 2012;202:309-317. [39] KANG J, WANG Y, WANG D. Endurance and resistance training mitigate the negative consequences of depression on synaptic plasticity through different molecular mechanisms. Int J Neurosci. 2020;130(6):541-550. [40] NAKAJIMA S, OHSAWA I, OHTA S, et al. Regular voluntary exercise cures stress-induced impairment of cognitive function and cell proliferation accompanied by increases in cerebral IGF-1 and GST activity in mice. Behav Brain Res. 2010;211(2):178-184. [41] WONG-GOODRICH S, PFAU M, FLORES C, et al. Voluntary running prevents progressive memory decline and increases adult hippocampal neurogenesis and growth factor expression after whole-brain irradiation. Cancer Res. 2010;70(22):9329-9338. [42] ZHENG H, ZHANG L, LUO J, et al. Physical exercise promotes recovery of neurological function after ischemic stroke in rats. Int J Mol Sci. 2014;15(6): 10974-10988. [43] 俞嘉玲,马黎,马兰,等.自主跑轮运动上调成年小鼠海马齿状回区细胞增殖及BDNF、IGF1和WNT4的表达水平[J].生理学报,2014,66(5): 559-568. [44] NIU X, ZHAO Y, YANG N, et al. Proteasome activation by insulin-like growth factor-1/nuclear factor erythroid 2-related factor 2 signaling promotes exercise-induced neurogenesis. Int J Mol Sci. 2020;38(2):246-260. [45] WANG J, ZHANG C, XU P, et al. Phosphoinositide 3‑kinase/protein kinase B regulates inflammation severity via signaling of Toll‑like receptor 4 in severe acute pancreatitis. Mol Med Rep. 2018;17(6):7835-7844. [46] ZHAO T, ZHU Y, YAO L, et al. IGF-1 alleviates CCL4-induced hepatic cirrhosis and dysfunction of intestinal barrier through inhibition TLR4/NF-κB signaling mediated by down-regulation HMGB1. Ann Hepatol. 2021;26:100560. [47] BELLINI M, HEREñú C, GOYA R, et al. Insulin-like growth factor-I gene delivery to astrocytes reduces their inflammatory response to lipopolysaccharide. J Neuroinflammation. 2011;8:21. [48] SCHEFFER D, LATINI A. Exercise-induced immune system response: anti-inflammatory status on peripheral and central organs. Biochim Biophys Acta Mol Basis Dis. 2020;1866(10):165823. [49] PIAO C, STOICA B, WU J, et al. Late exercise reduces neuroinflammation and cognitive dysfunction after traumatic brain injury. Neurobiol Dis. 2013;54:252-263. [50] GE L, LIU S, RUBIN L, et al. Research progress on neuroprotection of insulin-like growth factor-1 towards glutamate-induced neurotoxicity. Cells. 2022; 11(4):666. [51] STANLEY T, FOURMAN L, ZHENG I, et al. Relationship of IGF-1 and IGF-binding proteins to disease severity and glycemia in nonalcoholic fatty liver disease. J Clin Endocrinol Metab. 2021;106(2):e520-e533. [52] PHARAOH G, OWEN D, YEGANEH A, et al. Disparate central and peripheral effects of circulating IGF-1 deficiency on tissue mitochondrial function. Mol Neurobiol. 2020,57(3):1317-1331. [53] YAN H, MITSCHELEN M, BIXLER G, et al. Circulating IGF1 regulates hippocampal IGF1 levels and brain gene expression during adolescence. Mol Neurobiol. 2011;211(1):27-37. [54] ŻEBROWSKA A, SIKORA M, KONARSKA A, et al. Moderate intensity exercise in hypoxia increases IGF-1 bioavailability and serum irisin in individuals with type 1 diabetes. Ther Adv Endocrinol Metab. 2020;11:2042018820925326. [55] 谢峥,吴永华.运动干预对老年MCI患者认知功能及血清胰岛素样生长因子1水平的影响[J].黑龙江医药,2017,30(3):516-518. [56] TSAI C, UKROPEC J, UKROPCOVá B, et al. An acute bout of aerobic or strength exercise specifically modifies circulating exerkine levels and neurocognitive functions in elderly individuals with mild cognitive impairment. Neuroimage Clin. 2018;17:272-284. [57] CHO S, ROH H. Taekwondo enhances cognitive function as a result of increased neurotrophic growth factors in elderly women. Int J Environ Res Public Health. 2019;16(6):962. [58] KANG D, BRESSEL E, KIM D. Effects of aquatic exercise on insulin-like growth factor-1,brain-derived neurotrophic factor,vascular endothelial growth factor,and cognitive function in elderly women. Exp Gerontol. 2020;132:110842. [59] MOLINA-SOTOMAYOR E, CASTILLO-QUEZADA H, MARTíNEZ-SALAZAR C, et al. Effects of progressive resistance training on cognition and IGF-1 levels in elder women who live in areas with high air pollution. Int J Environ Res Public Health. 2020;17(17):6203. [60] ARAZI H, BABAEI P, MOGHIMI M, et al. Acute effects of strength and endurance exercise on serum BDNF and IGF-1 levels in older men. BMC Geriatr. 2021;21(1):50. [61] CARRO E, NUñEZ A, BUSIGUINA S, et al. Circulating insulin-like growth factor I mediates effects of exercise on the brain. J Neurosci. 2000;20(8):2926-2933. [62] CASSILHAS R, ANTUNES H, TUFIK S, et al. Mood, anxiety,and serum IGF-1 in elderly men given 24 weeks of high resistance exercise. Percept Mot Skills. 2010;110(1):265-276. [63] TAYLOR L, WILBORN C, KREIDER R, et al. Effects of resistance exercise intensity on extracellular signal-regulated kinase 1/2 mitogen-activated protein kinase activation in men. J Strength Cond Res. 2012;26(3):599-607. [64] CASSILHAS R, LEE K, VENâNCIO D, et al. Resistance exercise improves hippocampus-dependent memory. Braz J Med Biol Res. 2012;45(12):1215-1220. [65] FERNANDES J, SOARES J, DO AMARAL BALIEGO L, et al. A single bout of resistance exercise improves memory consolidation and increases the expression of synaptic proteins in the hippocampus. Hippocampus. 2016; 26(8):1096-1103. [66] ASTILL B, KATSMA M, CAUTHON D, et al. Sex-based difference in Achilles peritendinous levels of matrix metalloproteinases and growth factors after acute resistance exercise. J Appl Physiol (1985). 2017;122(2):361-367. [67] UYSAL N, AGILKAYA S, SISMAN A, et al. Exercise increases leptin levels correlated with IGF-1 in hippocampus and prefrontal cortex of adolescent male and female rats. J Chem Neuroanat. 2017;81:27-33. [68] CHEN H, CHUNG Y, CHEN Y, et al. Effects of different types of exercise on body composition,muscle strength, and IGF-1 in the elderly with sarcopenic obesity. J Am Geriatr Soc. 2017;65(4):827-832. [69] BOYNE P, MEYROSE C, WESTOVER J, et al. Effects of exercise intensity on acute circulating molecular responses poststroke. Neurorehabil Neural Repair. 2020;34(3):222-234. [70] STEIN A, DA SILVA T, COELHO F, et al. Acute exercise increases circulating IGF-1 in Alzheimer’s disease patients,but not in older adults without dementia. Behav Brain Res. 2021;396:112903. [71] NASCIMENTO M, GERAGE A, SILVA D, et al. Effect of resistance training with different frequencies and subsequent detraining on muscle mass and appendicular lean soft tissue, IGF-1, and testosterone in older women. Eur J Sport Sci. 2019;19(2):199-207. [72] GATTI R, DE PALO E, ANTONELLI G, et al. IGF-I/IGFBP system: metabolism outline and physical exercise. J Endocrinol Invest. 2012;35(7):699-707. [73] DING Y, CHANG C, XIE L, et al. Intense exercise can cause excessive apoptosis and synapse plasticity damage in rat hippocampus through Ca²⁺ overload and endoplasmic reticulum stress-induced apoptosis pathway. Chin Med J (Engl). 2014;127(18):3265-3271. [74] YAU S, GIL-MOHAPEL J, CHRISTIE B, et al. Physical exercise-induced adult neurogenesis:a good strategy to prevent cognitive decline in neurodegenerative diseases? Biomed Res Int. 2014;2014:403120. [75] NISHIDA Y, MATSUBARA T, TOBINA T, et al. Effect of low-intensity aerobic exercise on insulin-like growth factor-I and insulin-like growth factor-binding proteins in healthy men. Int J Endocrinol. 2010;2010:452820. [76] BAKER L, FRANK L, FOSTER-SCHUBERT K, et al. Effects of aerobic exercise on mild cognitive impairment: a controlled trial. Arch Neurol. 2010;67(1):71-79. |
| [1] | Nong Fuxiang, Jiang Zhixiong, Li Yinghao, Xu Wencong, Shi Zhilan, Luo Hui, Zhang Qinglang, Zhong Shuang, Tang Meiwen. Bone cement augmented proximal femoral nail antirotation for type A3.3 intertrochanteric femoral fracturalysis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(在线): 1-10. |
| [2] | Pan Zhongjie, Qin Zhihong, Zheng Tiejun, Ding Xiaofei, Liao Shijie. Targeting of non-coding RNAs in the pathogenesis of the osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1441-1447. |
| [3] | Cai Zhihao, Xie Zhaoyong. Femoral neck anteversion measurement assessment: how to establish a unified method and standard [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1448-1454. |
| [4] | Dang Yi, Du Chengyan, Yao Honglin, Yuan Nenghua, Cao Jin, Xiong Shan, Zhang Dingmei, Wang Xin. Hormonal osteonecrosis and oxidative stress [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1469-1476. |
| [5] | Nie Chenchen, Su Kaiqi, Gao Jing, Fan Yongfu, Ruan Xiaodi, Yuan Jie, Duan Zhaoyuan, Feng Xiaodong. The regulatory role of circular RNAs in cerebral ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1286-1291. |
| [6] | Liang Jiaqi, Liu Hengxu, Yang Jinxin, Yang Yi, Deng Xuhui, Tan Mingjian, Luo Jiong. Health benefit relationship between exercise and intestinal bacteria [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1292-1299. |
| [7] | Gao Yu, Han Jiahui, Ge Xin. Immunoinflammatory microenvironment after spinal cord ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1300-1305. |
| [8] | Huang Linke, Wei Linhua, Jiang Jie, Liu Qian, Chen Weiwei. Effects of estrogen combined with treadmill exercise on bone mass and articular cartilage in ovariectomized mice [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1166-1171. |
| [9] | Ruan Ling, Wang Guanghua, Wu Rongping, Jin Zhan, Lyu Zhenqing, Zhang Nan, Li Shoubang. Correlation between exercise intensity and lipid metabolism disorder and oxidative stress in a high-diet rat model [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1149-1155. |
| [10] | Zhang Yan, He Ruibo, Wang Qingbo, Pi Yihua, Lu Chunmin, Xu Chuanyi, Ma Gang, Peng Peng. Effects of aerobic exercises with different load volumes on inflammatory response and insulin signaling pathway of skeletal muscle in obese rats [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1237-1244. |
| [11] | Wu Dongzhe, Gao Xiaolin, Li Chuangtao, Wang Hao. Constructing the prediction model of maximal oxygen uptake by back-propagation neural network based on the cardiorespiratory optimal point [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1224-1231. |
| [12] | Wang Ji, Zhang Min, Yang Zhongya, Zhang Long. A review of physical activity intervention in type 2 diabetes mellitus with sarcopenia [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1272-1277. |
| [13] | Xu Xingxing, Wen Chaoju, Meng Maohua, Wang Qinying, Chen Jingqiao, Dong Qiang. Carbon nanomaterials in oral implant [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1062-1070. |
| [14] | Li Cheng, Zheng Guoshuang, Kuai Xiandong, Yu Weiting. Alginate scaffold in articular cartilage repair [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1080-1088. |
| [15] | Chen Shisong, Liu Xiaohong, Xu Zhiyun. Current status and prospects of bioprosthetic heart valves [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1096-1102. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||