Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (13): 2099-2105.doi: 10.12307/2022.340
Previous Articles Next Articles
Potential new target effects between exosomes derived from mesenchymal stem cells and various hematological tumors
Li Lichun, Li Xiaofeng, Li Jianping
- Liaoning Blood Center (Shenyang Central Blood Station), Shenyang 110044, Liaoning Province, China
-
Received:2021-05-27Revised:2021-06-02Accepted:2021-06-16Online:2022-05-08Published:2021-12-20 -
Contact:Li Jianping, MD, Professor, Liaoning Blood Center (Shenyang Central Blood Station), Shenyang 110044, Liaoning Province, China Li Xiaofeng, Master, Professor, Liaoning Blood Center (Shenyang Central Blood Station), Shenyang 110044, Liaoning Province, China -
About author:Li Lichun, Master, Liaoning Blood Center (Shenyang Central Blood Station), Shenyang 110044, Liaoning Province, China -
Supported by:Natural Foundation Program of Liaoning Province, No. 2020-MS-354 (to LXF)
CLC Number:
Cite this article
Li Lichun, Li Xiaofeng, Li Jianping. Potential new target effects between exosomes derived from mesenchymal stem cells and various hematological tumors[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(13): 2099-2105.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
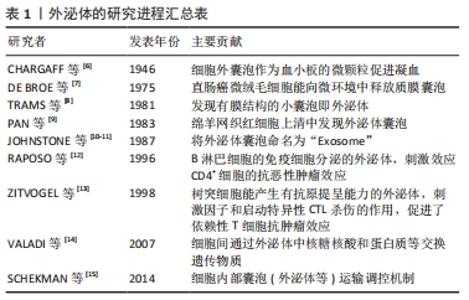
2.1 外泌体研究的发展历程 1946年,CHARGAFF等[6]研究发现,在健康人血浆中细胞外囊泡可以作为血小板的微颗粒促进凝血。1975年,DE BROE等[7]研究发现,直肠癌微绒毛细胞能向微环境中释放质膜囊泡。1981年,TRAMS等[8]在体外培养的绵羊红细胞上清液中发现了有膜结构的小囊泡即外泌体。1983年,PAN等[9]首次在培养绵羊网织红细胞上清中发现外泌体囊泡。1987年,科学家JOHNSTONE等[10]将外泌体囊泡命名为“Exosome”。外泌体是一种直径为30-150 nm的小囊泡,密度为1.10-1.21 g/mL[11]。1996年,RAPOSO等[12]发现了类似于B淋巴细胞的免疫细胞,可以分泌抗原呈递的外泌体,能够直接刺激效应CD4+细胞的抗恶性肿瘤效应。1998年,ZITVOGEL等[13]发现树突细胞也能产生有抗原提呈能力的外泌体,并且该外泌体含有功能性的MHC-Ⅰ类和Ⅱ类分子共刺激因子和启动特异性T淋巴细胞毒性杀伤的作用,促进了依赖性T细胞抗肿瘤效应。2007年,VALADI等[14]深入探索发现细胞间可以通过外泌体中核糖核酸和蛋白质等交换遗传物质。2013年,诺贝尔生理学或医学奖授予共同发现外泌体囊泡准确转运物质的调控机制的3位科学家(James E.Rothman,Randy W.Schekman,Thomas C.Südhof)以表彰他们发现细胞内部囊泡(外泌体等)运输调控机制,使外泌体的研究达到全新的高度[15]。就外泌体的研究方向而言,干细胞、免疫、microRNA、靶向给药及癌症的诊断治疗都是热门研究领域,见表1。"
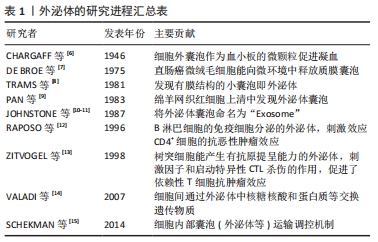
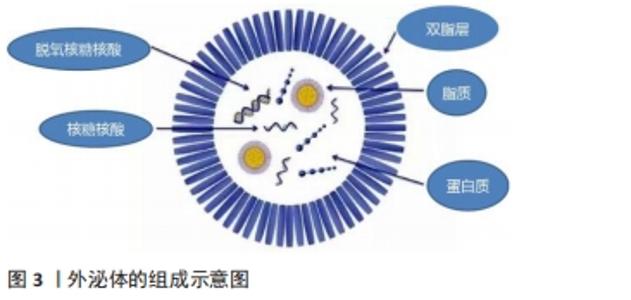
2.2 间充质干细胞来源外泌体的组成特性与作用机制 细胞通过内吞作用形成早期的核内体,直到管腔内囊泡生成后形成了晚期的核内体,即多囊泡体,而间充质干细胞来源外泌体起源于晚期内体膜的向内出芽,产生的小管腔内囊泡。当多囊泡体与质膜融合后,管腔内囊泡释放至细胞外,被称为外泌体[16]。间充质干细胞来源外泌体的生物合成和分泌可通过不同的机制引发,如神经酰胺依赖性途径和转运所需的内体分选复合物依赖性途径。通过细胞骨架蛋白、鸟苷三磷酸酶(guanosinetriphosphatase,GTPase)、突触小体相关蛋白(synaptosomal-associated protein,SNAP)等协同作用向质膜运输以及不同细胞间的转运。外泌体中存在多种蛋白质成分,比如参与信号转导的热休克蛋白家族(HSP60、HSP70和HSP90)、四次跨膜蛋白家族(CD9、CD63、CD81和CD82)、转化生长因子β(transforminggrowth factor-β,TGF-β)、干扰素γ(interferon-γ,IFN-γ)、调节相关免疫反应的凋亡蛋白因子配体(factorassociated suicide ligand,FasL)和细胞骨架蛋白(肌动蛋白、微管蛋白)以及肿瘤坏死因子α等[17]。外泌体亦含有多种核酸,包括DNA、mRNA、微小RNA(microRNA,miRNA)等,可携带一定量的遗传物质信息[18],见图3。"
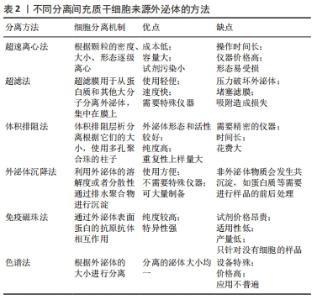
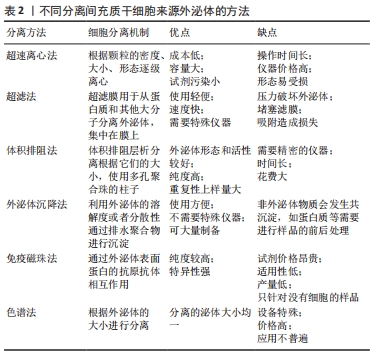
许多的证据表明,间充质干细胞来源外泌体参与了病毒复制和免疫应答,可以促进血液肿瘤转移和发生发展。因此,间充质干细胞来源外泌体成为临床血液肿瘤疾病诊疗的工具和生物标志。 2.3 间充质干细胞来源外泌体的作用特点和优势 间充质干细胞来源外泌体是运输药物和基因的载体,可携带许多分子进入受体细胞,如蛋白质、脂质和基因等,从而干扰了受体细胞的病理和生理过程。作为众多研究者公认的最理想的药物和基因运输的载体,间充质干细胞来源外泌体具有许多优势。①纳米级:直径40-100 nm,能自由穿透血管进入细胞外基质,可避免巨噬细胞的吞噬而发挥重要的作用。②稳定性好:具有双层脂质膜的保护,其内容物很难被各种酶降解,而且能够高效稳定地将装载物运输到目标组织中。③天然又无毒:相比其他运载体,具有免疫原性低,治疗性的物质不会在肝脏中累积,无严重的不良反应[19]。④穿透生物屏障的能力:可穿过多层结构进入血脑屏障,其机制大概与其在通过细胞间的多囊泡体进行传递有关[20]。⑤类似病毒侵入受体细胞的特效机制。⑥靶组织的归巢能力:该来源细胞与靶向性相关,因为其可以选择性地富集至来源细胞上构象相同的跨膜蛋白,可以结合归巢肽,故此具有归巢定向能力[21]。⑦存在多种装载方法:最常用的方法有利用化学转染、电穿孔、反复冻融或共孵育等方法直接把基因或药物转入间充质干细胞来源外泌体;还有对间充质干细胞来源外泌体来源的细胞共孵育或进行化学转染,使相关来源细胞分泌出有装载物的外泌体。⑧外泌体是细胞分泌的小生物膜囊泡,与间充质干细胞相比较,其所分泌的外泌体复杂性低、体积小,易于存储和生产,可以避免间充质干细胞的监管问题。⑨间充质干细胞来源外泌体富含生物活性分子,如蛋白质和核糖核酸。存在于外泌体中的许多蛋白质都是酶类,具有催化活性,这些活性与所处的环境有关,如pH值和底物浓度。⑩间充质干细胞来源外泌体对外界环境刺激的反应以及对维持细胞内稳态起到了重要的作用。当组织微环境稳态因损伤或疾病而遭到破坏时,该作用就显得尤为重要。外泌体作为理想的传送载体,将生物活性分子包裹在膜内,故而保护核糖核酸或者酶免于降解,通过细胞的内吞作用摄取在细胞内。 间充质干细胞来源外泌体还存在以下几个特点:①外泌体可以存放在-20 ℃的环境下长期保存,外泌体内的物质很难被降解;②外泌体安全性高,不存在移植细胞停留在体内的问题,不会产生免疫排斥反应;③外泌体能够直接到达受损部位,不会巢居在肺部的问题;④外泌体的生产成本可以控制,通过超速离心大批量的生产,不会像细胞那样对运输保存条件的苛刻[22]。 2.4 间充质干细胞来源外泌体的分离及鉴定 2.4.1 间充质干细胞来源外泌体的分离 目前已经发现多种外泌体提取方法,包括超速离心法、超滤法、体积排阻法、外泌体沉降法、免疫磁珠法及色谱法,目前多采用差速离心法[23],即低速离心去除死细胞及大的细胞碎片;高速离心去除小的细胞碎片及大囊泡等;最后超速离心得到外泌体。首先常规培养间充质干细胞,当细胞融合度达到70%时,更换培养基连续进行10-12 h后,收集新鲜的第3-5代间充质干细胞的上清液100 mL, 分装于超速离心管中进行分离纯化。超速离心法的具体步骤如下:离心10 min(4 ℃2 000×g)去除死细胞碎片,离心后取上清液;转移上清液到离心管中,离心30 min(1 000×g,4 ℃)去除大膜泡,然后用0.22 μm 滤器过滤上清液,转移滤液到离心管中;离心30 min(100 000×g,4 ℃),弃去上清液,收集底部重悬的沉淀;取上一步的重悬液在离心2 h(100 000×g,4 ℃),弃去上清液,最后收集PBS重悬液中的沉淀,-80 ℃冻存备用,见表2。"

2.4.2 间充质干细胞来源外泌体的鉴定 对间充质干细胞来源外泌体的功能研究进行鉴定,目前包括电镜法、NTA粒径法、Western Bolt法及核酸分析法等来鉴定外泌体的结构、特异性蛋白及核酸序列等。 形态分析——电镜观察法:取20 μL分离提取的间充质干细胞来源外泌体,重悬于塑料薄膜上,将铜网倒扣在液滴表面室温下静置10 min后,用滤纸吸去多余的液体,用体积分数1%戊二醛液负染5 min,并用双蒸馏水液滴洗涤铜网3次,3 min/次,室温晾干,用透射电镜观察并照相。 蛋白分析——Western Blot检测法:取适量的间充质干细胞来源外泌体,加入等体积的RIPA细胞裂解液(含体积分数1%PMSF),在冰上裂解30 min后,离心5 min (12 000 r/min),取上清液加入适量4×蛋白上样缓冲液,煮沸10 min;取处理后20 μg 间充质干细胞来源外泌体样本于12%的SDS-PAGE凝胶上电泳,之后转移蛋白到PVDF膜上,并恒流(200 mA)转膜80 min后,用体积分数5%脱脂奶粉封闭PVDF膜2 h,再按1∶1 000比例加入一抗(Tsg101、CD63、CD81),4 ℃摇床过夜。次日洗膜后加入二抗,孵育1 h,洗膜4次(10 min/次),显影观察结果。 结构分析——纳米颗粒跟踪分析(Nanoparticle Tracking Analysis):简称NTA,纳米颗粒跟踪分析技术是表征外泌体的浓度粒径测试手段之一,对不同大小的外泌体颗粒追踪和分析,可计算出外泌体的直径和浓度。相较于其他表征方式,纳米颗粒跟踪分析技术的样本处理更简单、更能保证外泌体原始状态、检测速度更快。纳米颗粒跟踪分析能够对低浓度的外泌体进行大小和浓度测定,并且在与荧光标记联合使用时,可以选择性地确定和分析复杂样品中特定类型的颗粒。 核酸鉴定——qPCR法/NGS测序:外泌体中含有大量的核糖核酸和脱氧核糖核酸,包括功能性的 mRNAs、miRNAs、lncRNA和mtDNA等,这些核糖核酸分子以外泌体为载体进入靶细胞后,会通过不同的机制对靶细胞产生影响。可通过实时荧光定量PCR法、高通量测序技术分析外泌体核糖核酸分子差异,是对外泌体核糖核酸功能研究的有效手段。 2.5 间充质干细胞来源外泌体在血液肿瘤系统方面的研究进展 "

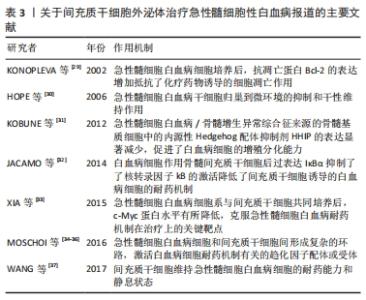
白血病是一类造血干细胞的克隆性恶性疾病,由于细胞内脱氧核糖核酸的变异造成骨髓中造血组织的不正常工作,过分生产不成熟的白细胞,从而妨碍了骨髓的其他工作,使得骨髓生产其他血细胞的功能降低。因此白血病越早发现、越早诊断和治疗对指导临床用药和预后的判断都具有尤为重要的临床意义。 2.5.1 急性髓细胞白血病 也叫急性骨髓性白血病,是一种骨髓性白细胞(而非淋巴性白细胞)异常增殖的血癌,如果不采取有效的治疗措施将会很快进入骨髓的衰竭期[24]。有研究证实间充质干细胞通过产生可溶性因子,如趋化分子、细胞因子和生长因子等促进急性髓细胞白血病的病情发展[25];同时证明了外泌体在间充质干细胞和白血病细胞之间发挥了极其重要的作用[26-28]。间充质干细胞对白血病细胞的作用主要是抑制白血病细胞的凋亡,可促进干性维持和化疗药物的抵抗作用。2002年,KONOPLEVA等[29]在相关的研究中发现急性髓细胞白血病原代细胞或白血病细胞系与小鼠间充质干细胞系MS-5之间直接接触经过传代培养后,抗凋亡蛋白Bcl-2的表达增加,同时可以抵抗化疗药物诱导的细胞凋亡作用。2006年,HOPE等[30]研究中发现应用CD44拮抗剂可以强烈地抑制人白血病干细胞在体内生长,可能机制是急性髓细胞白血病干细胞归巢到微环境的抑制和干性维持有关。导致Hedgehog信号通路在调节干/祖细胞扩增和淋巴细胞分化中发挥了重要作用。2012年,KOBUNE等[31]发现急性髓细胞白血病/骨髓增生异常综合征来源的骨髓基质细胞中的内源性Hedgehog配体抑制剂Hedgehog相互作用蛋白(Hedgehog interacting protein,HHIP)的表达显著减少,而HHIP的低表达率促进白血病细胞的增殖分化能力。2014年,JACAMO等[32]发现了白血病细胞作用骨髓间充质干细胞后的全基因组表达谱,使其血管内皮细胞黏附分子1/迟现抗原4(VCAM-1/VLA-4)和核转录因子kB传导通路相关的基因表达呈上调趋势,并且在体内外实验中通过化学药物或过表达IκBα抑制核转录因子kB的激活从而降低了间充质干细胞诱导的白血病细胞的耐药机制。2015年,XIA等[33]将急性髓细胞白血病原代培养的细胞以及其细胞系与间充质干细胞共同培养后,发现急性髓细胞白血病原代培养的细胞中c-Myc蛋白水平明显升高,而急性髓细胞白血病细胞系与间充质干细胞共同培养后,c-Myc蛋白水平有所降低,可以促进化疗药物诱导的细胞凋亡,揭示了c-Myc是克服急性髓细胞白血病耐药机制在治疗上的关键靶点。2016年,有研究发现间充质干细胞可通过物理方法转移线粒体影响了白血病细胞的分泌,使其对化疗具有极强的抵抗力[34]。2016年,CARTER等[35-36]强调了抗凋亡蛋白ARC的重要性,通过ARC诱导了急性髓细胞白血病细胞中白细胞介素1β的过表达,使得核转录因子kB/白细胞介素1β信号通路在急性髓细胞白血病细胞和间充质干细胞间形成复杂的环路,从而激活大多数与白血病细胞耐药机制密切相关的趋化因子配体或受体。2017年,WANG等[37]通过急性髓细胞白血病原代细胞与间充质干细胞共培养孵育,发现了骨髓间充质干细胞有利于维持急性髓细胞白血病细胞的耐药能力和静息状态。因此,关于间充质干细胞外泌体在急性髓细胞白血病中的研究近几年颇多,研究表明间充质干细胞来源外泌体在急性髓细胞性白血病中的抗化疗药物的耐药机制和促进肿瘤细胞凋亡等方面发挥了重要的作用,见表3,该外泌体将成为众多关于急性髓细胞性白血病研究中的热点标志。"

2.5.2 急性淋巴细胞白血病 由于未分化或分化很差的淋巴细胞在造血组织(特别是骨髓、脾脏和淋巴结)无限增殖所致的一种恶性血液病,是小儿时期最常见的疾病类型。随着新的抗白血病药物的不断出现,新的化疗方案和治疗方法在不断改进,急性淋巴细胞白血病的预后明显有所改善,现代的治疗已不是单纯获得缓解治疗,而是争取长期存活率,最终达到能够治愈。2015年,CAIVANO等[38]通过急性淋巴细胞白血病分泌的外泌体包含的肌动蛋白等囊泡分支结构,建立了一种对患者血液中的急性淋巴细胞白血病分泌的外泌体小囊泡进行跟踪的实验技术,从此为急性淋巴细胞白血病的诊断和治疗提供了启示。 2.5.3 慢性粒细胞白血病 是一类发生于造血干细胞的获得性血液恶性肿瘤,其病因是融合基因BCR-ABL编码的融合蛋白具有强烈酪氨酸激酶活性,会引发造血细胞的恶性转化BCR-ABL融合基因编码具有强烈酪氨酸激酶活性的融合蛋白P210,其在体内参与调节许多重要的分子信号传导途径,会导致细胞增殖失控、凋亡受到抑制和黏附功能等出现异常[39]。来源于慢性粒细胞白血病患者的间充质干细胞不管是在形态特征、生长特性、免疫表型还是细胞分化、分泌细胞因子和支持造血功能等方面均不存在明显异常,且未在慢性粒细胞白血病患者的间充质干细胞内发现Ph染色体和BCR-ABL融合基因,总之它们基本是正常的细胞群体[40-42]。2019年,陈莹[43]发现通过多种机制骨髓间充质干细胞与白血病细胞之间的相互作用促进慢性粒细胞白血病的复发与耐药,间充质干细胞靶向重构的白血病为骨髓微环境治疗慢性粒细胞白血病开辟了新的方向。总之,间充质干细胞来源外泌体在慢性粒细胞白血病方面近几年来相关研究甚少,大部分都是关于白血病的耐药机制和复发的研究,这就为科研工作者们关于慢性粒细胞白血病与间充质干细胞来源外泌体之间的作用机制和药代动力学等方面的研究提供了新的方向和动力。 2.5.4 慢性淋巴细胞性白血病 是由于单克隆性小淋巴细胞扩增,蓄积浸润骨髓、血液、淋巴结和其他器官,最终导致骨髓功能衰竭。通过外泌体在慢性淋巴细胞性白血病与骨髓微环境之间相互作用关系的研究发现,一方面骨髓微环境中间充质干细胞来源外泌体能够增强慢性淋巴细胞性白血病中B细胞的化疗耐药性和迁徙能力,有助于慢性淋巴细胞性白血病中白血病细胞药物诱导凋亡或逃离自发;另一方面通过慢性淋巴细胞性白血病的外泌体调节AKT信号转导通路,诱导血管内皮生长因子等慢性淋巴细胞性白血病促进因子的高表达,从而进行肿瘤和骨髓微环境的调节。 2002年,KONOPLEVA等[29]通过将HL-60细胞与MS-5细胞系共培养发现,小鼠骨髓间充质干细胞MS-5能够上调HL-60细胞中抗凋亡蛋白BCL-XL和BCL-2的表达,进而抑制了AraC诱导的HL-60细胞的凋亡。2003年,PARAGUASSFI-BRAGA等[44]发现骨髓间充质干细胞能够分泌细胞因子如血管细胞黏附因子1,介导白血病细胞与骨髓间充质干细胞之间的相互接触和黏附,骨髓间充质干细胞可以通过这种细胞与细胞之间的直接接触以及黏附作用而调控白血病细胞的增殖和分化,使白血病细胞克隆可以无限增殖,而分化过程受阻,从而参与慢性淋巴细胞性白血病的发生。2006年,付相建等[45]研究发现了白血病来源的骨髓间充质干细胞能够保护白血病细胞,骨髓造血微环境中间充质干细胞的异常可能会导致造血细胞克隆增殖分化和恶性选择,从而导致慢性淋巴细胞性白血病的发生。2007年,有研究发现骨髓间充质干细胞通过调节Akt信号途径从而维持白血病细胞的存活[46]。2008年,JIN等[47]对于慢性淋巴细胞性白血病的研究结果表明间充质干细胞能增强CXCR-4介导的白血病细胞向骨髓间充质的转移,减少白血病细胞的凋亡,使白血病细胞的细胞周期停滞在G0-G1期,从而对白血病细胞产生了保护作用。2015年,PAGGETTI等[48]将慢性淋巴细胞性白血病细胞分泌的外泌体作用于间充质干细胞,靶细胞接收了功能活跃的蛋白质及核糖核酸后,转录功能发生改变,并且增殖、迁移、分泌炎性细胞因子的能力有所增强,从而促进慢性淋巴细胞性白血病的发展。2017年,CROMPOT等[49]将慢性淋巴细胞性白血病细胞与骨髓间充质干细胞来源的外泌体在体外共培养作用24 h后,慢性淋巴细胞性白血病细胞自发性凋亡减少,而对多种药物的抵抗能力增强。2018年,MA[50]发现虽然人脐血间充质干细胞来源的外泌体对K562细胞系的增殖与凋亡无明显影响,但是能增强对伊马替尼的敏感性,增强其凋亡信号通路的活性,从而增强其对慢性淋巴细胞性白血病治疗的反应性。 综上,慢性淋巴细胞白血病与间充质干细胞外泌体之间共培养后,促进了白血病的发展,增强了患者的抵抗能力和反应性,为慢性淋巴细胞白血病诊断与预后提供了生物学标志和靶向治疗开辟了新的道路。 2.5.5 血液系统其他恶性肿瘤 多发性骨髓瘤是浆细胞异常增生的恶性肿瘤。患者间充质干细胞来源外泌体miRNA对患者诊断和预后判断具有指导意义。2013年,ROCCARO等[51]运用蛋白质组学和microRNA芯片对多发性骨髓瘤患者间充质干细胞来源外泌体的组成进行分析发现白细胞介素6,纤连蛋白和CCL2明显上调,而miR-15a与健康人相比明显下调,因此它们可以作为多发性骨髓瘤的诊断生物标志。2017年,UMEZU等[52]发现年轻人骨髓间充质干细胞分泌的外泌体中miR-340可以补充老年人骨髓间充质干细胞外泌体中miR-340,从而可以抑制多发性骨髓瘤患者的血管生成。骨髓增生异常综合征是一种造血干细胞恶性克隆性疾病。骨髓增生异常综合征患者分泌的外泌体可以通过mRNA、miRNA和蛋白质等介导肿瘤细胞与骨髓间充质细胞间的信息传递[53]。总结上述研究发现,间充质干细胞来源外泌体与这2种血液恶性肿瘤有着不可分割的关系,都是通过蛋白组学和构成机制等相关技术,阐述了血液恶性肿瘤细胞与间充质干细胞间的信息传递,对患者的诊治与预后判断提供了指导性的临床意义。 间充质干细胞来源外泌体作为基质细胞的前体细胞分泌的纳米级的小囊泡,富含100多种胞外基质蛋白、mRNA信使核糖核酸和在血液中分泌的细胞因子,参与构建间充质干细胞来源外泌体和骨髓造血微环境的重要组成部分,间充质干细胞来源外泌体在调节定植于造血干细胞的生理活性中发挥了重要作用,从而促进造血功能的重建,为临床血液恶性肿瘤患者的治疗提供了参考依据。总之,间充质干细胞来源外泌体通过将细胞分子信息从原发性肿瘤携带到远处靶组织细胞为主的循环转移而形成前生态位,进而诱导靶组织细胞生理变化而促进肿瘤细胞的侵袭和增殖,也是介导局部和远端微环境中血液肿瘤细胞和间充质干细胞间通讯的关键介质,在血液肿瘤患者的血液中,该外泌体含量显著增加且与肿瘤的侵袭性相关,为血液肿瘤疾病诊断和病情预后评价提供了可靠的依据。"

| [1] GONG C, ZHANG X, SHI M, et al. Tumor exosomes reprogrammed by low pH are efficient targeting vehicles for smart drug deliveryand personalized therapy against their homologous tumor. Adv Sci. 2021. doi:10.1002/advs.202002787. [2] 杨紫恩,赵继凯,于卉影.间充质干细胞来源外泌体生物学功能及对肿瘤调控作用研究现状[J].临床军医杂志,2020,48(11):1386-1388. [3] WHITESIDE TL. Exosome and mesenchymal stem cell cross-talk in the tumor microenvironment. Semin Immunol. 2018;35:69-79. [4] LAZENNEC G, LAM PY. Recent discoveries concerning the tumor-mesenchymal stem cell interactions. Biochim Biophys Acta. 2016; 1866(2):290-299. [5] 纪成,费书琴,陈鸣,等.间充质干细胞来源外泌体在肾脏疾病中的研究进展[J].第二军医大学报,2018,39(7):722-725. [6] CHARGAFF E, WEST R. The biological signifi cance of the thromboplastic protein of blood. J Biol Chem. 1946;166(1):189-197. [7] DE BROE M, WIEME R, ROELS F. Leteer: Mem brane fragments with koinozymic properties released from villous adenoma of the rectum. Lancet. 1975;2(7946):1214-1215. [8] TRAMS EG, LAUTER CJ, SALEM N JR, et al. Exfoliation of membrane ecto-enzymes in the form of micro-vesicles. Biochim Biophys Acta. 1981;645:63-70. [9] PAN BT, JOHNSTONE RM. Fate ofthe transferrin receptor during maturation of sheep reticuIocytes in vitro:selective externalization of the receptor. Cell. 1983;33(31):967-978. [10] JOHNSTONE RM, ADAM M, HAMMONDJ R, et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J Biol Chem. 1987;262: 9412-9420. [11] MATHIVANAN S, FAHNER CJ, REIDG E, et al. ExoCarta 2012:database of exosomal proteins, RNA and lipids. Nucleic Acids Res. 2012;40(Database issue):D1241-1244. [12] RAPOSO G, NIJMAN HW, STOORVOGEL W, et al. B lymphocytes secrete anti-gen-presenting vesicles. J Exp Med. 1996;183(3):1161. [13] ZITVOGEL L, REGNAULT A, LOZIER A, et al. Eradication of estab lished murine tumors using a novel cell-free vaccine: dendritic cell-derived exosomes. Nat Med. 1998;4(5):594-600. [14] VALADI H, EKSTRÖM K, BOSSIOS A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 2007;9(6):654-659. [15] SCHEKMAN R, SÜDHOF T. An interview with Randy Schekman and Thomas Südhof. Trends Cell Biol. 2014;24(1):6-8. [16] AlENQUER M, AMORIM MJ. Exosome biogenesis, regulation, and function in viral infection. Viruses. 2015;7(9):5066-5083. [17] VANNIEL G, D’ANGELO G, RAPOSO G. Shedding light on the cell biology of extracellular vesicles. Nat Rev Mol Cell Biol. 2018;19(4):213-228. [18] SADRI NAHAND J, BOKHARAEI-SALIM F, KARIMZADEH M, et al. MicroRNAs and exosomes: key players in HIV pathogenesis. HIV Med. 2020;21(4):246-278. [19] LI X, LI Z. Effects of human umbilical cord mesenchymal stem cells on co-cultured ovarian carcinoma cells. Microsc Res Tech. 2019;82(6):898-902. [20] EL ANDALOUSSI S, LAKHAL S, MÄGER I, et al. Exosomes for targeted siRNA delivery across biological barriers. Adv Drug Deliv Rev. 2013;65(3):391-397. [21] COOPER JM, WIKLANDER PO, NORDIN JZ, et al. Systemic exosomalsiRNA delivery reducedalpha-synuclein aggregates in brains of transgenic mice. Mov Disord. 2014;29(12):1476-1485. [22] 严冰浩.人间充质干细胞的增殖调控机制及体外扩增技术的优化策略研究[D].上海:第二军医大学,2016:1-71. [23] KANG L, WONG DK, HONG KY, et al. Cushioned–density gradient ultracentrifugation (c-dguc): a refined and high performance method for the isolation, characterization, and use of exosomes. Methods MolBiol. 2018;1740:69-83. [24] MORRISON SJ, SCADDEN DT. The bone marrow niche for haematopoietic stem cells. Nature. 2014;505:327-334. [25] DORON B, HANDU M, KURRE P. Concise review: adaptation of the bone marrow stroma in hematopoietic malignancies: current concepts and models. Stem Cells. 2018;36(3):304-312. [26] WHITES TL. Exosome and mesenchymal stem cell cross-talk in the tumor microenvironment. Semin Immunol. 2018;35:69-79. [27] CORRADO C, RAIMONDO S, SAIEVA L, et al. Exosome-mediated crosstalk between chronic myelogenous leukemia cells and human bone marrow stromal cells triggers an Interleukin 8-dependent survival of leukemia cells. Cancer Lett. 2014;348(1):71-76. [28] SHOJAEI S, HASHEMI SM, GHANBARIAN H, et al. Effect of mesenchymal stem cells-derived exosomes on tumor microenvironment: tumor progression versus tumor suppression. J Cell Physiol. 2019;234(4):3394-3409. [29] KONOPLEVA M, KONOPLEV S, HU W, et al. Stromal cells prevent apoptosis of AML cells by upregulation of anti-apoptotic proteins. Leukemia. 2002;16(9):1713-1724. [30] HOPE KJ, JIN L, SMADJA-JOFFE F, et al. Targeting of CD44 eradicates human acute myeloid leukemic stem cells. Nat Med. 2006;12(10):1167-1174. [31] KOBUNE M, IYAMA S, KIKUCHI S, et al. Stromal cells expressing hedgehog-interacting protein regulate the proliferation of myeloidneoplasms. Blood Cancer J. 2012;2(9):e87. [32] JACAMO R, CHEN Y, WANG Z, et al. Reciprocal leukemia-stroma VCAM-1/VLA-4-dependent activation of NF-kappaB mediates chemoresistance. Blood. 2014;123(17):2691-2702. [33] XIA B, TIAN C, GUO S, et al. c-Myc plays part in drug resistance mediated by bone marrow stromal cells in acute myeloid leukemia. Leuk Res. 2015;39(1):92-99. [34] MOSCHOI R, IMBERT V, NEBOUT M, et al. Protective mitochondrial transfer from bone marrow stromal cells to acute myeloid leukemic cells during chemotherapy. Blood. 2016;128(2):253-264. [35] CARTER BZ, MAKP Y, CHEN Y, et al. Anti-apoptotic ARC protein confers chemoresistance by controllingleukemia-microenvironment interactions through a NFkappaB/IL1beta signaling network. Oncotarget. 2016;7(15):20054-20067. [36] LEE M W, RYU S, KIM DS, et al. Mesenchymal stem cells in suppression or progression of hema-tologic malignancy: current status and challenges. Leukemia. 2019;33(3):597-611. [37] WANG W, BOCHTLER T, WUCHTER P, et al. Mesenchymal stromal cells contribute to quiescence of therapy‐resistant leukemic cells in acute myeloid leukemia. Eur J Haematol. 2017;99(5):392-398. [38] CAIVANO A, DEL VECCHIO L, MUSTO P. Do we need to distinguish exosomes from microvesicles in hematological malignancies? Leukemia. 2017;31(9):2009-2010. [39] THOMPSON PA, KANTARJIAN HM, CORTES JE. Diagnosis and treatment of chronic myeloid leukemia in 2015. Mayo Clin Proc. 2015;90:1440-1454. [40] WOHRER S, RABITSCH W, SHEHATA M, et al. Mesenchymal stem cells in patients with chronic myelogenousleukaemia or bi-phenotypic Ph+ acute leukaemia are not related to the leukaemic clone. Anticancer Res. 2007;27:3837-3841. [41] JOOTAR S, PORNPRASERTSUD N, PETVISES S, et al. Bone marrow derived mesenchymal stem cells from chronic myeloid leukemia t(9;22) patients are devoid of Philadelphia chromosome and support cord blood stem cell expansion. Leuk Res. 2006;30:1493-1498. [42] ZHAO Z, TANG X, YOU Y, et al. Assessment of bone marrow mesenchymal stem cell biological characteristics and support hemotopoiesis function in patients with chronic myeloid leukemia. Leuk Res. 2006;30:993-1003. [43] 陈莹.抑制RAB27B重启急性髓系白血病干细胞衰老并阻止其诱导骨髓间充质细胞衰老的研究[D].武汉:华中科技大学,2019. [44] PARAGUASSFI-BRAGA FH, BOROJEVIC R, BOUZAS LF, et a1. Bone marrow stroma inhibits proliferation and apoptosis in leukemic cells through gap junction-mediated cell communication. Cell Death Differ. 2003;10(9): 1101-1108. [45] 付相建,陈幸华.急性白血病骨髓基质细胞体外培养的生长特性及细胞外基质的检测[J].西南军医,2006,8(1):28-30. [46] WANG L, FORTNEY JE, GIBSON LE. Stromal cell protection of B-lineage acute lymphoblastic leukemic cells during chemotherapy requires active Akt. Leuk Res. 2004;28(7):733-742. [47] JIN L, TABE Y, KONOPLEV S, et a1. CXCR4 up-regulation by imatinib induces chronic myelogenous leukemia(CML)cell migration to bone marrow stroma and promotes survival ofquiescent CML cells. Mol Cancer Ther. 2008;7(1): 48-58. [48] PAGGETTI J, HADERK F, SEIFFERT M, et al. Exosomes released bychronic lymphocytic leukemia cells induce the transition ofstromal cells into cancer-associated fibroblasts. Blood. 2015;126(9):1106-1117. [49] CROMPOT E, VAN DAMME M, PIETERS K, et al. Extracellular vesicles of bone marrow stromal cells rescue chronic lymphocytic leukemia B cells from apoptosis, enhance their migration and induce gene expression modifications. Haematologica. 2017;102(9):1594-1604. [50] MA F. Exosomes from mesenchymal stromal cells enhance imatinib-induced apoptosis in human leukemia cells via activation of caspase signaling pathway. Cytotherapy. 2018;20(2):181-188. [51] ROCCARO AM , SACCO A, MAISO P, et al. BM mesenchymal stromal cell-derived exosomes facilitate multiple myeloma progression. J Clin Invest. 2013;123(4):1542-1555. [52] UMEZUT, IMANISHI S, AZUMA K, et al. Replenishing exosomesfrom older bone marrow stromal cells with miR-340 inhibits myeloma-related angiogenesis. Blood Adv. 2017;1(13):812-823. [53] BATTH IS, MITRA A, MANIER S, et al. Circulating tumor markers: harmonizing the yin and yang of CTCs and ctDNA for precision medicine. Ann Oncol. 2017;1;28(3):468-477. [54] 程琳,许天敏.间充质干细胞源性外泌体及其在肿瘤治疗中的研究进展[J].现代肿瘤医学,2016,24(15):2470-2473. [55] 李嘉,王智慧,吴迪,等.间充质干细胞源性外泌体在骨科疾病治疗中的作用与应用前景[J].中国组织工程研究,2020,24(25):4068-4072. [56] EDWIN J, BUNGGULAWA, WANG W, et al. Recent advancements in the use of exosomes as drug deIivery systems. J Nanobiotechnol. 2018;16(1):81. [57] 缪着,卢福琼,马波,等.人间充质干细胞外泌体研究进展[J].中国医药生物技术,2019,14(4):361-365. [58] BELUN G, GARDlN C, FERRONl L, et al. Exosome in cardiovascular diseases: a complex world full of hope. Cells. 2019;8(2):166. [59] MA CH, WU CH, JOU IM, et al. PKR promotes oxidative stress and apoptosis of human articular chondrocytes by causing mitochondrial dysfunction through p38, ARK activation-PLR activation causes apoptosis in human chondrocytes. Antioxidants (Basel). 2019;8(9):2201-2209. |
| [1] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [2] | Jin Tao, Liu Lin, Zhu Xiaoyan, Shi Yucong, Niu Jianxiong, Zhang Tongtong, Wu Shujin, Yang Qingshan. Osteoarthritis and mitochondrial abnormalities [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1452-1458. |
| [3] | Zhang Lichuang, Xu Hao, Ma Yinghui, Xiong Mengting, Han Haihui, Bao Jiamin, Zhai Weitao, Liang Qianqian. Mechanism and prospects of regulating lymphatic reflux function in the treatment of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1459-1466. |
| [4] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1260-1265. |
| [5] | Xiao Hao, Liu Jing, Zhou Jun. Research progress of pulsed electromagnetic field in the treatment of postmenopausal osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1266-1271. |
| [6] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1272-1277. |
| [7] | Tian Chuan, Zhu Xiangqing, Yang Zailing, Yan Donghai, Li Ye, Wang Yanying, Yang Yukun, He Jie, Lü Guanke, Cai Xuemin, Shu Liping, He Zhixu, Pan Xinghua. Bone marrow mesenchymal stem cells regulate ovarian aging in macaques [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 985-991. |
| [8] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1102-1106. |
| [9] | Zhou Hongqin, Wu Dandan, Yang Kun, Liu Qi. Exosomes that deliver specific miRNAs can regulate osteogenesis and promote angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1107-1112. |
| [10] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [11] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1119-1124. |
| [12] | Hui Xiaoshan, Bai Jing, Zhou Siyuan, Wang Jie, Zhang Jinsheng, He Qingyong, Meng Peipei. Theoretical mechanism of traditional Chinese medicine theory on stem cell induced differentiation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1125-1129. |
| [13] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [14] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1137-1142. |
| [15] | Wang Xinmin, Liu Fei, Xu Jie, Bai Yuxi, Lü Jian. Core decompression combined with dental pulp stem cells in the treatment of steroid-associated femoral head necrosis in rabbits [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1074-1079. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||