Chinese Journal of Tissue Engineering Research ›› 2016, Vol. 20 ›› Issue (25): 3785-3792.doi: 10.3969/j.issn.2095-4344.2016.25.021
Previous Articles Next Articles
Osteoinduction of calcium phosphate and its application
Chen Hao-dong1, Yao Jin-feng2, Liang Zhi-gang2
- 1Guangzhou Medical University, Guangzhou 510000, Guangdong Province, China; 2the Second Hospital of Shenzhen, Shenzhen 518000, Guangdong Province, China
-
Received:2016-03-24Online:2016-06-17Published:2016-06-17 -
Contact:Liang Zhi-gang, the Second Hospital of Shenzhen, Shenzhen 518000, Guangdong Province, China -
About author:Chen Hao-dong, Studying for master’s degree, Guangzhou Medical University, Guangzhou 510000, Guangdong Province, China
CLC Number:
Cite this article
Chen Hao-dong, Yao Jin-feng, Liang Zhi-gang. Osteoinduction of calcium phosphate and its application[J]. Chinese Journal of Tissue Engineering Research, 2016, 20(25): 3785-3792.
share this article
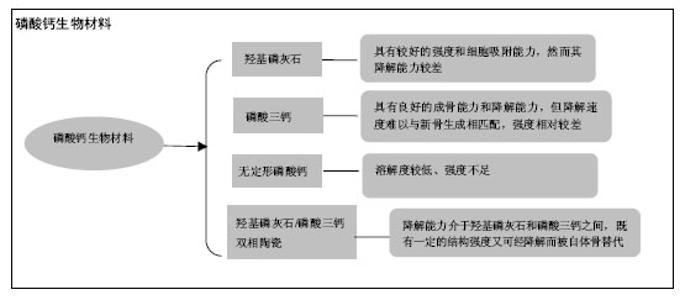
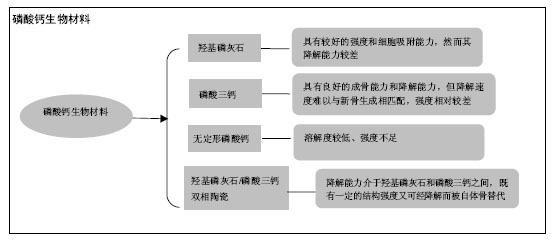
2.1 磷酸钙陶瓷材料的理化性质 羟基磷灰石:羟基磷灰石的分子式为(Ca5(PO4)3) OH,钙磷比为1.67。因其成分与骨相似,曾被广泛应用于骨缺损的修复上[14]。在pH值为3.5-9.7的环境中,羟基磷灰石的溶度积Ksp约为2.9×10-58[15]。 磷酸三钙:磷酸三钙的分子式为Ca3(PO4)2,钙磷比为1.5。磷酸三钙不是机体骨组织成分,其化学组成与羟基磷灰石相似,但晶体结构与羟基磷灰石不同。根据烧结温度可将磷酸三钙分为α-磷酸三钙和β-磷酸三钙两相,当烧结温度高于1 120-1 180 ℃为α-磷酸三钙,低于1 120-1 180 ℃则为β-磷酸三钙[16]。在25 ℃的液体环境中,α-磷酸三钙的Ksp约为10-25.5,β-磷酸三钙的Ksp约为10-28.9[17]。 无定形磷酸钙:无定形磷酸钙是一种原子排列无序的磷酸钙陶瓷,可从钙及磷酸根离子溶液中沉淀析出得到,因此它们往往含有多种杂质而有着较高的溶解度[18]。其钙磷比往往介于1.15-1.67之间。无定形磷酸钙被报道在溶液中的Ksp在10-25-10-23之间[19]。 羟基磷灰石/磷酸三钙双向陶瓷:羟基磷灰石/磷酸三钙双向陶瓷是采用羟基磷灰石和β-磷酸三钙按一定钙磷比制备而成的双向磷酸钙陶瓷[20],钙磷比在1.5-1.67之间。它的Ksp介于羟基磷灰石和β-磷酸三钙之间,通过调节两者比例来改变降解速度[21],可使其与新骨的生长速率相匹配。 2.2 磷酸钙材料固有骨诱导性的发现历程 1911年,Wells最早发现钙盐对成骨有促进作用。1965年在Urist的文章中骨诱现象被正式提出[22]。Urist 发现将脱钙皮质骨置入动物肌肉中可诱发异位成骨。随后他又成功从皮质骨成功提取出一种具有诱导非骨区域细胞分化成骨的蛋白质,即为骨形态发生蛋白[23]。至今已有大量研究进一步证实骨形态发生蛋白具骨诱导能力,可诱导异位成骨,甚至已被部分应用于临床上骨缺损修复。 早期的研究认为,单纯磷酸钙材料仅具有骨传导性,而不具备诱导间充质细胞向成骨细胞分化的能力(即骨诱导性)[24]。然而从发现骨形态发生蛋白骨诱导能力以来,不断有研究报道发现未添加生长因子的磷酸钙材料也具有异位成骨的能力:Yamasaki等[25]将多孔羟基磷灰石置入犬皮下,发现有异位骨形成;Ripamoti等[26]发现置入狒狒肌肉的多孔羟基磷灰石有新骨形成。因此有研究者提出一种理论,即通过优化人工材料的理化性能,使其可产生“固有骨诱导性”或“材料依赖性骨诱导”[27]。随着研究的深入,发现磷酸钙陶瓷材料的固有骨诱导性受材料组成成分、孔隙结构等影响[28]。Gerber等[29]也发现基于β-磷酸三钙和羟基磷灰石的多孔材料在猪体内不仅有骨引导作用,还具有刺激骨生成的作用。Yuan等[30]研究发现相对于羟基磷灰石/磷酸三钙双向陶瓷和羟基磷灰石,能磷酸三钙材料够诱导骨髓间充质干细胞表达更多的骨钙素和骨唾液蛋白mRNA。在2000年美国第六届世界生物陶瓷大会上,磷酸钙陶瓷固有骨诱导性理论在国际上已逐步得到认同。 2.3 磷酸钙材料骨诱导过程和机制 Urist提出发生骨诱导的3个条件:存在具备分化成骨能力的前体细胞;存在激活前体细胞分化成骨的生物因子;存在适合的成骨环境。Bao等[31]在多次实验中发现,材料置入区首先形成血凝块,然后形成血管及肉芽组织,接着多形性细胞聚集、成骨细胞分化和成骨。他提出了磷酸钙材料固有骨诱导性可能的发生机制:置入区材料对生长因子的吸附、材料降解提供的大量钙磷离子和材料与体液的各种化学反应,共同形成一个特殊的“生物修饰表面”及微环境,诱使间充质干细胞趋化、迁移并分化成骨母细胞。骨母细胞通过自分泌进一步提高如骨形态发生蛋白等生长因子的浓度,最终分化、增殖并成熟成骨。近年来,对材料固有骨诱导性机制的研究也越来越多。Danoux等[32]研究发现,材料分解产生的钙离子可显著增加人类间充质干细胞产生碱性磷酸酶,并对成骨标志蛋白的表达有积极作用。Davison等[33]将2组具有骨诱导性的材料、1组无骨诱导性的材料分别置入小鼠皮下,其中1组置入具骨诱导性材料的小鼠,通过脂质体氯膦酸盐抑制其破骨细胞。12周后发现抑制组和无骨诱导性组小鼠内无成骨现象,而骨诱导性无抑制组有新骨形成,证明破骨细胞在新骨,形成中具有积极作用。还有许多研究者认为材料分解产生的钙离子能激活细胞膜钙敏感受体,促进血管生成,为骨修复和再生创造良好的环境[34]。总而言之,磷酸钙材料的骨诱导性是由多因素综合产生的,其中如溶液中的钙磷离子、生长因子的吸附、间充质干细胞的分化和增殖及破骨细胞的参与都对骨诱导产生了积极作用。 2.4 磷酸钙陶瓷材料的表面结构 Davison等[35]发现相对于宏观结构和表面化学性质,磷酸钙材料的表面微结构对异位骨形成和破骨影响更为重要。 孔径尺寸:有研究发现,材料孔径在150-500 µm范围内有利于骨组织的生长[36]。Hulbert等[37]发现当材料孔径在100 µm以上时,成骨细胞能更好地迁移;当材料孔径≥150 µm时,甚至能启动骨的形成。Papenburg等[38-39]发现当材料孔径在200 µm左右时,有利于血管的生长和营养物质的运输。Yao等[40]在犬背部肌肉内置入孔径200-400 μm、600-800 μm和 1 000-1 200 μm的多孔磷酸钙材料,发现200- 400 μm孔径材料的成骨率、成骨时间和成骨量表现最佳。Wang等[41]将颗粒大小为212-300 μm、106-212 μm、45-106 μm和小于45 μm的羟基磷灰石/磷酸三钙双向陶瓷材料置入犬脊旁肌。12周后发现除了颗粒小于45 μm的材料以外,其余颗粒都有丰富的新骨形成。综合多数文献,可能保持材料的孔径在200 µm左右是比较适宜的。 微孔尺寸:Zhu等[42]研究发现,当材料表面含有更多直径大于20 nm的微孔时,羟基磷灰石和羟基磷灰石/磷酸三钙双向陶瓷对胰岛素和纤维蛋白原的吸附作用明显提高,而对Ⅰ型胶原的吸附作用却无明显影响。Zhang等[43]分别研制两种不同颗粒和微孔大小的磷酸三钙材料做体外实验和动物实验,发现相对于颗粒尺寸为(0.99±0.20) μm、微孔大小为(0.65±0.25) μm的磷酸三钙材料,颗粒尺寸为(3.08±0.52) μm、微孔大小为(1.58±0.65) μm的磷酸三钙材料在体外实验中诱导骨髓间充质干细胞增殖分化更加显著,在动物实验中诱导成骨更加明显。Davison等[35]将表面孔径为1 μm、2-4 μm和有钛涂层无多孔结构的羟基磷灰石/磷酸三钙双向陶瓷(80%羟基磷灰石+20%磷酸三钙)置入犬体内12周,发现在孔径1 μm和无多孔结构的对照组中发现较多破骨细胞样细胞,而孔径2-4 μm的材料中则很少见到破骨细胞样细胞。现已发现骨诱导性的人工材料大多具有微孔结构,微孔的骨诱导特性已有大量的文献支持,然而微孔直径大小与骨诱导能力的关系还尚未有明确报道。 表面粗糙程度:Webster等[44]用不同制作工艺制作出表面粗糙度介于17-32 nm的氧化铝、二氧化钛和羟基磷灰石做蛋白质和细胞吸附实验。他们在实验中发现表面粗糙度的增加伴随着材料粒度的变小、孔径变小和孔隙率的增加,最终造成材料对玻连蛋白和胶原蛋白吸附的显著提高,并进一步显著提高材料对成骨细胞的黏附,降低对纤维母细胞和内皮细胞的黏附。Vlacic-Zischke等[45]发现,在表面喷砂和酸性处理后钛材料表面的人类成骨细胞分化能力增强。总体来说,多数文献认为随着材料表面粗糙度的增加,材料的骨诱导能力也随之提高[46]。 比表面积:Li等[47]的研究显示,材料表面积越大,材料吸附的蛋白分子数量越多。Hanseler等[48]通过动物实验和体外实验发现,材料表面积的减小和骨形态发生蛋白2在材料里释放速度的增加呈线性关系:表面积越大,材料对蛋白分子吸附能力越强。Habibovic等[49]将磷酸钙材料置入山羊体内并分析材料表面特性和骨诱导量发现,材料表面活性会随材料比表面积增加而增大。由此推测较大的比表面积可能是骨诱导性人工材料必不可少的要素。 表面电荷:Feng等[50]发现成骨细胞在表面涂层为钙的钛种植体上吸附得比在表面涂层为磷酸的钛种植体好。Bodhak等[51]用极化后的羟基磷灰石材料进行实验,发现人类胚胎成骨细胞在带负极的羟基磷灰石上吸附增殖得要比在带正极的羟基磷灰石上要好。Hanseler等[45]通过研究发现,经过处理具有亲水性表面钛材料的骨结合能力得到了提高。多数研究发现,极化后的材料表面对植入体的骨结合和细胞黏附作用有帮助,可能由于极化表面亲水性增加,提高了材料对体内低分子蛋白质的吸附作用。 2.5 磷酸钙材料对细胞的附着能力 Hu等[52]研究发现,兔骨髓间充质干细胞在羟基磷灰石上吸附的数量要比在无定形磷酸钙上多。Berube等[53]的研究也发现,羟基磷灰石吸附的鼠颅骨成骨细胞的数量多于无定形磷酸钙。Knabe等[54]发现,α-磷酸三钙吸附鼠骨髓间充质干细胞比CaKPO4多,他们认为释放等量Ca的情况下,CaKPO4将释放更多的离子,影响细胞的吸附。Webster等[55]发现,随着羟基磷灰石材料孔径和表面粒度的减小、表面粗糙程度和孔隙率的增加,纤维母细胞和内皮细胞的黏附率有所降低,但成骨细胞黏附却显著增加。Poulsson等[56]用经紫外/臭氧表面处理过的超高分子量聚乙烯与人类成骨样细胞培养,发现成骨样细胞的附着和功能得到了增强,证明了增加材料表面含氧量也能提高成骨细胞的附着。综合以上研究可以推测,增加材料的表面粗糙程度和含氧量,选择较低溶解度的材料,选择较高结晶度的材料都可能有利于成骨细胞的吸附和增殖。 2.6 磷酸钙材料对蛋白质分子的吸附能力 Zhu等[42]通过体外实验发现,羟基磷灰石/磷酸三钙双向陶瓷对胰岛素、纤维蛋白原和Ⅰ型胶原的吸附作用比羟基磷灰石更强。Hanseler等[48]将重组人骨形态发生蛋白2分别与羟基磷灰石/磷酸三钙双向陶瓷和脱蛋白牛骨结合并在兔体内和试管内培养,发现脱蛋白牛骨15 d后只释放了一半骨形态发生蛋白2,而羟基磷灰石/磷酸三钙双向陶瓷在24 h内就已释放了全部骨形态发生蛋白2。他们检测出脱蛋白牛骨表面积为67 m2/g,而羟基磷灰石/磷酸三钙双向陶瓷只有0.009 m2/g。表面积的减小和骨形态发生蛋白2释放速度的增加呈线性关系,因此推测影响骨形态发生蛋白2释放速度的主要因素是材料表面积。Webster等[55]也得出了随着羟基磷灰石表面粗糙程度的增加,其对玻连蛋白和胶原蛋白的吸附能力明显提高,对白蛋白、层粘连蛋白和纤连蛋白的吸附却有所下降。由此推测,增加材料的表面积可提高材料对周围组织中蛋白质的吸附。然而决定蛋白质吸附程度的因素还有很多,并且对于不同种类的蛋白质其效果也不尽相同,其原理并不明确,仍然需要更加深入的研究探索。 2.7 磷酸钙材料诱导微血管生成的能力 在骨修复和再生中,新血管的形成发挥着重要作用。Chen等[57]通过比较羟基磷灰石/β-磷酸三钙比例分别为100/0、70/30、30/70和2/98的材料做体内和体外血管诱导生成实验,发现磷酸钙材料能促进微血管生成,且比例为30/70和2/98两组诱导血管更为显著。Castaño等[34]认为是材料中释放的钙离子刺激细胞膜钙敏感受体产生诱导血管形成能力,并成功通过控制材料中钙离子释放来调节血管生成。Zhang等[58]用凝胶复合β-磷酸三钙纤维支架行诱导骨髓间充质干细胞分化成骨和修复鼠骨缺损实验,发现添加β-磷酸三钙的支架材料诱导骨髓间充质干细胞表达细胞膜钙敏感受体显著上升,并诱导更多的新骨和新生血管。综上所述,释放钙离子较多的多孔磷酸钙陶瓷具有更强的诱导微血管生成作用。 2.8 磷酸钙材料的降解度 磷酸钙陶瓷材料的降解方式分为材料自身溶解及破骨细胞介导的吸收。材料的化学组成、晶相构成、表面积、环境酸碱度等都可影响材料的吸收。Yang等[59]研究发现,相对于单纯的多孔脂肪族聚氨酯,结合了羟基磷灰石的多孔脂肪族聚氨酯生物支架在模拟体液中的生物矿化能力显著增强了。他们认为可能是羟基磷灰石颗粒溶解产生大量钙离子,增强了材料的生物矿化能力[59]。因此磷酸钙材料的低溶解度降有助于成骨细胞的附着[52-53],增加材料的强度,却不利于机体新骨的形成。而溶解度增高有助于新骨形成,释放更多的钙离子促进血管新生[34,57-58],但却牺牲了材料强度及稳定性。4种材料的降解能力:无定形磷酸钙>磷酸三钙>羟基磷灰石/磷酸三钙双向陶瓷>羟基磷灰石。理想的植骨材料既需要高的细胞附着性能,较强的机械性能,又尽量减少对新骨形成的影响。当材料的溶解度位于羟基磷灰石与磷酸三钙之间,既能促进新骨形成又能及时降解为新骨。 2.9 磷酸钙材料的置入环境 Yang等[59]在检测材料生物矿化能力的实验中发现,材料在模拟体液和裸鼠皮下所得的实验结果并不一致,他们认为可能是材料所处的环境影响了它的成骨能力。Danoux等[60]也发现,含磷酸钙成分的复合材料在模拟体液、生理盐水和犬肌肉中的骨诱导表现并不一致。有研究用羟基磷灰石和磷酸三钙(60%羟基磷灰石和40%磷酸三钙)植入犬、兔和大鼠肌肉中,发现在狗肌肉中的BCP成骨效果最佳,而在兔和大鼠肌肉中的材料一律只有类骨质形成。很多研究发现同种植入材料在不同动物种属内表现出不同骨诱导能力。且动物种系越接近于人,所表现的骨诱导能力越明显。有研究将磷酸钙材料分别埋入犬肌肉与皮下脂肪,发现皮下脂肪虽然也可成骨,但诱导的骨量与在肌肉中诱导的骨量还是有明显的差距。Habibovic等[49]将人工材料分别置入山羊肌肉和皮下,发现置入肌肉中的材料产生异位成骨,而置入皮下的材料则没有。因此置入环境对材料的骨诱导性能有着显著影响。其机制可能是不同环境下,其溶液中钙磷离子和生物因子浓度有所不同,对成骨细胞的刺激程度不同,甚至材料周围的间充质细胞数量也不同[59]。 2.10 磷酸钙材料的不足和尚待研究方向 尽管磷酸钙材料作为骨替代材料具有许多其他材料所不具备的优点,但也有研究者发现,若单纯依靠其固有骨诱导性,存在短期内成骨能力较弱的缺点。有研究分别用结合骨髓间充质干细胞的多孔磷酸钙组织工程骨、单纯多孔磷酸钙和自体骨分别修复狗牙槽突裂,20周后观察到组织工程骨诱导生成的骨量比单独用磷酸钙材料诱导的量多,而与自体骨诱导形成的骨量无明显差异。后来有学者等改进了实验和检测方法,用结合骨髓间充质干细胞的多孔磷酸钙支架材料和单纯多孔磷酸钙分别修复比格犬下颌骨缺损,在植骨4周和8周后发现都有新骨生成,但前者诱导生成的骨量较多,残留的材料较少。有研究分别用单纯多孔羟基磷灰石/磷酸三钙双向陶瓷材料和结合了重组人骨形态发生蛋白2的多孔羟基磷灰石/磷酸三钙双向陶瓷材料修复小鼠头盖骨缺损,发现结合了人骨形态发生蛋白2的多孔羟基磷灰石/磷酸三钙双向陶瓷材料无论在成骨速度和生成新骨厚度上都要比单纯多孔羟基磷灰石/磷酸三钙双向陶瓷材料效果佳。虽然许多研究发现结合生长因子或细胞的磷酸钙材料在短时间内可明显提升成骨速度和成骨骨量,但随着恢复时间的延长,其与单纯多孔磷酸钙材料最终成骨的差异越来越小。因此,如何进一步改良材料的物理性状,提高短期内的成骨速度是需要探索的方向。"
| [1] Giannoudis PV,Dinopoulos H,Tsiridis E.Bone substitutes: an update.Injury.2005;36 Suppl 3:S20-S27.[2] Habibovic P,de Groot K.Osteoinductive biomaterials-- properties and relevance in bone repair.J Tissue Eng Regen Med.2007;1(1):25-32.[3] Williams DF. On the mechanisms of biocompatibility. Biomaterials.2008;29(20): 2941-2953.[4] Thawani JP,Wang AC,Than KD,et al.Bone morphogenetic proteins and cancer: review of the literature.Neurosurgery.2010;66(2):233-246,246.[5] Virtanen S,Alarmo EL,Sandstrom S,et al.Bone morphogenetic protein -4 and -5 in pancreatic cancer--novel bidirectional players.Exp Cell Res. 2011;317(15):2136-2146.[6] Deng H,Makizumi R,Ravikumar TS,et al.Bone morphogenetic protein-4 is overexpressed in colonic adenocarcinomas and promotes migration and invasion of HCT116 cells.Exp Cell Res. 2007;313(5): 1033-1044.[7] Ivanova T,Zouridis H,Wu Y,et al.Integrated epigenomics identifies BMP4 as a modulator of cisplatin sensitivity in gastric cancer.Gut. 2013; 62(1): 22-33.[8] Singh A,Morris RJ.The Yin and Yang of bone morphogenetic proteins in cancer. Cytokine Growth Factor Rev.2010;21(4):299-313.[9] Ampuja M,Jokimaki R,Juuti-Uusitalo K,et al.BMP4 inhibits the proliferation of breast cancer cells and induces an MMP-dependent migratory phenotype in MDA-MB-231 cells in 3D environment.BMC Cancer. 2013;13:429.[10] Theriault BL,Shepherd TG,Mujoomdar ML,et al.BMP4 induces EMT and Rho GTPase activation in human ovarian cancer cells. Carcinogenesis. 2007;28(6): 1153-1162.[11] Hao J,Lee R,Chang A,et al.DMH1, a small molecule inhibitor of BMP type i receptors, suppresses growth and invasion of lung cancer.PLoS One. 2014;9(6):e90748.[12] Lee YC,Cheng CJ,Bilen MA,et al.BMP4 promotes prostate tumor growth in bone through osteogenesis. Cancer Res.2011;71(15):5194-5203.[13] Dorozhkin SV,Epple M.Biological and medical significance of calcium phosphates.Angew Chem Int Ed Engl.2002;41(17):3130-3146.[14] Yoshikawa H,Myoui A.Bone tissue engineering with porous hydroxyapatite ceramics. J Artif Organs. 2005; 8(3):131-136.[15] Bell LC,Mika H,Kruger BJ.Synthetic hydroxyapatite- solubility product and stoichiometry of dissolution.Arch Oral Biol.1978;23(5):329-336.[16] Yin XL,Stott MJ,Rubio A. alpha- and beta-tricalcium phosphate: A density functional study. Phys Rev B. 2003;20(68):1-8.[17] Fernandez E,Gil FJ,Ginebra MP,et al.Calcium phosphate bone cements for clinical applications. Part I: solution chemistry.J Mater Sci Mater Med. 1999; 10(3): 169-176.[18] Zhao J,Liu Y,Sun WB,et al.Amorphous calcium phosphate and its application in dentistry.Chem Cent J.2011;5:40.[19] Combes C,Rey C.Amorphous calcium phosphates: synthesis, properties and uses in biomaterials.Acta Biomater.2010;6(9):3362-3378.[20] Daculsi G,Legeros RZ,Nery E,et al.Transformation of biphasic calcium phosphate ceramics in vivo: ultrastructural and physicochemical characterization.J Biomed Mater Res.1989;23(8):883-894.[21] Legeros RZ,Lin S,Rohanizadeh R,et al.Biphasic calcium phosphate bioceramics: preparation, properties and applications.J Mater Sci Mater Med. 2003;14(3):201-209.[22] Urist MR.Bone:formation by autoinduction.Science. 1965;150(3698):893-899.[23] Urist MR,Strates BS.Bone morphogenetic protein.J Dent Res.1971;50(6):1392-1406.[24] Finkemeier CG.Bone-grafting and bone-graft substitutes.J Bone Joint Surg Am. 2002;84-A(3): 454-464.[25] Yamasaki H.Heterotopic bone formation around porous hydroxyapatite ceramics in the subcutis of dogs.Oral Biol(Japan).1990;32:190.[26] Ripamonti U.The morphogenesis of bone in replicas of porous hydroxyapatite obtained from conversion of calcium carbonate exoskeletons of coral. Bone Toint Surg.1991;73(5):692.[27] Ravaglioli A,Krajewski A.Bioceramics and the human body.London: Elsevier Applied Science,1992:519.[28] Fu H.Alumina decorated TiO2 nanotubes with ordered mesoporous walls as high sensitivity of NOx gas sensors at room temperature.Nanoscale. 2013;5(18): 8569-8576.[29] Gerber T, Traykova T, Henkel KO,et al.Development and In Vivo Test of Sol-Gel Derived Bone Grafting Materials.J Sol-gel Sci Technol.2003;1-3(26): 1173-1178.[30] Yuan H,Fernandes H,Habibovic P,et al.Osteoinductive ceramics as a synthetic alternative to autologous bone grafting.Proc Natl Acad Sci U S A.2010;107(31): 13614-13619.[31] Bao C,Zhang X.[Research development and prospect of calcium phosphate biomaterials with intrinsic osteoinductivity].Sheng Wu Yi Xue Gong Cheng Xue Za Zhi.2006;23(2): 442-445,454.[32] Danoux CB,Bassett DC,Othman Z,et al.Elucidating the individual effects of calcium and phosphate ions on hMSCs by using composite materials.Acta Biomater. 2015;17:1-15.[33] Davison NL,Gamblin AL,Layrolle P,et al.Liposomal clodronate inhibition of osteoclastogenesis and osteoinduction by submicrostructured beta-tricalcium phosphate.Biomaterials. 2014; 35(19):5088-5097.[34] Castaño O,Sachot N,Xuriguera E,et al.Angiogenesis in bone regeneration: tailored calcium release in hybrid fibrous scaffolds.ACS Appl Mater Interfaces. 2014; 6(10): 7512-7522.[35] Davison NL,Su J,Yuan H,et al.Influence of surface microstructure and chemistry on osteoinduction and osteoclastogenesis by biphasic calcium phosphate dics. Eur Cells Meter.2015;29:314-329.[36] Lane JM,Bostrom MP.Bone grafting and new composite biosynthetic graft materials. Instr Course Lect.1998;47:525-534.[37] Hulbert SF,Young FA,Mathews RS,et al.Potential of ceramic materials as permanently implantable skeletal prostheses.J Biomed Mater Res. 1970; 4(3):433-456.[38] Kuboki Y,Jin Q,Takita H.Geometry of carriers controlling phenotypic expression in BMP-induced osteogenesis and chondrogenesis.J Bone Joint Surg Am.2001;83-A Suppl 1(Pt 2):S105-S115.[39] Papenburg BJ,Liu J,Higuera GA,et al.Development and analysis of multi-layer scaffolds for tissue engineering.Biomaterials.2009;30(31):6228-6239.[40] Yao JF,Li XY,Zhang XW.Study on the Osteoinductivity of Calcium Phosphate Ceramics with different Macroporous Size.J Oral Sci Res. 2011;27(4): 288-295.[41] Wang L,Barbieri D,Zhou H,et al.Effect of particle size on osteoinductive potential of microstructured biphasic calcium phosphate ceramic.J Biomed Mater Res A. 2015;103(6): 1919-1929.[42] Zhu XD,Zhang HJ,Fan HS,et al.Effect of phase composition and microstructure of calcium phosphate ceramic particles on protein adsorption.Acta Biomater. 2010;6(4): 1536-1541.[43] Zhang J,Luo X,Barbieri D,et al.The size of surface microstructures as an osteogenic factor in calcium phosphate ceramics.Acta Biomater. 2014;10(7):3254-3263.[44] Webster TJ,Ergun C,Doremus RH,et al.Specific proteins mediate enhanced osteoblast adhesion on nanophase ceramics.J Biomed Mater Res. 2000;51(3): 475-483.[45] Vlacic-Zischke J,Hamlet SM,Friis T,et al.The influence of surface microroughness and hydrophilicity of titanium on the up-regulation of TGFbeta/BMP signalling in osteoblasts.Biomaterials. 2011;32(3): 665-671.[46] Zhang J,Barbieri D,Ten HH,et al.Microporous calcium phosphate ceramics driving osteogenesis through surface architecture.J Biomed Mater Res A. 2015;103(3): 1188-1199.[47] Li X,van Blitterswijk CA,Feng Q,et al.The effect of calcium phosphate microstructure on bone-related cells in vitro.Biomaterials. 2008; 29(23):3306-3316.[48] Hanseler P,Ehrbar M,Kruse A,et al.Delivery of BMP-2 by two clinically available apatite materials: in vitro and in vivo comparison. J Biomed Mater Res A. 2015; 103(2): 628-638.[49] Habibovic P,Sees TM,van den Doel MA,et al.Osteoinduction by biomaterials--physicochemical and structural influences.J Biomed Mater Res A.2006; 77(4):747-762. [50] Feng B,Weng J,Yang BC,et al.Characterization of titanium surfaces with calcium and phosphate and osteoblast adhesion.Biomaterials. 2004;25(17): 3421-3428.[51] Bodhak S,Bose S,Bandyopadhyay A.Role of surface charge and wettability on early stage mineralization and bone cell-materials interactions of polarized hydroxyapatite.Acta Biomater. 2009; 5(6):2178-2188.[52] Hu QH,Tan Z,Liu YK,et al.Effect of crystallinity of calcium phosphate nanoparticles on adhesion, proliferation, and differentiation of bone marrow mesenchymal stem cells.J Mater Chem. 2007;17(44): 4690-4698.[53] Berube P,Yang Y,Carnes DL,et al.The effect of sputtered calcium phosphate coatings of different crystallinity on osteoblast differentiation.J Periodontol. 2005;76(10): 1697-1709.[54] Knabe C,Berger G,Gildenhaar R,et al.The functional expression of human bone-derived cells grown on rapidly resorbable calcium phosphate ceramics. Biomaterials. 2004;25(2):335-344.[55] Webster TJ,Ergun C,Doremus RH,et al.Specific proteins mediate enhanced osteoblast adhesion on nanophase ceramics.J Biomed Mater Res. 2000; 51(3):475-483.[56] Poulsson AH,Mitchell SA,Davidson MR,et al. Attachment of human primary osteoblast cells to modified polyethylene surfaces.Langmuir. 2009; 25(6):3718-3727.[57] Chen Y,Wang J,Zhu XD,et al.Enhanced effect of beta-tricalcium phosphate phase on neovascularization of porous calcium phosphate ceramics: in vitro and in vivo evidence.Acta Biomater. 2015;11:435-448.[58] Zhang X,Meng S,Huang Y,et al.Electrospun Gelatin/beta-TCP Composite Nanofibers Enhance Osteogenic Differentiation of BMSCs and In Vivo Bone Formation by Activating Ca (2+) -Sensing Receptor Signaling.Stem Cells Int.2015;2015:507154.[59] Yang W,Both SK,Zuo Y,et al.Biological evaluation of porous aliphatic polyurethane/hydroxyapatite composite scaffolds for bone tissue engineering. J Biomed Mater Res A.2015;103(7):2251-2259.[60] Danoux CB,Barbieri D,Yuan H,et al.In vitro and in vivo bioactivity assessment of a polylactic acid/hydroxyapatite composite for bone regeneration. Biomatter.2014;4: e27664. |
| [1] | Pu Rui, Chen Ziyang, Yuan Lingyan. Characteristics and effects of exosomes from different cell sources in cardioprotection [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(在线): 1-. |
| [2] | Zhang Tongtong, Wang Zhonghua, Wen Jie, Song Yuxin, Liu Lin. Application of three-dimensional printing model in surgical resection and reconstruction of cervical tumor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1335-1339. |
| [3] | Zhang Chao, Lü Xin. Heterotopic ossification after acetabular fracture fixation: risk factors, prevention and treatment progress [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1434-1439. |
| [4] | Zhou Jihui, Li Xinzhi, Zhou You, Huang Wei, Chen Wenyao. Multiple problems in the selection of implants for patellar fracture [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1440-1445. |
| [5] | Wang Debin, Bi Zhenggang. Related problems in anatomy mechanics, injury characteristics, fixed repair and three-dimensional technology application for olecranon fracture-dislocations [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1446-1451. |
| [6] | Ji Zhixiang, Lan Changgong. Polymorphism of urate transporter in gout and its correlation with gout treatment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1290-1298. |
| [7] | Yuan Mei, Zhang Xinxin, Guo Yisha, Bi Xia. Diagnostic potential of circulating microRNA in vascular cognitive impairment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1299-1304. |
| [8] | Wang Xianyao, Guan Yalin, Liu Zhongshan. Strategies for improving the therapeutic efficacy of mesenchymal stem cells in the treatment of nonhealing wounds [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1081-1087. |
| [9] | Wan Ran, Shi Xu, Liu Jingsong, Wang Yansong. Research progress in the treatment of spinal cord injury with mesenchymal stem cell secretome [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1088-1095. |
| [10] | Liao Chengcheng, An Jiaxing, Tan Zhangxue, Wang Qian, Liu Jianguo. Therapeutic target and application prospects of oral squamous cell carcinoma stem cells [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1096-1103. |
| [11] | Zhao Min, Feng Liuxiang, Chen Yao, Gu Xia, Wang Pingyi, Li Yimei, Li Wenhua. Exosomes as a disease marker under hypoxic conditions [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1104-1108. |
| [12] | Xie Wenjia, Xia Tianjiao, Zhou Qingyun, Liu Yujia, Gu Xiaoping. Role of microglia-mediated neuronal injury in neurodegenerative diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1109-1115. |
| [13] | Li Shanshan, Guo Xiaoxiao, You Ran, Yang Xiufen, Zhao Lu, Chen Xi, Wang Yanling. Photoreceptor cell replacement therapy for retinal degeneration diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1116-1121. |
| [14] | Jiao Hui, Zhang Yining, Song Yuqing, Lin Yu, Wang Xiuli. Advances in research and application of breast cancer organoids [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1122-1128. |
| [15] | Wang Shiqi, Zhang Jinsheng. Effects of Chinese medicine on proliferation, differentiation and aging of bone marrow mesenchymal stem cells regulating ischemia-hypoxia microenvironment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1129-1134. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||