Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (32): 6971-6978.doi: 10.12307/2025.996
Previous Articles Next Articles
Application of concentrated growth factor in treatment of chronic wounds
Zuo Chaoqi, Zhang Zhiqiang, Cao Nan, Guo Xuan, Xie Kai, Wang Haixia, Zhang Guangliang
- Department of Dermatology, Dermatology Hospital Affiliated to Shandong First Medical University, Jinan 250022, Shandong Province, China
-
Received:2024-11-07Accepted:2024-12-31Online:2025-11-18Published:2025-04-29 -
Contact:Zhang Guangliang, MD, Associate chief physician, Department of Dermatology, Dermatology Hospital Affiliated to Shandong First Medical University, Jinan 250022, Shandong Province, China -
About author:Zuo Chaoqi, Department of Dermatology, Dermatology Hospital Affiliated to Shandong First Medical University, Jinan 250022, Shandong Province, China -
Supported by:Taishan Scholar Talent Project, No. tsqn202312371 (to ZGL); Shandong Province Medical Science and Technology Health Project, No. 202320001137 (to ZGL)
CLC Number:
Cite this article
Zuo Chaoqi, Zhang Zhiqiang, Cao Nan, Guo Xuan, Xie Kai, Wang Haixia, Zhang Guangliang. Application of concentrated growth factor in treatment of chronic wounds[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6971-6978.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
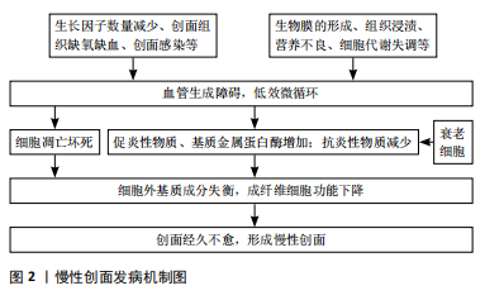
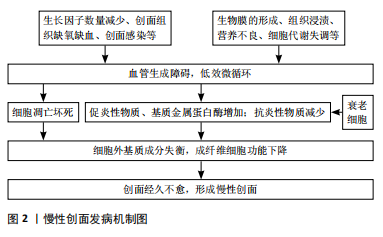
2.1 慢性创面的发病及愈合机制 慢性创面常指3个月内在经过各种治疗方法后仍无法愈合且无法恢复其解剖和功能完整性的创面[5],慢性创面在临床分类上稍有差异,但大致可分为动脉性溃疡、静脉性溃疡、糖尿病性溃疡以及压力性溃疡,其中静脉性溃疡最常见[6-7]。 2.1.1 发病机制 创面愈合的生理过程包括4个步骤:止血、炎症、增殖和重塑,4个步骤在顺序发生的基础上也可重叠发生[6,8],而各种因素如反复感染、糖尿病等阻碍了组织再生的修复过程,从而使创面形成一个慢性创面[9]。 曾鸿孟等[10]总结了慢性创面的发病诱因,包括局部生长因子数量减少、创面组织缺氧、创面组织缺血、创面感染等。MONIKA等[11]在文章中更加详细地概述了导致创面愈合延迟的局部和全身因素,除生长因子含量降低、组织缺血缺氧外还包括生物膜的形成、组织浸渍、营养不良、细胞代谢失调等,这些因素通常会影响血流动力学系统,导致血管生成障碍,最后影响愈合过程。低效的微循环会导致细胞凋亡和坏死,同时会导致促炎性巨噬细胞数量增多、基质金属蛋白酶释放增多以及抗炎性巨噬细胞吞噬能力降低等[12],这些因素又将导致细胞外基质成分失衡、成纤维细胞生成减少。成纤维细胞的功能发生改变,又将会阻碍创面愈合和上皮形成,并最终形成了慢性创面[9,13]。 近年来,慢性创面中的衰老细胞也会阻碍创面愈合的猜想也逐渐得到证明[14-15]。衰老的细胞会促进炎症因子和活性氧的释放,调控微环境从而损伤细胞蛋白质和DNA,促进细胞死亡,并最终延长愈合过程[16]。文章汇总描述了慢性创面的分子机制,见图2。"
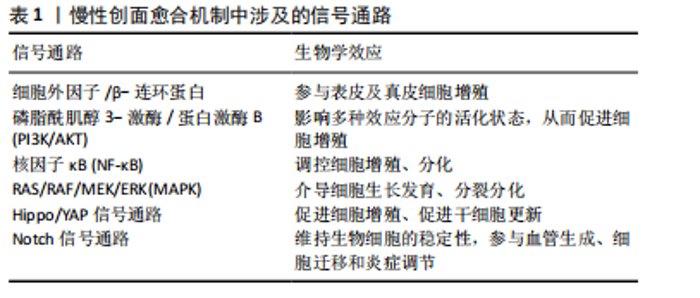
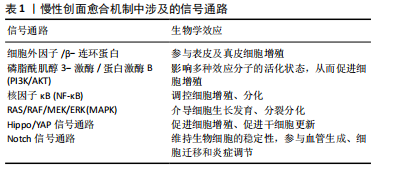
2.1.2 愈合机制 创面愈合过程复杂,主要依靠角质形成细胞、成纤维细胞、炎症细胞、内皮细胞、血小板等不同类型的细胞在皮肤创面愈合中发挥作用[17]。机体受伤后,首先通过收缩血管以及迅速形成血凝块的方式进行止血,同时血小板不断释放生长因子等活性物质加速愈合过程[6,8,18]。炎症早期阶段主要是中性粒细胞通过释放适量的活性氧、基质金属蛋白酶以及蛋白水解酶对受损部位进行分解[6,8,19];而在炎症后期阶段,巨噬细胞、单核细胞长期存在并分泌生长因子和细胞因子,用来促进肉芽组织的生成[8,19-20],此时期也正是慢性创口愈合的特征性时期[11];最后,成纤维细胞、内皮细胞以及角质形成细胞在这些细胞因子的作用下开始增殖迁移,逐渐使创面闭合,完成增殖和重塑阶段[6,19,21]。 王科等[22]在文献中总结了慢性创面愈合的机制:细胞外因子/β-连环蛋白、磷脂酰肌醇3-激酶/蛋白激酶B (phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)、核因子κB等信号通路通过促进多种细胞的增殖和分化、调控机体多种生物学功能参与皮肤创面组织的愈合。同时RAS/RAF/MEK/ERK(MAPK)信号通路在促进创面愈合中的积极作用也得到了广泛认可,该信号通路能够介导细胞生长发育、分裂分化等多个过程,对细胞的增殖、血管的生成有着重要作用[23-24]。吉新彦等[25]、韦积华等[26]分别在文章中提出了Hippo/YAP信号通路以及Nocth 信号通路在慢性创面愈合的重要作用。文章汇总描述了慢性创面愈合的分子机制,见表1。 2.2 浓缩生长因子 血小板中富含生长因子,能够参与机体的各种炎症、免疫反应。富血小板血浆是第一代血小板浓缩物,虽然能够早期释放生长因子,但由于缺乏标准化的制备方案以及制备过程需要添加抗凝剂,对人体"
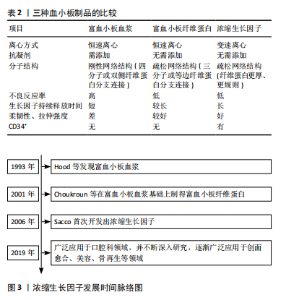
的作用效果差异较大[1]。并且吴锦涛等[27]研究显示富血小板血浆是由四分子或双侧纤维蛋白分支连接而成,在自身高浓度凝血酶的作用下可形成刚性网络结构,而此结构并不利于细胞因子融合和细胞的迁移,因此限定了富血小板血浆在临床中的应用。富血小板纤维蛋白是在富血小板血浆基础上制得的,相对于富血小板血浆而言,富血小板纤维蛋白拥有三维纤维蛋白生物支架的结构而能保证生长因子的缓慢释放,增强作用效果,同时由于富血小板纤维蛋白无须添加抗凝剂,也减少了不良反应的发生率,但离心方式采用恒速离心的方式,导致静脉血离心出的生长因子含量较低[28]。2006年,Sacco首次开发了浓缩生长因子,制作过程中同样不需要添加抗凝剂并且离心方式为变速离心,能够使其天然的三维纤维蛋白支架比富血小板纤维蛋白更加紧密,因此具备了更好的可柔韧性和拉伸强度,同时使得生长因子释放也更加缓慢,从而具有更好的促组织再生能力和抗炎能力。2019年前后,浓缩生长因子因具备高浓度生长因子及良好的拉伸强度,在口腔领域中得到了广泛关注[29]。近年来,由于对浓缩生长因子的研究不断深入,对于其作用机制的认识也不断完善,在创面愈合、美容、骨再生等领域的应用也不断成熟。表2比较了3种血小板制品的特点,图3为浓缩生长因子发展时间脉络图。"
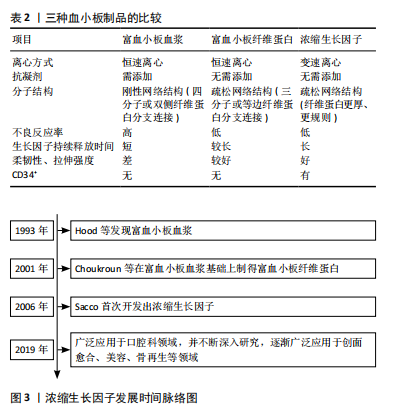
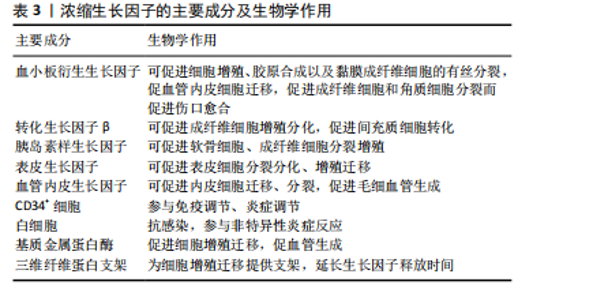
浓缩生长因子中的生长因子释放更加缓慢的观点得到了普遍认可,但关于浓缩生长因子中生长因子的浓度问题,也有学者提出了不同的观点。曾淑红等[30]通过离心静脉血后制备浓缩生长因子及富血小板纤维蛋白,检测其富含的生长因子浓度差异,结果发现从相同体积的血液提取出的浓缩生长因子和富血小板纤维蛋白中的血小板衍生生长因子(platelet-derived growth factor,PDGF)、转化生长因子(transforming growth factor,TGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)的差异并无统计学意义。但总的来说,由于浓缩生长因子含有高浓度的生长因子及紧密的三维纤维蛋白支架,在修复慢性创面、促进创面愈合的应用前景还是非常可观的。 2.2.1 浓缩生长因子的制备 浓缩生长因子是Sacco于2006年通过差速离心血液制得的,其提取过程是首先抽取患者自身静脉血并收集到不含添加剂的试管中,然后放入浓缩生长因子离心机(Medifugetm)中并立即进行离心操作;严格按照离心顺序(加速30 s,2 700 r/min离心2 min,2 400 r/min离心4 min,2 700 r/min离心4 min,3 000 r/min离心3 min,减速36 s至停止)进行离心;血液经过离心后分可为3层(上层为贫血小板血浆,中层即为浓缩生长因子,最下层为红细胞)[31]。 2.2.2 浓缩生长因子的主要成分 生长因子能够促进创面愈合过程顺序进行,不同的生长因子在创面愈合过程中发挥着不同的作用[32]。如血小板衍生生长因子能够促进细胞增殖和胶原合成从而促进创面愈合[33-34];转化生长因子β1能够促进间充质细胞的转化从而促进创面愈合[32,35];血管内皮生长因子能够促进血管生成和重建,实现早期修复创面[32,36]。 浓缩生长因子两大优势就是具有高浓度的生长因子以及具有天然的三维纤维蛋白支架,此外还含有白细胞、CD34+免疫细胞、白细胞介素、基质金属蛋白酶等生物活性成分[37],因此还具备了一定的调节免疫和炎症反应的作用。MASUKI等[38]通过酶联免疫吸附法测定了浓缩生长因子中的生长因子水平,结果发现浓缩生长因子中的血小板衍生生长因子、转化生长因子、血管内皮生长因子等占比均较高。QIAO等[39]和TAKEDA等[40]研究者也测定了浓缩生长因子中生长因子的含量,结果都表示浓缩生长因子中含有高浓度的血小板衍生生长因子、胰岛素样生长因子、血管内皮生长因子等生长因子。此外,LEE等[41]通过酶联免疫吸附测定法比较了浓缩生长因子和富血小板纤维蛋白之间的生长因子含量,结果显示浓缩生长因子中的血小板衍生生长因子、表皮生长因子均显著高于富血小板纤维蛋白组,具有统计学意义。并且TAKAHASHI等[42]还表示这些生长因子的分布状态是均匀分布在浓缩生长因子中。表3汇总了浓缩生长因子中主要成分及生物学作用。 2.2.3 浓缩生长因子促进创面愈合机制 慢性创面愈合与正常创面愈合过程的主要区别在于愈合过程受到干扰,导致愈合过程延长,最终可能导致愈合延迟或不愈。浓"

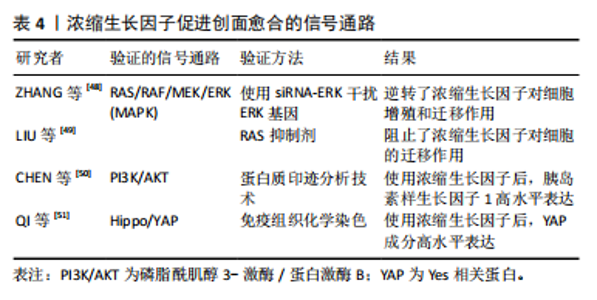
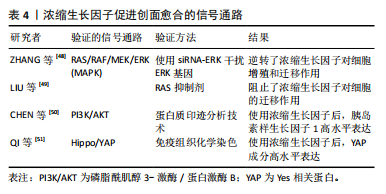
缩生长因子中的血小板受到激活后可以释放α颗粒,之后即可释放多种生长因子和细胞因子[43],并对创面愈合中的关键细胞产生生物学效应,如促进角质形成细胞增殖并迁移到受损部位[44]、通过其可溶性因子和细胞成分促进血管生成等[45],减轻愈合过程中的干扰,加速慢性创面的愈合。 (1)促进细胞迁移增殖:周颐等[33]、高雅姗等[43]分别总结了不同生长因子对不同种类细胞的生物学作用。血小板衍生生长因子、转化生长因子β、胰岛素样生长因子、表皮生长因子、血管内皮生长因子等生长因子相互协同作用,促进细胞增殖迁移,这些生物学作用均有助于慢性创面组织的再生和修复。此外,浓缩生长因子中的基质金属蛋白酶能选择性降解细胞外基质,促进细胞迁移。并且致密的纤维蛋白网络可起到暂时存储生长因子的作用,使生长因子缓慢释放,延长其作用时间。 (2)促进血管生成:血小板衍生生长因子、血管内皮生长因子等均可促进血管内皮细胞迁移及分化,利于血管形成[2],同时由于浓缩生长因子含有三维纤维蛋白结构,能延缓生长因子的释放,具有更强的血管内皮细胞增殖迁移能力,促进血管生成。在基质金属蛋白酶的作用下,内皮细胞也更易迁移并侵入周围组织,促进新血管的形成[46]。 (3)减轻免疫炎症反应:浓缩生长因子本身具有的白细胞、CD34+免疫细胞、白细胞介素等生物活性成分即可调节炎症反应、免疫反应。血小板活化后释放的趋化因子、组胺等物质也可以通过间接趋化白细胞发挥杀菌作用[2]。LUO等[47]将巨噬细胞接种至浓缩生长因子培养基中并通过ELISA检测白细胞介素发现,浓缩生长因子可以调节巨噬细胞的功能活动,证明了浓缩生长因子在抗炎方面的积极作用。 (4)浓缩生长因子促进创面愈合的信号通路:对于浓缩生长因子促进创面愈合的RAS/RAF/MEK/ERK(MAPK)信号通路机制,ZHANG等[48]通过对猪肛瘘模型中对照组、浓缩生长因子组和模型组的治疗效果进行比较,检测到用浓缩生长因子治疗的瘘管创面肉芽组织中表皮生长因子等多种物质含量升高,而表皮生长因子是激活MAPK通路有效物质,即证明浓缩生长因子可以通过激活MAPK信号通路而促进细胞增殖以加速创面愈合;其团队还使用了siRNA-ERK干扰ERK基因,结果发现逆转了浓缩生长因子对细胞增殖和迁移的影响,再次证明浓缩生长因子可以通过MAPK通路促进软组织修复。LIU等[49]也表示表皮生长因子是浓缩生长因子中最重要的成分之一,通过与受体结合激活MAPK通路,并经过RAS抑制剂进行验证,结果发现使用抑制剂后阻止了浓缩生长因子对细胞的迁移作用。 此外,CHEN等[50]通过使用浓缩生长因子刺激从小耳畸形患者中提取出的软骨细胞,并使用蛋白质印迹技术检测胰岛素样生长因子1等物质,发现浓缩生长因子能够提高胰岛素样生长因子1含量而激活胰岛素样生长因子1受体/PI3K/AKT通路,从而促进组织愈合。QI等[51]使用浓缩生长因子对小鼠进行口腔牙龈注射,并使用免疫组织化学染色的方法探究细胞核中Yes相关蛋白(Yes-associated protein,YAP)的浓度,结果显示在使用浓缩生长因子后细胞核内YAP成分呈现高水平表达,证明浓缩生长因子可以通过YAP通路提高血管内皮生长因子而促进组织修复。表4汇总了浓缩生长因子促进创面愈合的信号通路。"
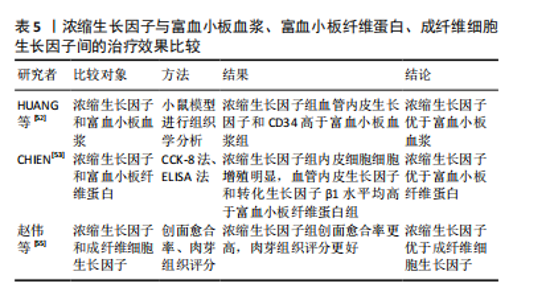
2.2.4 浓缩生长因子与富血小板血浆、富血小板纤维蛋白、成纤维细胞生长因子的治疗效果比较 浓缩生长因子以含有更高浓度的生长因子和天然的三维结构为优势,但在应用于临床时,与同属于血液制品的富血小板血浆、富血小板纤维蛋白以及在临床应用较多的成纤维细胞生长因子之间的治疗效果是否存在差异,需要进一步探索。该文通过查阅文献将浓缩生长因子与富血小板血浆、富血小板纤维蛋白、成纤维细胞生长因子之间分别进行了对比。 HUANG等[52]在治疗小鼠全层皮肤缺损模型实验中,通过对小鼠模型进行组织学分析,发现浓缩生长因子治疗创口中的血管内皮生长因子和CD34明显高于富血小板血浆组,这表明浓缩生长因子促进创面愈合有着更显著的作用。在浓缩生长因子和富血小板纤维蛋白的治疗效果对比中,CHIEN[53]通过CCK-8法分别检测了浓缩生长因子和富血小板纤维蛋白应用于人脐静脉内皮细胞时的增殖情况,发现浓缩生长因子促进细胞增殖的效果更加明显,并通过ELISA检测发现浓缩生长因子组的血管内皮生长因子和转化生长因子β1水平均高于富血小板纤维蛋白组,这表明浓缩生长因子比富血小板纤维蛋白更具有促进创面愈合的潜能。成纤维细胞生长因子因具有刺激细胞生长活性的能力,在临床上广泛用于促进创面愈合、减少瘢痕残留[54]。赵伟等[55]比较浓缩生长因子组和成纤维细胞生长因子组患者的慢性创面愈合率、肉芽组织评分等,结果显示浓缩生长因子组的总体情况明显优于成纤维细胞生长因子组,这表明浓缩生长因子治疗慢性创面的疗效更佳[54]。 综上,通过分别将浓缩生长因子与富血小板血浆、富血小板纤维蛋白、成纤维细胞生长因子之间进行比较,结果表明,浓缩生长因子促进创面愈合的能力明显优于其他,具有很大的促进创面愈合潜能,是一个良好的治疗方案。表5对上述内容进行了汇总。"


2.3 浓缩生长因子的临床应用 作为新兴的血小板浓缩制品,浓缩生长因子已广泛应用于口腔、骨再生等方面的治疗[56-57],虽然目前还没有明确浓缩生长因子在促进创面愈合方面的显著优势,但已经有不少文章证明了浓缩生长因子在这方面的潜能。 柳宏志等[58]首先在实验犬软组织缺损模型中探究了浓缩生长因子对软组织损伤修复的效果,对比了浓缩生长因子组、生物膜对照组和空白对照组的肉芽组织生长情况和炎症反应强度,发现浓缩生长因子组的肉芽组织生长最好、炎症反应最弱,肯定了浓缩生长因子能明显缩短软组织损伤愈合时间、提高愈合质量的能力。ZHAO等[59]通过使用浓缩生长因子对鼻中隔黏膜缺损患者进行临床治疗,发现在经过3-12次的治疗后,患者鼻中隔的外观和功能均已恢复,在后续随访中也未出现复发的情况,并在文章中明确肯定了浓缩生长因子在临床实践中的积极作用。KABILAMURTHI等[60]通过早期创面愈合指数评估了使用浓缩生长因子对于植入类手术后创面愈合的有效性,通过统计学方法证明了浓缩生长因子组和非浓缩生长因子组数据之间具有统计学意义,结果显示浓缩生长因子对于植入类术后的创面愈合有积极影响。WANG等[61]使用浓缩生长因子治疗因注射透明质酸而致组织坏死的患者,经过临床观察,所有患者的创面均有愈合倾向,并经过对这些患者4周的随访发现愈合率高达91.67%。李晨极等[62]探究了浓缩生长因子在糖尿病足溃疡创面修复的作用,纳入了50例符合标准的患者,对这些患者进行了8周的临床观察,对比了他们使用浓缩生长因子前后的代表性指标,结果显示浓缩生长因子用于慢性糖尿病足溃疡的治疗中有着积极作用。 2.4 浓缩生长因子的发展前景 首先,浓缩生长因子应用形式多样。目前浓缩生长因子的制备技术已经成熟,TABATABAEI等[9]、陈诺等[29]、TAKEDA等[40]总结了浓缩生长因子应用于临床的不同形式。但目前浓缩生长因子的各种形式制备方法仍不太统一,以浓缩生长因子膜形式制备过程为例,KAO[63]直接使用钳子压缩浓缩生长因子凝胶以形成一片浓缩生长因子膜,除此之外,有研究者使用压缩器、注射器等进行制备。可见,浓缩生长因子制备过程有待于进一步规范化、标准化。表6总结了浓缩生长因子的不同应用形式及制备方法。"


其次由于浓缩生长因子具有大量可溶性生长因子以及天然的三维纤维蛋白支架的特点,目前已有很多研究者将浓缩生长因子与仿生细胞外基质材料、其他生物活性物质、不同治疗技术等联合使用,用于促进组织创面修复。张利祥[64]运用甲基丙烯酰化明胶(gelatin methacryloyl,GM)负载浓缩生长因子的方法进行创面修复和再生;林勇等[65]运用浓缩生长因子联合Bio-Oss骨粉的方法促进口腔种植术后黏膜愈合和骨缺损再生;赵金[66]运用浓缩生长因子联合负压引流技术治疗糖尿病足溃疡;KAO[63]将人类永生化表皮细胞(HaCaT细胞)培养在浓缩生长因子膜上,用于促进创面的再上皮化等。将浓缩生长因子与不同材料、不同活性物质、不同技术结合,发挥各自的优势,最终达到理想的临床治疗效果。 关于浓缩生长因子的成本效益问题,AMATO等[67]评估了浓缩生长因子的平均应用成本,指出自体浓缩生长因子制作成本约7.5欧元,并表明虽然使用浓缩生长因子敷料的时间较标准敷料平均高出10 min,但由于所需敷料数量显著减少,治疗总成本最终是相对有利的。 最后是关于使用浓缩生长因子的操作简便性。由于目前治疗慢性创面的过程大都较为复杂,后续创面护理要求较高,如皮瓣重建、人工真皮移植、负压创面治疗等,而浓缩生长因子各种形式的使用操作均较简便,如通过涂抹浓缩生长因子凝胶、覆盖浓缩生长因子膜、创面注射浓缩生长因子等途径进行创面治疗,患者依从性好,后续的治疗效果相对也就更佳。 2.5 浓缩生长因子的不足之处 作为新型的血小板浓缩物,浓缩生长因子在治疗口腔疾病、促骨再生、促毛发再生等方面的研究已很成熟[68-69]。近年来许多研究者开始探究浓缩生长因子在治疗慢性创面中促进创面愈合的潜能,并大都肯定了浓缩生长因子在此方面的积极作用。但是,浓缩生长因子在临床应用中仍存在一些问题。 首先是浓缩生长因子的使用剂量问题。LIU等[70]在文章中表示浓缩生长因子的适当剂量是治疗的关键;TABATABAEI等[9]同样表示细胞增殖是以剂量依赖的方式增加,但相较于高浓度而言,在低浓度(< 50%)的浓缩生长因子中细胞迁移和分化增强更加明显。但目前仍缺乏一个公认的治疗标准,关于浓缩生长因子的用法用量问题尚不能达到统一。 此外浓缩生长因子的离心设置也未达到统一,此文选取的离心方案是由2006年SACCO提出的,也有其他研究者是按照不同的离心方案来制备浓缩生长因子。LIU等[70]将离心过程设置为加速30 s,2 700 r/min持续2 min、2 400 r/min持续4 min、2 700 r/min持续2 min和减速30 s;朱湛枫等[71]在离心制备浓缩生长因子时并未设置减速过程。 另外浓缩生长因子是否制备成功并没有标准的鉴定方法。单轶等[72]、何勤等[73]在进行浓缩生长因子的相关研究时,均直接使用变速离心后的静脉血的中间层进行临床试验,并未进行成分鉴定。但是由于不同供者血液中的生长因子浓度有所不同,以及抽取血液制备浓缩生长因子时的时间周期、环境温度等因素的不同,都可能会影响最终制得的浓缩生长因子中的生长因子浓度[74]。陈飞等[75]、QIAO等[39]、TAKEDA等[40]检测了浓缩生长因子中的血管内皮因子、转化生长因子β含量,但各自测得的生长因子浓度结果差异较大,故仅通过检测浓缩生长因子中生长因子的浓度来鉴定浓缩生长因子是否制备成功的方法并不适用。在《浓缩血小板制品在创面修复中应用的全国专家共识(2020版)》中,专家表示应用于创面修复的浓缩血小板制品的血小板浓度应≥1 000×109 L-1, 这为鉴定浓缩生长因子质量优劣问题提供了一个方法。刘小嘉[76]在研究血小板浓缩制品对小鼠烧伤创面的影响时,将制备的IPRF中的血小板浓度和生长因子浓度与自身血液中的浓度进行比较,结果发现两组数据差异较大,均具有统计学意义,综合两组结果,并以此作为鉴定血小板浓缩制品制备成功的标准,通过将浓缩生长因子与自身血液成分进行比较,避免了个体差异性。 此外,如上文提及的浓缩生长因子不同形态的制备方案也有待于进行规范化、统一化。浓缩生长因子的发展前景十分可观,如果能够解决标准化的问题,浓缩生长因子将会在多个领域上发挥其积极作用,成为一种安全有效的治疗方案。"

| [1] 陈新冲,黄广涛.慢性创面的血小板浓缩物制品治疗研究进展[J].重庆医学,2022,51(19):3374-3378+3384. [2] 丁泓帆,郑兴锋,夏照帆.血小板浓缩物在慢性创面治疗中应用的研究进展[J].中华损伤与修复杂志(电子版),2022,17(2):147-153. [3] NELSON EA, BRADLEY MD. Dressings and topical agents for arterial leg ulcers. Cochrane Database Syst Rev. 2007;(1):CD001836. [4] CHEN J, WAN Y, LIN Y, et al. Platelet-rich fibrin and concentrated growth factors as novel platelet concentrates for chronic hard-to-heal skin ulcers: a systematic review and Meta-analysis of randomized controlled trials. J Dermatolog Treat. 2022;33(2):613-621. [5] ZHAO R, LIANG H, CLARKE E, et al. Inflammation in Chronic Wounds. Int J Mol Sci. 2016;17(12):2085. [6] SHEDOEVA A, LEAVESLEY D, UPTON Z, et al. Wound Healing and the Use of Medicinal Plants. Evid Based Complement Alternat Med. 2019; 2019:2684108. [7] REZAIE F, MOMENI-MOGHADDAM M, NADERI-MESHKIN H. Regeneration and Repair of Skin Wounds: Various Strategies for Treatment. Int J Low Extrem Wounds. 2019;18(3):247-261. [8] DALISSON B, BARRALET J. Bioinorganics and Wound Healing. Adv Healthc Mater. 2019;8(18):e1900764. [9] TABATABAEI F, AGHAMOHAMMADI Z, TAYEBI L. In vitro and in vivo effects of concentrated growth factor on cells and tissues. J Biomed Mater Res A. 2020;108(6):1338-1350. [10] 曾鸿孟,唐乾利.体表慢性难愈合创面的研究进展[J].中国烧伤创疡杂志,2016,28(5):340-344. [11] MONIKA P, CHANDRAPRABHA MN, RANGARAJAN A, et al, Chidambara Murthy KN. Challenges in Healing Wound: Role of Complementary and Alternative Medicine. Front Nutr. 2022;8:791899. [12] RAZIYEVA K, KIM Y, ZHARKINBEKOV Z, et al. Immunology of Acute and Chronic Wound Healing. Biomolecules. 2021;11(5):700. [13] PASTAR I, BALUKOFF NC, MARJANOVIC J, et al. Molecular Pathophysiology of Chronic Wounds: Current State and Future Directions. Cold Spring Harb Perspect Biol. 2023;15(4):a041243. [14] BOWERS S, FRANCO E. Chronic Wounds: Evaluation and Management. Am Fam Physician. 2020;101(3):159-166. [15] WEI X, LI M, ZHENG Z, et al. Senescence in chronic wounds and potential targeted therapies. Burns Trauma. 2022;10:tkab045. [16] KHALID KA, NAWI AFM, ZULKIFLI N, et al. Aging and Wound Healing of the Skin: A Review of Clinical and Pathophysiological Hallmarks. Life (Basel). 2022;12(12):2142. [17] MAMUN AA, SHAO C, GENG P, et al. Recent advances in molecular mechanisms of skin wound healing and its treatments. Front Immunol. 2024;15:1395479. [18] NOSRATI H, ARAMIDEH KHOUY R, NOSRATI A, et al. Nanocomposite scaffolds for accelerating chronic wound healing by enhancing angiogenesis. J Nanobiotechnology. 2021;19(1):1. [19] SU L, ZHENG J, WANG Y, et al. Emerging progress on the mechanism and technology in wound repair. Biomed Pharmacother. 2019;117:109191. [20] TEHRANY PM, RAHMANIAN P, REZAEE A, et al. Multifunctional and theranostic hydrogels for wound healing acceleration: An emphasis on diabetic-related chronic wounds. Environ Res. 2023;238(Pt 1):117087. [21] CHIN JS, MADDEN L, CHEW SY, et al. Drug therapies and delivery mechanisms to treat perturbed skin wound healing. Adv Drug Deliv Rev. 2019;149-150:2-18. [22] 王科,晁生武.创面愈合相关机制的研究进展[J].中华损伤与修复杂志(电子版),2021,16(1):81-84. [23] DEGIRMENCI U, WANG M, HU J. Targeting Aberrant RAS/RAF/MEK/ERK Signaling for Cancer Therapy. Cells. 2020;9(1):198. [24] 陈建勇,王聪,王娟,等.MAPK信号通路研究进展[J].中国医药科学,2011,1(8):32-34. [25] 吉新彦,钟国轩,赵斌.哺乳动物Hippo信号通路分子机制研究进展[J].遗传,2017,39(7):546-567. [26] 韦积华,周海东.糖尿病足溃疡创面愈合相关机制的研究进展[J].右江医学,2021,49(8):621-624. [27] 吴锦涛,邹立津,刘兆辉,等.血小板浓缩物在创面愈合中的研究进展[J].广东医学,2023,44(1):118-123. [28] 魏中武,黄谢山,陈灼庚.浓缩生长因子在口腔临床中的应用及研究进展[J].国际口腔医学杂志,2020,47(2):235-243. [29] 陈诺,李羽霖,阮琼芳,等.浓缩生长因子及其在促进损伤组织修复中的应用进展[J].中华损伤与修复杂志(电子版),2021,16(6):520-524. [30] 曾淑红,易成刚.血小板浓缩提取物促进组织修复的研究进展[J].中国美容整形外科杂志,2021,32(12):768-771. [31] RODELLA LF, FAVERO G, BONINSEGNA R, et al. Growth factors, CD34 positive cells, and fibrin network analysis in concentrated growth factors fraction. Microsc Res Tech. 2011;74(8):772-777. [32] DING ZY, TAN Y, PENG Q, et al. Novel applications of platelet concentrates in tissue regeneration (Review). Exp Ther Med. 2021; 21(3):226. [33] 周颐,刘笑言,向柄彦.组织修复和再生领域浓缩生长因子的应用优势[J].中国组织工程研究,2022,26(10):1631-1640. [34] LI J, HU W, ZHANG R, et al. PDGF-C promotes cell proliferation partially via downregulating BOP1. Cell Biol Int. 2023;47(12):1942-1949.
[35] LIU J, ZHANG J, LIN X, et al. Age-associated callus senescent cells produce TGF-β1 that inhibits fracture healing in aged mice. J Clin Invest. 2022;132(8):e148073. [36] DU E, LI X, HE S, et al. The critical role of the interplays of EphrinB2/EphB4 and VEGF in the induction of angiogenesis. Mol Biol Rep. 2020; 47(6):4681-4690. [37] 程浩,李菊,赵勇,等.浓缩生长因子(CGF)的基础研究及临床应用进展[J].中国美容整形外科杂志,2024,35(8):505-508+519. [38] MASUKI H, OKUDERA T, WATANEBE T, et al. Growth factor and pro-inflammatory cytokine contents in platelet-rich plasma (PRP), plasma rich in growth factors (PRGF), advanced platelet-rich fibrin (A-PRF), and concentrated growth factors (CGF). Int J Implant Dent. 2016;2(1):19. [39] QIAO J, AN N, OUYANG X. Quantification of growth factors in different platelet concentrates. Platelets. 2017;28(8):774-778. [40] TAKEDA Y, KATSUTOSHI K, MATSUZAKA K, et al. The Effect of Concentrated Growth Factor on Rat Bone Marrow Cells In Vitro and on Calvarial Bone Healing In Vivo. Int J Oral Maxillofac Implants. 2015; 30(5):1187-1196. [41] LEE HM, SHEN EC, SHEN JT, et al. Tensile strength, growth factor content and proliferation activities for two platelet concentrates of platelet-rich fibrin and concentrated growth factor. J Dent Sci. 2020; 15(2):141-146. [42] TAKAHASHI A, TSUJINO T, YAMAGUCHI S, et al. Distribution of platelets, transforming growth factor-β1, platelet-derived growth factor-BB, vascular endothelial growth factor and matrix metalloprotease-9 in advanced platelet-rich fibrin and concentrated growth factor matrices. J Investig Clin Dent. 2019;10(4):e12458. [43] 高雅姗,李青峰.自体血小板浓缩制品在整形美容外科中的应用[J].组织工程与重建外科杂志,2015,11(4):282-285. [44] 刘芸伶,何儒雅,聂敏海,等.浓缩生长因子和表皮生长因子在口颌面部软硬组织损伤修复领域的应用[J].中国组织工程研究,2023, 27(1):105-113. [45] CALABRISO N, STANCA E, ROCHIRA A, et al. Angiogenic Properties of Concentrated Growth Factors (CGFs): The Role of Soluble Factors andCellularComponents. Pharmaceutics. 2021;13(5):635. [46] 梁荣洲,杨思奋.浓缩生长因子在皮肤和整形美容中的应用进展[J].中国美容医学,2024,33(11):175-178. [47] LUO H, LIU W, ZHOU Y, et al. Concentrated growth factor reg ulates the macrophage-mediated immune response. Regen Biomater. 2021;8(6):49. [48] ZHANG X, QIU J, WANG H, et al. Autologous Bioactive Compound Concentrated Growth Factor Ameliorates Fistula Healing of Anal Fistula in a Pig Model and Promotes Proliferation and Migration of Human Skin Fibroblasts via Regulating the MEK/ERK Pathway. Oxid Med Cell Longev. 2022;2022:7660118. [49] LIU Y, LIU Y, ZENG C, et al. Concentrated Growth Factor Promotes Wound Healing Potential of HaCaT Cells by Activating the RAS Signaling Pathway. Front Biosci (Landmark Ed). 2022;27(12):319. [50] CHEN X, ZHANG R, ZHANG Q, et al. Microtia patients: Auricular chondrocyte ECM is promoted by CGF through IGF-1 activation of the IGF-1R/PI3K/AKT pathway. J Cell Physiol. 2019;234(12):21817-21824. [51] QI L, LIU L, HU Y, et al. Concentrated growth factor promotes gingival regeneration through the AKT/Wnt/β-catenin and YAP signaling pathways. Artif Cells Nanomed Biotechnol. 2020;48(1):920-932. [52] HUANG L, DONG Y, LI C, et al. Effect of platelet concentrate prepared by different methods on the healing of full-thickness skin defects. J Cosmet Dermatol. 2022;21(11):5910-5921. [53] CHIEN QD .浓缩生长因子和富血小板纤维蛋白促血管化作用的体外对比研究[D].长春:吉林大学,2016. [54] 苏毅程,王珣.碱性成纤维细胞生长因子在减少创面瘢痕中作用的研究进展[J].中国美容整形外科杂志,2023,34(7):446-451. [55] 赵伟,陈旭日,伍玉兰.自体血小板浓缩生长因子与成纤维细胞生长因子治疗慢性难愈性创面的临床对照研究[J].中国美容医学, 2023,32(10):33-36+158. [56] CHEN L, CHENG J, CAI Y, et al. Efficacy of concentrated growth factor (CGF) in the surgical treatment of oral diseases: a systematic review and meta-analysis. BMC Oral Health. 2023;23(1):712. [57] 张璐,王频,郭玲,等.富自体浓缩生长因子纤维蛋白液在口腔骨缺损种植引导骨再生后的骨量变化[J].中国组织工程研究,2017, 21(8):1186-1191. [58] 柳宏志,邹高峰,王天祥,等.浓缩生长因子促进犬软组织损伤修复的实验研究[J].口腔颌面外科杂志,2013,23(1):28-31. [59] ZHAO QM, GAO J, HUANG XX, et al. Concentrated Growth Factors Extracted from Blood Plasma Used to Repair Nasal Septal Mucosal Defect After Rhinoplasty. Aesthetic Plast Surg. 2020;44(2):511-516. [60] KABILAMURTHI RS, ABHINAV RP, THIYANESWARAN N, et al. Effectiveness of Concentrated Growth Factor on Surgical Wound Healing: A Pilot Study. J Long Term Eff Med Implants. 2021;31(3):27-32. [61] WANG X, ZHAO Q, CHEN X, et al. Use of liquid concentrated growth factor in the management of necrotic tissue after facial vascular complications induced by hyaluronic acid injection. Wounds. 2022; 34(11):263-268. [62] 李晨极,曹东升.浓缩生长因子(CGF)在糖尿病足溃疡创面治疗中的应用研究[J].科技风,2021(14):151-152. [63] KAO CH. Use of concentrate growth factors gel or membrane in chronic wound healing: Description of 18 cases. Int Wound J. 2020;17(1):158-166. [64] 张利祥.负载浓缩生长因子的甲基丙烯酰化水凝胶促进创面修复的研究[D].重庆:中国人民解放军陆军军医大学,2023. [65] 林勇,毛驰,侯丹,等.富自体浓缩生长因子纤维蛋白液联合Bio-Oss骨粉对口腔种植引导性骨再生术后黏膜愈合和骨缺损再生的影响[J].上海口腔医学,2020,29(3):316-320. [66] 赵金.自体浓缩生长因子联合负压引流技术治疗糖尿病足溃疡的临床研究[D].唐山:华北理工大学,2022. [67] AMATO B, FARINA MA, CAMPISI S, et al. CGF Treatment of Leg Ulcers: a Randomized Controlled Trial. Open Med (Wars). 2019;14:959-967. [68] 刘燕,庞静,张雪青,等.浓缩生长因子治疗雄激素性秃发的回顾性研究[J].中国麻风皮肤病杂志,2024,40(2):95-100. [69] HUANG MN, TANG SJ. CGF-induced implant osteogenesis. Br Dent J. 2024;236(7):507. [70] LIU P, LIU Y, KE CN, et al. Therapeutic effect of autologous concentrated growth factor on lower-extremity chronic refractory wounds: A case report. World J Clin Cases. 2021;9(18):4797-4802. [71] 朱湛枫,杨婷婷,陈沁怡,等.屏障材料自体浓缩生长因子膜和骨胶原在后牙区牙槽嵴保存术中的应用:一项1年随访的前瞻性队列研究[J].华西口腔医学杂志,2024,42(3):346-352. [72] 单轶,刘虹秀,包春艳,等.CGF用于牙髓血管再生对内皮细胞增殖的影响[J].中国美容医学,2024,33(10):18-22. [73] 何勤,任婷婷,罗青,等.自体浓缩生长因子联合毫火针激活 Wnt/β-catenin信号促进小鼠毛发生长[J].中国皮肤性病学杂志, 2023,37(7):771-778. [74] 朱业华,马春会,郭如华,等.自体血小板胶中转化生长因子-β1浓度的影响因素[J].中国生物制品学杂志,2011,24(2):176-178. [75] 陈飞,潘韶霞,冯海兰.转化生长因子-β1和血管内皮生长因子在浓缩生长因子各层中的分布及含量特点[J].北京大学学报(医学版),2016,48(5):860-865. [76] 刘小嘉.可注射浓缩血小板纤维蛋白对大鼠烧伤创面愈合的影响[D].南充:川北医学院,2020. [77] 江遥,梁舒曼,李敬.浓缩生长因子在创面修复及美容医学中的应用进展[J].中国医疗美容,2024,14(5):106-109. |
| [1] | Dong Meilin, Du Haiyu, Liu Yuan. Quercetin-loaded carboxymethyl chitosan hydrogel promotes wound healing in diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 692-699. |
| [2] | Yan Rui, Wang Yiyu, Liu Xue, Jiang Yourong, Cheng Huanzhi, Ma Zhe. Application of exosome-loaded hydrogel in nerve injury regeneration and wound healing [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7439-7446. |
| [3] | Cao Dayong, Zheng Junjie, Wang Lei, Yang Yang, Guo Haina, Xing Peipeng, Xia Chengde, Di Haiping. Autologous scalp repair of wounds in the medium-thickness skin donor area: safety and effectiveness [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(18): 3804-3810. |
| [4] | Lin Li, Jiao Linxi, Yu Fangning, Ma Yichao, Zhang Bo, Xu Xuying. Preclinical study of platelet-rich plasma combined with adipose stem cell transplantation in accelerating wound healing: a systematic evaluation and meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(13): 2753-2763. |
| [5] | Long Chenyan, Cheng Biao, Tian Ju. Cellular and molecular mechanisms of platelet-rich plasma in promoting wound healing [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(13): 2793-2801. |
| [6] | Zhang Ya, Mu Qiuju, Wang Zilin, Liu Hongjie, Zhu Lili. Hydrogel loaded with platelet-rich plasma promotes wound healing in diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 690-696. |
| [7] | Tang Lulu, Pan Xiaojia, Lai Yingtao, Wang Li. Regulatory mechanism of ferroptosis on pressure ulcers: bioinformatics analysis and experimental validation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(35): 5656-5661. |
| [8] | Liu Lu, Liu Shudan, Liu Xiaodan, Yang Li, Ling Chen, Hai Xiaoming, Ma Huiming, Chen Dongmei. Oxymatrine hydrogel promotes wound healing by activating Nrf2/HO-1 pathway in keratinocytes [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(29): 4620-4627. |
| [9] | Zhu Yongzhao, Fang Chao, Zhao Fang, Zhang Qing, Zhao Dan. Mechanism by which lycium barbarum polysaccharides inhibit keratinocyte apoptosis in burn wounds via autophagy [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(23): 3686-3691. |
| [10] | Wang Maomao, Zhang Qing, Wu Bowen, Xie Yan. Liposome gel loaded oleic acid promotes the repair of chronic burn wounds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(22): 3524-3531. |
| [11] | Xiao Ziteng, Wang Tingyu, Zhang Wenwen, Tan Fengyi, Su Haiwei, Li Siting, Wu Yahui, Zhou Yanfang, Peng Xinsheng. Exosomes and skin wound healing [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(19): 3104-3110. |
| [12] | Wang Xindong, Liang Chengzhi, Zhang Yongxian. Functional characteristics and clinical applications of MXene nanoparticles in wound healing [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(17): 2739-2746. |
| [13] | Wang Jinlei, Li Ke, Zhao Liang. Platelet-camouflaged silver nanoparticle hydrogel accelerates wound healing in type 1 diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(17): 2659-2666. |
| [14] | He Wei, Zhou Zheng, Wu Lingling, Wang Kai, Mu Caiyun. Moxibustion and reduced graphene oxide/cerium dioxide nanocomposites for repairing infectious wounds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(15): 2307-2314. |
| [15] | Dong Hongfei, Huang Xi, Li Xianhui, Zhang Yanbiao, Wang Xuyang, Wang Bing, Sun Hongyu. Placenta-derived mesenchymal stem cells in promoting acute skin wound healing in rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(13): 2047-2053. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||