Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (32): 6979-6988.doi: 10.12307/2025.940
Previous Articles Next Articles
Neural physiological basis and exercise-induced mechanism of central fatigue
Wang Qifei1, Du Xingbin1, Kong Jianda2
- 1Shandong Huayu University of Technology, Dezhou 253000, Shandong Province, China; 2School of Sport Science, Qufu Normal University, Jining 272000, Shandong Province, China
-
Received:2024-10-31Accepted:2024-12-10Online:2025-11-18Published:2025-04-29 -
Contact:Du Xingbin, Doctoral candidate, Professor, Shandong Huayu University of Technology, Dezhou 253000, Shandong Province, China Co-corresponding author: Kong Jianda, MS, School of Sport Science, Qufu Normal University, Jining 272000, Shandong Province, China -
About author:Wang Qifei, MS, Associate professor, Shandong Huayu University of Technology, Dezhou 253000, Shandong Province, China Corresponding author: -
Supported by:2021 Shandong Undergraduate Education and Teaching Reform Project, No. M2021107 (to DXB)
CLC Number:
Cite this article
Wang Qifei, Du Xingbin, Kong Jianda. Neural physiological basis and exercise-induced mechanism of central fatigue[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6979-6988.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
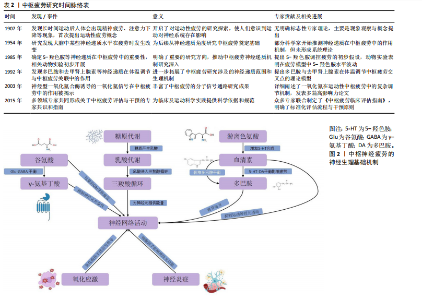
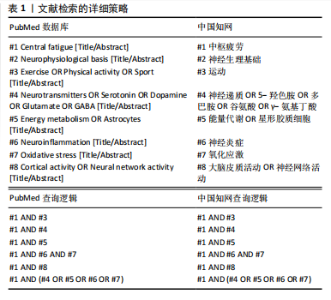
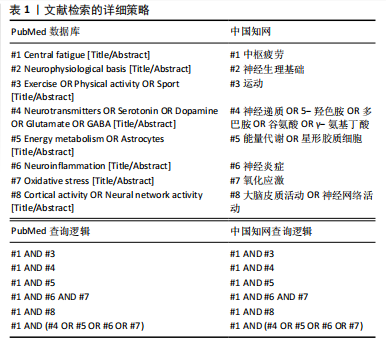
来实现中枢疲劳的量化[4-5]。与外周疲劳不同,中枢疲劳主要涉及大脑和脊髓中的神经网络及神经递质的不平衡,尤其是在控制运动和情绪的神经通路中,涉及多巴胺、5-羟色胺和去甲肾上腺素等递质的调节失调[16]。YANG等[7]研究表明,长时间的精神或体力活动会使神经递质发生变化,例如5-羟色胺水平升高可能会增加疲劳的感觉,而多巴胺减少能够导致动力下降和认知能力降低。此外,YANG等[7]还认为神经炎症和神经免疫反应亦与中枢疲劳密切相关,可能使学习能力和记忆力下降,这进一步加剧了疲劳的表现。 中枢疲劳的形成与运动持续时间、强度以及神经递质的调节密切相关,而长时间或高强度的运动会使大脑中5-羟色胺和多巴胺等神经递质失衡,进而增加疲劳感[1]。 5-羟色胺的双重作用主要体现在其浓度和作用部位的不同。当运动强度较低或中等时,5-羟色胺的增加有助于改善情绪、提高兴奋状态和保持较高的运动表现[17];然而,在高强度、长时间的运动后,5-羟色胺浓度显著升高,尤其是在脑干和下丘脑等控制睡眠和疲劳的区域,可能会产生过度的抑制作用[18]。过量的5-羟色胺通过与其受体(如5-羟色胺2A、5-羟色胺3等)的相互作用,可能使疲劳感加剧、动力缺失及情绪低落等负面效应[8-19]。例如,CORDEIRO等[8]研究显示,通过增加大脑中色氨酸促进5-羟色胺合成,虽然短期内能够提高运动表现,但随着浓度的持续升高,运动持续时间和表现反而会显著下降,表现出5-羟色胺的抑制作用。此外,5-羟色胺的浓度调节还受到能量代谢紊乱、神经炎症和氧化应激等生理机制的影响,这些因素可能通过影响大脑的能量供应和神经递质的平衡进一步加剧疲劳感[11-15]。表2展示了该领域的时间脉络表。 2.2 中枢疲劳的神经生理基础 中枢疲劳不仅仅是身体肌肉的疲劳,还涉及大脑中复杂的神经网络和生理过程的相互作用,特别是神经递质、能量代谢以及炎症反应等因素的调控。图2展示了中枢神经疲劳的神经生理基础机制。"

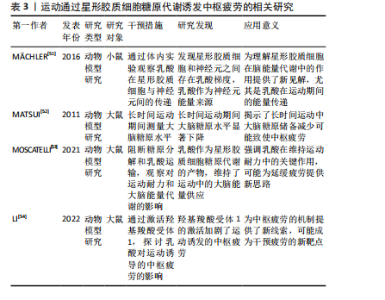
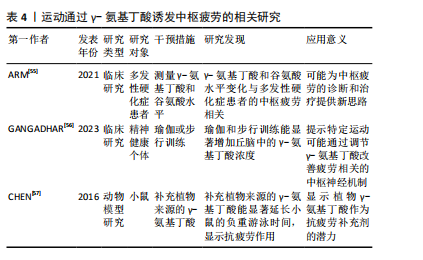
2.2.1 中枢疲劳的神经递质调控 (1)5-羟色胺调控:5-羟色胺在中枢疲劳中发挥了复杂的双重作用。运动时,5-羟色胺水平升高会抑制运动神经元的活动,致使疲劳感增加[6],该过程与血浆中游离色氨酸的浓度变化有关,当游离色氨酸水平上升时,5-羟色胺合成增加,进而在大脑内产生更强烈的疲劳感[18]。此外,ROELANDS等[16]通过综述表明,5-羟色胺可能通过影响大脑中的神经递质如多巴胺和去甲肾上腺素的平衡,在持久运动过程中促进耐力的提升,但5-羟色胺的抑制作用则是中枢疲劳的关键机制之一。5-羟色胺在大脑中的作用具有双重性,既能够发挥兴奋作用,又能在一定浓度下发挥抑制作用[20-21]。通常适量的5-羟色胺有助于调节情绪、睡眠和动力等功能[22]。然而,在高强度或长时间运动后,5-羟色胺浓度过高时,会致使疲劳的加重,甚至出现抑制性作用[18]。 (2)多巴胺调控:多巴胺是一种关键的激励性神经递质,与中枢疲劳的产生密切相关,而运动诱发的多巴胺水平变化与动机、愉悦感和奖励机制有密切联系[23]。研究显示,当多巴胺水平下降时,个体的运动意愿降低,疲劳感增加,这种现象被认为是中枢疲劳的主要表现之一[24]。此外,5-羟色胺与多巴胺之间的平衡在疲劳产生中起到了重要作用。5-羟色胺增加时常伴随着多巴胺的减少,这种神经递质间的不平衡会加剧疲劳感[9-25]。研究显示,运动过程中5-羟色胺上升通常会增加疲劳的风险[25],而多巴胺水平下降则会抑制运动中的愉悦感和动机[23]。研究表明,特定药物或营养补充(如支链氨基酸)能够通过影响5-羟色胺和多巴胺的合成或释放来调节疲劳的程度[8]。 因此,多巴胺和5-羟色胺在运动诱导的中枢疲劳机制中发挥重要作用,这说明通过调节这些神经递质的平衡有可能减轻中枢疲劳。 (3)γ-氨基丁酸调控:在运动中,γ-氨基丁酸作为中枢神经系统的主要抑制性神经递质,其活性增强可能通过抑制神经元兴奋性而诱发疲劳感。研究显示,γ-氨基丁酸不仅在神经抑制中发挥作用,而且通过调节免疫反应影响疲劳的产生。特别是在慢性疲劳综合征中,γ-氨基丁酸和谷氨酸水平失衡是致使中枢疲劳的潜在原因[9]。这些机制为理解运动与疲劳的神经生物学基础提供了重要的线索。 (4)谷氨酸调控:谷氨酸是中枢神经系统中的主要兴奋性神经递质,特别是在长时间或高强度运动中,谷氨酸水平升高会致使神经元过度兴奋,进而诱发中枢疲劳的症状[26-27]。研究显示,在运动过程中,随着身体负荷的增加,谷氨酸水平显著升高,这种现象是由于大脑代谢率和谷氨酸合成增加[28]。此外,谷氨酸与γ-氨基丁酸的平衡对于维持正常的神经功能至关重要。谷氨酸的过度积累可能使神经元负担过重,进一步导致中枢疲劳。而γ-氨基丁酸作为主要的抑制性神经递质,通过调节突触前和突触后的信号传递,能够抑制过度兴奋,维持神经元的稳定[10]。这些研究显示,长时间的运动不仅增加了谷氨酸的浓度,还影响了谷氨酸和γ-氨基丁酸的调控机制,打破二者平衡,致使中枢疲劳的产生。 2.2.2 能量代谢与中枢疲劳 (1)糖原代谢:大脑的能量主要来源于糖原储备,尤其是星形胶质细胞中的糖原。在长时间的运动过程中,这些储备逐渐被消耗,致使能量供应下降。乳酸作为糖原分解的主要产物,是神经元的关键能量底物,并通过单羧酸转运蛋白有效地穿过血脑屏障。当运动激烈时,单羧酸转运蛋白的表达会迅速上调,以满足大脑对能量的急剧需求[29]。然而,随着运动持续,血糖水平下降,脑内的糖原逐步耗竭,最终致使神经元能量供应不足,进而诱发中枢疲劳[30]。 研究显示,星形胶质细胞中的糖原在长时间运动中发挥了至关重要的作用。当血糖水平下降时,糖原通过糖酵解转化为乳酸,并供神经元使用,进而维持大脑的功能稳定[31],该机制在运动过程中确保了大脑在能量需求增加时能够高效运作[32]。然而,在持续的高强度运动中,脑内糖原储备的耗竭最终无法满足神经元的能量需求,致使中枢疲劳的发生,这揭示了糖原代谢在运动疲劳中的重要作用[33]。 (2)乳酸代谢:乳酸在运动中的代谢过程已被广泛研究,尤其是在神经元功能维持方面的作用。根据“星形胶质细胞-神经元乳酸穿梭假说”,星形胶质细胞通过糖酵解产生乳酸,并通过单羧酸转运蛋白将其输送至神经元[34-35]。在神经元内,乳酸被转化为丙酮酸,进入三羧酸循环,进而为神经元提供ATP,满足其高能量需求,尤其在运动强度增加或神经活动增强时[35]。 不仅如此,乳酸还通过影响神经元的兴奋性,在调控中枢疲劳的感知中发挥着重要作用。研究显示,乳酸可通过激活特定受体(如HCAR1受体)来降低神经元的兴奋性,进而抑制疲劳感[28]。然而,当乳酸浓度过高时,可能会通过这些受体加剧神经元的抑制作用,进一步加重疲劳的感知[34]。该现象表明,乳酸在代谢过程中的作用是双向的,既有助于维持神经元的能量供应,亦可能在过量时对神经功能产生负面影响。 (3)三羧酸循环:三羧酸循环(亦称为克雷布斯循环)作为大脑能量代谢的核心过程,在运动中发挥着重要作用。在运动期间,神经元需要大量能量来维持正常功能,三羧酸循环通过氧化代谢生成ATP,ATP作为细胞的主要能量货币,支持神经元的活跃活动[36]。然而,随着运动时间的延长,三羧酸循环的效率可能逐渐下降,ATP的生成速度减缓,致使能量供应不足,神经元的功能受到抑制,进而诱发中枢疲劳[9]。 此外,研究还表明,在长时间的剧烈运动过程中,神经元的代谢与血液供应之间可能出现短暂的失衡,这种失衡进一步加剧了能量缺乏的状态[37]。大脑无法及时获得足够的氧气和葡萄糖,致使神经元无法正常运作,这种能量供需不平衡是中枢疲劳的重要机制之一[38]。随着运动的持续,血液中的氧气和葡萄糖运输效率下降,神经元的代谢受限,使大脑在长时间高强度运动后的疲劳感变得更加明显[30]。 2.2.3 神经网络活动与中枢疲劳 中枢疲劳的产生与多个神经网络的活动密切相关,尤其是皮质-脊髓通路和下丘脑的功能变化,其中大脑皮质通过皮质-脊髓通路调控运动输出[39]。在持续运动或高强度运动时,皮质兴奋性下降,使运动神经元激活减少,表现为运动能力的降低和疲劳感的增加[40]。研究显示,当运动负荷增加时,皮质通过减少对运动神经元的激活来保护身体免于过度消耗,是中枢疲劳的一个关键生理机制[39-41]。此外,下丘脑在调节与运动相关的疲劳中发挥关键作用。下丘脑不仅通过调控自主神经系统影响能量代谢和体温,还通过调节多种神经递质如5-羟色胺和多巴胺来参与中枢疲劳的产生[41-42]。除皮质和下丘脑外,其他脑区如海马体和基底神经节亦参与了疲劳的调控。不同脑区之间的协同作用形成了复杂的神经网络,这些网络的活动共同调控个体的疲劳感知[7]。 2.2.4 神经炎症与中枢疲劳 运动诱发的免疫反应会促使炎症因子的释放[13-14],如肿瘤坏死因子α和白细胞介素1β,这些炎症因子能够通过血脑屏障进入中枢神经系统,直接作用于神经网络,激活微胶质细胞,进而诱发神经炎症,抑制神经递质的释放,损害神经传导,增加氧化应激,进一步加剧疲劳感[12,42-43]。此外,研究还表明,肿瘤坏死因子α和白细胞介素1β不仅在急性神经炎症中起作用(如脑损伤),亦在慢性炎症疾病中发挥重要作用,干扰大脑的能量代谢并影响线粒体功能,这可能是中枢疲劳的一个重要机制[13-44]。 2.2.5 氧化应激与中枢疲劳 氧化应激是指体内自由基产生与抗氧化系统的平衡被打破的状态[42]。当自由基(如活性氧和氮物质)生成过多时,会对细胞内的重要生物大分子(如脂质、蛋白质和DNA)造成氧化损伤,显著影响细胞特别是神经元的功能[35]。在大脑中,过量的氧化损伤可能干扰神经递质的合成与代谢,破坏神经元之间的信号传递,进而引发一种主观的疲劳感[38],这说明氧化应激不仅在细胞层面引发广泛的损伤,亦在大脑的神经调节系统中发挥着至关重要的作用。 神经元对氧化应激的敏感性较高,与其代谢特点和高能量需求密切相关。大脑在长期或高强度的运动过程中,由于大量的能量消耗,代谢产物(如乳酸和过量的自由基)会显著增加[45],这些代谢产物通过不同的机制作用于神经系统,使神经元的功能受到干扰,进而引发疲劳的感觉。具体来说,活性氧和活性氮物质不仅对神经递质的合成造成影响,还可能通过改变神经细胞膜的流动性、破坏细胞内钙离子浓度的稳定,进而影响神经传导功能,其具有一系列自我保护机制来应对氧化应激,其中抗氧化系统起到了关键作用[46-47]。 然而,当运动强度过高或持续时间过长时,体内产生的自由基数量会超过抗氧化系统的清除能力,造成自由基的积累[48-49]。这种过量的自由基不仅加剧了氧化损伤,还可能使中枢神经系统功能紊乱,进而诱发和加重中枢疲劳的发生[49-50]。因此,补充抗氧化剂,尤其是在高强度运动后,可能有助于缓解这种由自由基过量引起的疲劳,并帮助恢复神经系统的正常功能。 综上所述,氧化应激不仅是身体疲劳的一个重要生理机制,还是大脑中枢疲劳的关键推动力之一。通过合理调节抗氧化系统,补充适量的抗氧化剂,或许能够在一定程度上缓解中枢疲劳的发生和发展。 2.3 运动通过神经生理基础诱发中枢疲劳 2.3.1 运动通过星形胶质细胞糖原代谢诱发中枢疲劳 大脑的主要能量储备形式是糖原,主要来源于星形胶质细胞,这些细胞中的糖原能够被转化为乳酸,后者作为神经元的能量底物被利用[51]。研究显示,星形胶质细胞在神经元激活时释放乳酸,乳酸被神经元吸收后转化为丙酮酸,进一步氧化生成乙酰辅酶A,进入三羧酸循环[51]。该发现支持了星形胶质细胞与神经元之间的代谢合作,为神经元在长时间运动中提供了持续的能量支持。 然而,在长时间的运动中,血糖浓度会逐渐下降,致使大脑糖原储备减少。研究显示,随着血糖和脑糖原水平的下降,大脑皮质中的单胺类神经递质代谢显著增加,这可能与中枢性疲劳的发生密切相关[52]。然而,目前尚不清楚该过程中的具体分子机制,因此未来的研究应深入探讨大脑能量储备与神经递质代谢之间的相互作用。星形胶质细胞通过糖原代谢产生乳酸,在长时间运动中不仅为神经元提供了持续的能量支持,还可能延缓疲劳的发生。乳酸还能通过增强初级运动皮质的神经兴奋性,进一步延缓疲劳的进程[53]。然而,乳酸在运动中的作用并非单一正向。研究显示,运动过程中L-乳酸水平升高激活脑中的羟基羧酸受体1加剧了中枢疲劳[54],表明乳酸在中枢疲劳中复杂的双重作用,既作为能量来源,又可能通过特定的信号通路促进疲劳感的产生。 综上所述,星形胶质细胞通过糖原分解产生的乳酸为神经元提供了持续的能量供应。乳酸不仅在能量代谢中发挥关键作用,亦可能通过调控神经兴奋性和信号通路影响疲劳感的产生。未来的研究需进一步阐释乳酸在神经元代谢和信号传导中的双重作用,特别是乳酸在中枢疲劳发生过程中的复杂分子机制,以便更全面地理解运动诱导的中枢疲劳机制。运动通过星形胶质细胞糖原代谢诱发中枢疲劳的相关研究见表3。 2.3.2 运动通过调控γ-氨基丁酸诱发中枢疲劳 γ-氨基丁酸是中枢神经系统中的主要抑制性神经递质,其在运动诱发的中枢疲劳中的具体作用尚未得到充分证实。由于γ-氨基丁酸能够调节免疫反应[27],故推测其可能在疲劳产生中起到关键作用,这一观点得到了部分间接证据的支持,例如,ARM等[55]研究发现,多发性硬化症患者的中枢疲劳与体内γ-氨基丁酸和谷氨酸水平的变化相关联,这说明γ-氨基丁酸在神经性疲劳中发挥了潜在的作用。然而,当前对γ-氨基丁酸与中枢疲劳的直接关联尚无确凿的实验证据,故需要进一步研究以明确γ-氨基丁酸在中枢疲劳形成中的具体作用机制。此外,健康个体研究亦为揭示γ-氨基丁酸在运动与中枢疲劳之间的联系提供了支持。GANGADHAR[56]在一项为期12周的干预试验中"
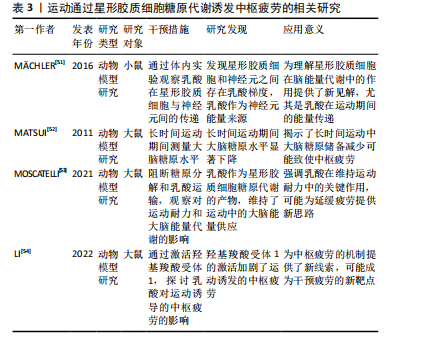
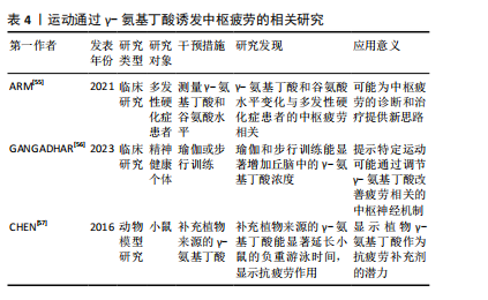
发现,瑜伽或步行训练能够显著增加个体丘脑中的γ-氨基丁酸浓度,这说明某些形式的运动可能通过调节中枢γ-氨基丁酸水平来影响与疲劳相关的中枢神经机制。然而,尚不清楚γ-氨基丁酸浓度的增加是否能直接改善运动诱发的中枢疲劳。此外,动物实验方面的研究进一步支持了γ-氨基丁酸的抗疲劳功能。研究显示,通过补充植物来源的γ-氨基丁酸,能够显著延长小鼠的负重游泳时间,凸显了γ-氨基丁酸在抗疲劳中的潜力[57]。然而,这些动物实验提供的结果能否有效外推至人类尚需进一步临床验证。 总的来说,现有研究为γ-氨基丁酸在运动诱发中枢疲劳中的作用提供了初步线索,但机制还未被充分揭示。未来研究应进一步探索γ-氨基丁酸在不同运动条件下的作用机制,特别是在中枢神经系统中的调控作用。同时,临床研究需验证γ-氨基丁酸补充剂是否能有效减缓人类中枢疲劳,这对于未来开发针对疲劳的干预措施具有重要意义。运动通过γ-氨基丁酸诱发中枢疲劳的相关研究见表4。"
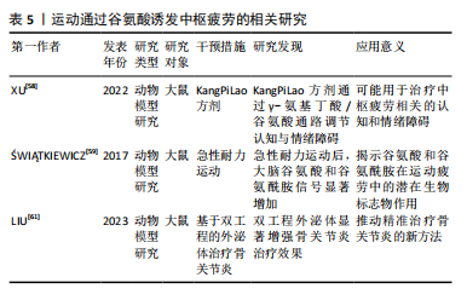
2.3.3 运动调控谷氨酸诱发中枢疲劳 谷氨酸作为一种条件性必需氨基酸,在运动营养学中的作用得到了广泛研究,尤其是在中枢疲劳形成中。XU等[58]研究显示,在小脑和海马体中谷氨酸水平升高以及脑中谷氨酰胺循环增加,均与中枢疲劳密切相关,这表明运动诱发的谷氨酸水平变化可能是中枢疲劳的重要生物标志。然而,尚不清楚这些变化如何影响不同脑区的神经活动,尤其是谷氨酰胺循环在这一过程中发挥的确切作用。此外,?WI?TKIEWICZ等[59]研究使用磁共振波谱技术发现,在急性耐力运动后,大鼠大脑中的谷氨酸和谷氨酰胺信号显著增加,这表明运动可能通过干扰谷氨酰胺循环,影响脑细胞的能量代谢和神经传递,进而导致中枢疲劳的出现。然而,尚不完全清楚不同运动强度或持续时间如何影响谷氨酰胺循环的平衡。此外,谷氨酸在延缓中枢疲劳的过程中还可能通过代谢途径发挥重要作用。COQUEIRO等[60]发表综述认为谷氨酸能够通过补充三羧酸循环中间体和增强糖异生作用,提高糖原合成酶的活性,同时作为无毒的氨导管,防止运动过程中氨的过度积累,进而延缓疲劳的产生,这一机制说明谷氨酸不仅在神经传递中起到重要作用,还通过调节代谢过程对运动疲劳产生影响。然而,现有研究主要集中于谷氨酸在特定代谢途径中的作用,其在不同运动模式中的表现尚需进一步研究。因此,未来应通过不同运动负荷下的代谢研究,全面评估谷氨酸在延缓中枢疲劳中的潜在作用机制。 下丘脑作为调节运动相关疲劳的重要中枢,近年来引起了广泛关注。一项关于下丘脑核活动变化与中枢疲劳关系的研究显示,运动诱发的下丘脑核活动动态变化与早期疲劳的出现密切相关[61],该研究还发现下丘脑核细胞外液中谷氨酸/γ-氨基丁酸比例的变化可能与运动诱发的中枢疲劳有关[61],这表明谷氨酸不仅在代谢调控中具有重要作用,还可能通过神经递质平衡调节中枢疲劳的进程。然而,谷氨酸/γ-氨基丁酸比例的具体调控机制以及在不同运动阶段的变化尚需进一步研究。因此,未来的研究应关注谷氨酸/γ-氨基丁酸平衡在疲劳调节中的时空动态变化,特别是在下丘脑区域中的神经递质调控机制,以更好地理解其在中枢疲劳中的作用。 总而言之,谷氨酸在运动诱发的中枢疲劳中起到了复杂而重要的作用,尚有许多机制还未明确,特别是谷氨酸在不同脑区及与其他神经递质系统的相互作用。运动通过谷氨酸诱发中枢疲劳的相关研究见表5。"

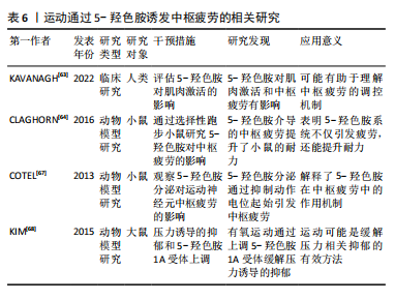
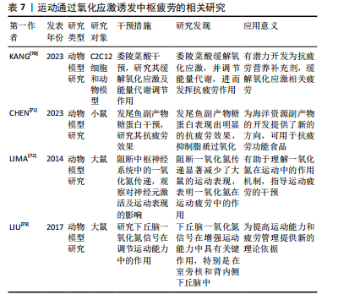
2.3.4 运动通过调控5-羟色胺诱发中枢疲劳 5-羟色胺作为一种抑制性神经递质,在运动诱发的中枢疲劳过程中发挥了关键作用。5-羟色胺是血浆中通过血脑屏障的色氨酸,受游离色氨酸水平的调节[62]。研究显示,当血液中的游离色氨酸水平升高时,部分中枢神经系统神经元中的5-羟色胺水平亦随之增加,这一变化直接影响了大脑的神经电生理活动,进而可能导致中枢疲劳[11]。 5-羟色胺的合成过程由色氨酸羟化酶调节,主要发生在中缝核的5-羟色胺能神经元中[9]。KAVANAGH等[63]指出5-羟色胺通过影响运动神经元的活性,参与中枢疲劳的调节,这一发现揭示了5-羟色胺在运动表现与疲劳之间的复杂关联,即通过调控5-羟色胺系统或可缓解因运动导致的疲劳。然而,5-羟色胺在不同运动强度下的具体作用机制尚需进一步阐释。此外,动物模型研究亦支持5-羟色胺在中枢疲劳中的重要作用。CLAGHORN等[64]研究发现,5-羟色胺介导的中枢疲劳有助于提升小鼠的耐力,这表明5-羟色胺系统不仅仅在疲劳过程中起到负面作用,还可能通过增强耐力适应性来提升运动表现。然而,该现象是否在人类中同样适用尚有待进一步验证。此外,LO MONACO等[65]发现,剧烈运动引起的中枢神经调节失衡可能通过调整5-羟色胺系统得以纠正,这为预防过度训练导致的短暂性心理障碍提供了潜在的治疗途径。 PEARCEY等[66]研究显示,5-羟色胺主要是借助对超脊髓水平神经过程的调控来影响疲劳状况,而非直接作用于运动系统的输出,这说明5-羟色胺或许能够通过影响中枢神经的高级调控进程,从而改变人类对于疲劳的主观感受与认知。然而,该调控机制的复杂性以及5-羟色胺在不同运动情境下的表现尚需进一步探讨。此外,中缝核的5-羟色胺神经元在调节运动诱发的中枢疲劳中起到了核心作用[41]。研究显示,运动过程中5-羟色胺释放至细胞外能够激活5-羟色胺受体,延长中缝-脊髓通路的刺激,进而增强5-羟色胺信号传导,最终促进运动神经元的疲劳,在此过程中5-羟色胺1A和5-羟色胺1B受体的激活通过抑制运动神经元轴突起始段的动作电位,发挥了抑制性调节作用[67],这说明中缝核5-羟色胺能神经元通过特定的受体机制调控中枢疲劳。然而,针对这些受体的具体机制,特别是在不同运动强度下的反应,尚需进一步实验研究加以验证。 此外,在压力状态下,5-羟色胺系统的作用表现更为显著。KIM等[68]研究显示,在大鼠跑步机运动过程中,压力状态下5-羟色胺1A受体的增强激活促进了5-羟色胺的合成,进而加速中枢疲劳的发生,这一发现强调5-羟色胺系统在应激条件下的独特作用,说明在不同的心理和生理状态下,5-羟色胺系统的调节模式可能存在显著差异。因此,未来的研究应进一步结合应激与运动的交互基础,以全面理解5-羟色胺在中枢疲劳调节中的复杂作用。 总体而言,5-羟色胺在运动诱发的中枢疲劳中具有关键作用。然而,5-羟色胺的具体调控机制、不同运动条件下的表现差异,以及在人类与动物模型中的异同尚需深入探讨。后续研究应重点关注5-羟色胺在不同运动强度和情境下的作用机制,为运动疲劳的干预和治疗提供新的科学依据。运动通过5-羟色胺诱发中枢疲劳的相关研究见表6。"
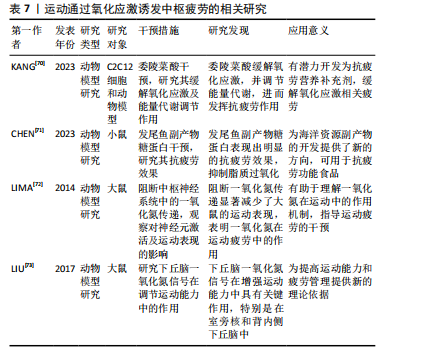
2.3.5 运动通过氧化应激诱发中枢疲劳 氧化应激的主要递质包括脂质氧化的副产物丙二醛以及3种重要的抗氧化酶:超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶[69-70]。然而,在低氧运动的情况下,虽然超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶的活性可能会增加,但大脑中丙二醛的含量亦会显著上升,反映出脂质过氧化的增强[71],这说明虽然抗氧化酶的活性增强,低氧状态下的运动尚可能加剧氧化损伤,特别是在耗竭性运动后,氧化应激的累积更加显著[71]。 氧化应激不仅会因自由基的累积而给大脑带来影响,而且与一氧化氮生成的调控有着紧密的联系。一氧化氮属于活性氮物质,广泛参与血流调节过程,由一氧化氮合酶予以调控,在大脑皮质与下丘脑等区域表现尤为明显[72]。一氧化氮水平出现轻微的变动,都可能直接对运动表现产生作用,进一步对中枢疲劳造成影响。例如,在中枢神经系统中对神经型一氧化氮合酶进行急性阻断后,大鼠在跑步机上的活动表现显著降低,说明一氧化氮合酶以及一氧化氮在运动诱发的中枢疲劳进程中有着极为关键的作用[72]。一氧化氮不仅是维持正常血流量的关键要素,而且在运动中的调节功效也极为复杂。特别是神经型一氧化氮合酶所诱导的一氧化氮信号在室旁核与背内侧下丘脑中起到了至关重要的作用,对于提升运动能力有着决定性的价值[73]。 总的来说,氧化应激通过多种途径参与运动诱发的中枢疲劳过程。低氧运动条件下的自由基生成和脂质过氧化增加了氧化损伤,虽然抗氧化酶系统活跃,尚无法完全抵消其影响,且一氧化氮信号通路的调控进一步揭示了氧化应激对运动能力的双重作用,既调节了血流,亦在中枢神经系统中直接参与运动相关的疲劳过程。然而,目前的研究尚不足以全面揭示氧化应激与一氧化氮在中枢疲劳中的具体机制,尚需进一步探索。运动通过氧化应激诱发中枢疲劳的相关研究见表7。"
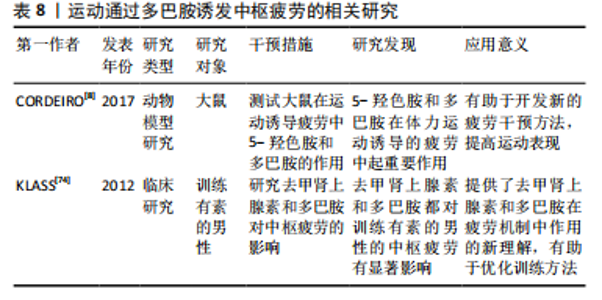
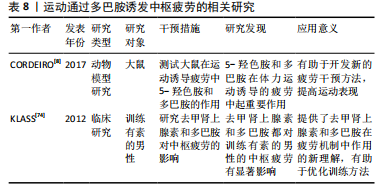
2.3.6 运动通过调控多巴胺诱发中枢疲劳 多巴胺是由氨基酸酪氨酸衍生的神经递质,其在运动诱发的中枢疲劳中具有重要作用。研究显示,多巴胺不仅对动机和运动行为具有显著的影响,还密切参与了疲劳的“中枢”机制调控[6]。中枢多巴胺能系统通过调节肌肉张力,为运动行为的实施提供了必要的准备,这有助于身体有效地进行运动[30]。然而,大脑皮质中多巴胺刺激的减少可能成为中枢性疲劳的重要诱因,这表明多巴胺在运动中的作用不仅限于运动准备阶段,还涉及对疲劳的调控。此外,TORNERO-AGUILERA等[30]发现,多巴胺水平下降可能导致中枢性疲劳的发生。然而,尚需进一步确定多巴胺下降如何影响中枢疲劳的不同阶段。 多巴胺与去甲肾上腺素于视前区以及下丘脑前部的活动状况,对体温调节同样具有特定的影响作用。多巴胺因其增强运动能力的作用而备受关注,多巴胺不仅能够增加热量储存能力,还能提升机体对高温的耐受性[8],这说明在高温条件下,多巴胺有助于提高运动表现并延缓疲劳的出现。然而,去甲肾上腺素的再摄取则可能对运动表现产生负面影响,降低运动表现的发挥[74]。 总之,多巴胺在运动诱发的中枢疲劳中起着多重作用,能够调节肌肉张力,并在高温条件下通过增强耐热性提升运动表现。然而,未来应进一步探讨多巴胺的作用机制,尤其是在不同运动条件下(如高温、长时间运动)的作用。运动通过多巴胺诱发中枢疲劳的相关研究见表8。"
| [1] 田峰.对中枢与外周运动性疲劳的再认识[J].中国组织工程研究, 2015,19(42):6849-6854. [2] RUDROFF T. Revealing the Complexity of Fatigue: A Review of the Persistent Challenges and Promises of Artificial Intelligence. Brain Sci. 2024;14(2):186. [3] GREENHOUSE-TUCKNOTT A, BUTTERWORTH JB, WRIGHTSON JG, et al. Effect of the subjective intensity of fatigue and interoception on perceptual regulation and performance during sustained physical activity. PLoS One. 2022;17(1):e0262303. [4] NIU H, MING D, PAPADELIS C, et al. Editorial: The Brain Under Fatigue. Front Neurosci. 2022;16:945527. [5] ZHANG H, WANG J, GENG X, et al. Objective Assessments of Mental Fatigue During a Continuous Long-Term Stress Condition. Front Hum Neurosci. 2021;15:733426. [6] 魏高峡,盖力锟,林萱.运动认知神经科学研究(2012~2022):10年回顾与未来展望[J].科学通报,2024,69(24):3492-3514. [7] YANG X, LI F, LIU Y, et al. Study on the Correlation Between NF-κB and Central Fatigue. J Mol Neurosci. 2021;71(10):1975-1986. [8] CORDEIRO LMS, RABELO PCR, MORAES MM, et al. Physical exercise-induced fatigue: the role of serotonergic and dopaminergic systems. Braz J Med Biol Res. 2017;50(12):e6432. [9] VANTI C, ANDREATTA S, BORGHI S, et al. The effectiveness of walking versus exercise on pain and function in chronic low back pain: a systematic review and meta-analysis of randomized trials. Disabil Rehabil. 2019;41(6):622-632. [10] KANTAMNENI S. Cross-talk and regulation between glutamate and GABAB receptors. Front Cell Neurosci. 2015;9:135. [11] MEEUSEN R, WATSON P, HASEGAWA H, et al. Central fatigue: the serotonin hypothesis and beyond. Sports Med. 2006;36(10):881-909. [12] SEO DY, HEO JW, KO JR, et al. Exercise and Neuroinflammation in Health and Disease. Int Neurourol J. 2019;23(Suppl 2):S82-92. [13] MEE-INTA O, ZHAO ZW, KUO YM. Physical Exercise Inhibits Inflammation and Microglial Activation. Cells. 2019;8(7):691. [14] KATSUHIKO S. Cytokine Response to Exercise and Its Modulation. Antioxidants. 2018;7(1):17-23. [15] RAVI M, MILLER AH, MICHOPOULOS V. The Immunology of Stress and the Impact of Inflammation on the Brain and Behavior. BJPsych Adv. 2021;27(Suppl 3):158-165. [16] ROELANDS B, MEEUSEN R. Alterations in central fatigue by pharmacological manipulations of neurotransmitters in normal and high ambient temperature. Sports Med. 2010;40(3):229-246. [17] XIE Y, WU Z, SUN L, et al. The Effects and Mechanisms of Exercise on the Treatment of Depression. Front Psychiatry. 2021;12:705559. [18] HEIJNEN S, HOMMEL B, KIBELE A, et al. Neuromodulation of Aerobic Exercise-A Review. Front Psychol. 2016;6:1890. [19] 王若冲,吴凤芝,于清茜,等.中枢疲劳的机制研究与相关动物模型构建方法探析[J].中国医药导报,2023,20(9):181-185+197. [20] CARLOS-LIMA E, HIGA GSV, VIANA FJC, et al. Serotonergic Modulation of the Excitation/Inhibition Balance in the Visual Cortex. Int J Mol Sci. 2023;25(1):519. [21] ENGEL M, SMIDT MP, VAN HOOFT JA. The serotonin 5-HT3 receptor: a novel neurodevelopmental target. Front Cell Neurosci. 2013;7:76. [22] HOEPNER CT, MCINTYRE RS, PAPAKOSTAS GI. Impact of Supplementation and Nutritional Interventions on Pathogenic Processes of Mood Disorders: A Review of the Evidence. Nutrients. 2021;13(3):767. [23] BANWINKLER M, DZIALAS V, RIGOUX L, et al. Putaminal dopamine modulates movement motivation in Parkinson’s disease. Brain. 2024; 147(10):3352-3357.
[24] DOBRYAKOVA E, GENOVA HM, DELUCA J, et al. The dopamine imbalance hypothesis of fatigue in multiple sclerosis and other neurological disorders. Front Neurol. 2015;6:52. [25] FOLEY TE, FLESHNER M. Neuroplasticity of dopamine circuits after exercise: implications for central fatigue. Neuromolecular Med. 2008; 10(2):67-80. [26] 李梦民,刘滔,罗婷,等.疲劳评价与食源性抗运动疲劳成分研究进展[J].食品工业科技,2025,46(2):394-402. [27] 高照,段锐.运动性疲劳的分子生物学机制及相关特异性基因靶点的研究进展[J].生理科学进展,2024,55(1):13-20. [28] LI R, YANG Y, WANG H, et al. Lactate and Lactylation in the Brain: Current Progress and Perspectives. Cell Mol Neurobiol. 2023;43(6): 2541-2555. [29] 孔健达,朱磊.长时程增强相关代谢产物的作用机制及其运动效应[J].神经解剖学杂志,2023,39(6):733-736. [30] TORNERO-AGUILERA JF, JIMENEZ-MORCILLO J, RUBIO-ZARAPUZ A, et al. Central and Peripheral Fatigue in Physical Exercise Explained: A Narrative Review. Int J Environ Res Public Health. 2022;19(7):3909. [31] COGGAN JS, KELLER D, CALÌ C, et al. Norepinephrine stimulates glycogenolysis in astrocytes to fuel neurons with lactate. PLoS Comput Biol. 2018;14(8):e1006392. [32] MATSUI T, OMURO H, LIU YF, et al. Astrocytic glycogen-derived lactate fuels the brain during exhaustive exercise to maintain endurance capacity. Proc Natl Acad Sci U S A. 2017;114(24):6358-6363. [33] BEARD E, LENGACHER S, DIAS S, et al. Astrocytes as Key Regulators of Brain Energy Metabolism: New Therapeutic Perspectives. Front Physiol. 2022;12:825816. [34] MAGISTRETTI PJ, ALLAMAN I. Lactate in the brain: from metabolic end-product to signalling molecule. Nat Rev Neurosci. 2018;19(4):235-249. [35] ROUMES H, PELLERIN L, BOUZIER-SORE AK. Astrocytes as metabolic suppliers to support neuronal activity and brain functions. Essays Biochem. 2023;67(1):27-37. [36] 樊饶,孔健达,丁国诏,等.运动在延缓脑衰老中的作用:从大脑可塑性到神经保护[J].生理科学进展,2024,55(4):361-368. [37] XUE X, LIU B, HU J, et al. The potential mechanisms of lactate in mediating exercise-enhanced cognitive function: a dual role as an energy supply substrate and a signaling molecule. Nutr Metab (Lond). 2022;19(1):52. [38] GASMI A, PEANA M, ARSHAD M, et al. Krebs cycle: activators, inhibitors and their roles in the modulation of carcinogenesis. Arch Toxicol. 2021; 95(4):1161-1178. [39] SHARPLES SA, GOULD JA, VANDENBERK MS, et al. Cortical Mechanisms of Central Fatigue and Sense of Effort. PLoS One. 2016;11(2):e0149026. [40] HENDY AM, ANDRUSHKO JW, DELLA GATTA PA, et al. Acute Effects of High-Intensity Aerobic Exercise on Motor Cortical Excitability and Inhibition in Sedentary Adults. Front Psychol. 2022;13:814633. [41] PERRIER JF, RASMUSSEN HB, JØRGENSEN LK, et al. Intense Activity of the Raphe Spinal Pathway Depresses Motor Activity via a Serotonin Dependent Mechanism. Front Neural Circuits. 2018;11:111. [42] KONG J, FAN R, ZHANG Y, et al. Oxidative stress in the brain-lung crosstalk: cellular and molecular perspectives. Front Aging Neurosci. 2024;16:1389454. [43] WANG M, ZHANG H, LIANG J, et al. Exercise suppresses neuroinflammation for alleviating Alzheimer’s disease. J Neuroinflammation. 2023;20(1):76. [44] MORRIS G, BERK M, WALDER K, et al. Central pathways causing fatigue in neuro-inflammatory and autoimmune illnesses. BMC Med. 2015;13:28. [45] HASHIMOTO T, TSUKAMOTO H, ANDO S, et al. Effect of Exercise on Brain Health: The Potential Role of Lactate as a Myokine. Metabolites. 2021;11(12):813. [46] MAHAPATRA C, THAKKAR R, KUMAR R. Modulatory Impact of Oxidative Stress on Action Potentials in Pathophysiological States: A Comprehensive Review. Antioxidants (Basel). 2024;13(10):1172. [47] LEE KH, CHA M, LEE BH. Neuroprotective Effect of Antioxidants in the Brain. Int J Mol Sci. 2020;21(19):7152. [48] KAWAMURA T, MURAOKA I. Exercise-Induced Oxidative Stress and the Effects of Antioxidant Intake from a Physiological Viewpoint. Antioxidants (Basel). 2018;7(9):119. [49] MENG Q, SU CH. The Impact of Physical Exercise on Oxidative and Nitrosative Stress: Balancing the Benefits and Risks. Antioxidants (Basel). 2024;13(5):573. [50] YE Y, LIN H, WAN M, et al. The Effects of Aerobic Exercise on Oxidative Stress in Older Adults: A Systematic Review and Meta-Analysis. Front Physiol. 2021;12:701151. [51] MÄCHLER P, WYSS MT, ELSAYED M, et al. In Vivo Evidence for a Lactate Gradient from Astrocytes to Neurons. Cell Metab. 2016;23(1):94-102. [52] MATSUI T, SOYA S, OKAMOTO M, et al. Brain glycogen decreases during prolonged exercise. J Physiol. 2011;589(Pt 13):3383-3393. [53] MOSCATELLI F, MESSINA A, VALENZANO A, et al. Transcranial Magnetic Stimulation as a Tool to Investigate Motor Cortex Excitability in Sport. Brain Sci. 2021;11(4):432. [54] LI J, XIA Y, XU H, et al. Activation of brain lactate receptor GPR81 aggravates exercise-induced central fatigue. Am J Physiol Regul Integr Comp Physiol. 2022;323(5):R822-R831. [55] ARM J, OELTZSCHNER G, AL-IEDANI O, et al. Altered in vivo brain GABA and glutamate levels are associated with multiple sclerosis central fatigue. Eur J Radiol. 2021;137:109610. [56] GANGADHAR BN. Evidence-based integration of yoga in psychiatric practice. Indian J Psychiatry. 2023;65(1):5-11. [57] CHEN H, HE X, LIU Y, et al. Extraction, purification and anti-fatigue activity of γ-aminobutyric acid from mulberry (Morus alba L.) leaves. Sci Rep. 2016;6:18933. [58] XU Y, LIAN Y, LI J, et al. KangPiLao decoction modulates cognitive and emotional disorders in rats with central fatigue through the GABA/Glu pathway. Front Pharmacol. 2022;13:939169. [59] ŚWIĄTKIEWICZ M, FIEDOROWICZ M, ORZEŁ J, et al. Increases in Brain 1H-MR Glutamine and Glutamate Signals Following Acute Exhaustive Endurance Exercise in the Rat. Front Physiol. 2017;8:19. [60] COQUEIRO AY, ROGERO MM, TIRAPEGUI J. Glutamine as an Anti-Fatigue Amino Acid in Sports Nutrition. Nutrients. 2019;11(4):863. [61] LIU W, LIU A, LI X, et al. Dual-engineered cartilage-targeting extracellular vesicles derived from mesenchymal stem cells enhance osteoarthritis treatment via miR-223/NLRP3/pyroptosis axis: Toward a precision therapy. Bioact Mater. 2023;30:169-183. [62] GRIFKA-WALK HM, JENKINS BR, KOMINSKY DJ. Amino Acid Trp: The Far Out Impacts of Host and Commensal Tryptophan Metabolism. Front Immunol. 2021;12:653208. [63] KAVANAGH JJ, TAYLOR JL. Voluntary activation of muscle in humans: does serotonergic neuromodulation matter? J Physiol. 2022;600(16): 3657-3670. [64] CLAGHORN GC, FONSECA IAT, THOMPSON Z, et al. Serotonin-mediated central fatigue underlies increased endurance capacity in mice from lines selectively bred for high voluntary wheel running. Physiol Behav. 2016;161:145-154. [65] LO MONACO M, GERVOIS P, BEAUMONT J, et al. Therapeutic Potential of Dental Pulp Stem Cells and Leukocyte- and Platelet-Rich Fibrin for Osteoarthritis. Cells. 2020;9(4):980. [66] PEARCEY GEP, HECKMAN CJ. Serotonin affects our perception of fatigue when performing submaximal efforts - but is it all in our heads? J Physiol. 2020;598(13):2533-2534. [67] COTEL F, EXLEY R, CRAGG SJ, et al. Serotonin spillover onto the axon initial segment of motoneurons induces central fatigue by inhibiting action potential initiation. Proc Natl Acad Sci U S A. 2013;110(12):4774-4779. [68] KIM TW, LIM BV, BAEK D, et al. Stress-Induced Depression Is Alleviated by Aerobic Exercise Through Up-Regulation of 5-Hydroxytryptamine 1A Receptors in Rats. Int Neurourol J. 2015;19(1):27-33. [69] FENG J, ZHENG Y, GUO M, et al. Oxidative stress, the blood-brain barrier and neurodegenerative diseases: The critical beneficial role of dietary antioxidants. Acta Pharm Sin B. 2023;13(10):3988-4024. [70] KANG HG, LIM JH, KIM HY, et al. Anti-fatigue effect of tormentic acid through alleviating oxidative stress and energy metabolism-modulating property in C2C12 cells and animal models. Nutr Res Pract. 2023;17(4):670-681. [71] CHEN J, LU X, CHEN P, et al. Anti-fatigue effect of glycoprotein from hairtail (Trichiurus lepturus) by-products in a behavioral mouse model. Food Chem X. 2023;18:100645. [72] LIMA PM, SANTIAGO HP, SZAWKA RE, et al. Central blockade of nitric oxide transmission impairs exercise-induced neuronal activation in the PVN and reduces physical performance. Brain Res Bull. 2014;108:80-87. [73] LIU H, XUE J. Involvement of hypothalamic nitric oxide signaling in the modulation of a rat’s exercise capacity. Neuroreport. 2017;28(7):408-413. [74] KLASS M, ROELANDS B, LÉVÉNEZ M, et al. Effects of noradrenaline and dopamine on supraspinal fatigue in well-trained men. Med Sci Sports Exerc. 2012;44(12):2299-2308. |
| [1] | Sun Yundi, Cheng Lulu, Wan Haili, Chang Ying, Xiong Wenjuan, Xia Yuan. Effect of neuromuscular exercise for knee osteoarthritis pain and function: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1945-1952. |
| [2] | Wang Qiuyue, Jin Pan, Pu Rui . Exercise intervention and the role of pyroptosis in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1667-1675. |
| [3] | Wang Juan, Wang Guanglan, Zuo Huiwu. Efficacy of exercise therapy in the treatment of anterior cruciate ligament reconstruction patients: #br# a network meta-analysis #br# [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1714-1726. |
| [4] | Zheng Huakun, Yin Mingyue, Liu Qian. Effects of interval and continuous training on the quality of life in physically inactive adults: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1727-1740. |
| [5] | Lou Guo, Zhang Min, Fu Changxi. Exercise preconditioning for eight weeks enhances therapeutic effect of adipose-derived stem cells in rats with myocardial infarction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1363-1370. |
| [6] | Zheng Rongfa, Mo Weibin, Huang Peng, Chen Junji, Liang Ting, Zi Fangyu, Li Guofeng. Effects of electroacupuncture on the expression of metabolic enzymes and autophagy genes in gastrocnemius muscle tissues of exercising rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1127-1136. |
| [7] | Zhao Xiaoxuan, Liu Shuaiyi, Li Qi, Xing Zheng, Li Qingwen, Chu Xiaolei. Different exercise modalities promote functional recovery after peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1248-1256. |
| [8] | Zhang Wenhua, Li Xun, Zhang Weichao, Li Xinying, Ma Guoao, Wang Xiaoqiang . Promoting myogenesis based on the SphK1/S1P/S1PR2 signaling pathway: a new perspective on improving skeletal muscle health through exercise [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1265-1275. |
| [9] | Ma Haoyu, Qiao Hongchao, Hao Qianqian, Shi Dongbo. Causal effects of different exercise intensities on the risk of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1305-1311. |
| [10] | Wang Dongyang, Yang Qiaohui, Lin Xinchao. Relationship between vitamin D levels and reproductive characteristics and exercise dietary situation in postmenopausal women [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1021-1025. |
| [11] | Yang Yu, Li Yinghao, Duo Zhuangzhi, Zhou Dingrong. Effect of overall functional physical exercise on lumbar biomechanics in patients with lumbar disc herniation after surgery [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(33): 7096-7101. |
| [12] | Yuan Yingjia, Yi Yanzi, Li Jin, Wang Ke, Wang Yu, Lin Tianye, Zhang Qingwen, He Wei, Wei Qiushi. Effect of hip abductor muscle exercise on three-dimensional gait and collapse rate in patients with non-traumatic femoral head necrosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(33): 7211-7216. |
| [13] | Geng Zhizhong, Wang Jinhao, Cao Guohuan, Tan Chenhao, Li Longji, Qiu Jun. Difference of energy metabolism and skeletal muscle oxygenation in athletes under high temperature, high humidity and low oxygen environment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6866-6876. |
| [14] | Liu Chenchen, Liu Ruize, Bao Mengmeng, Fang Li, Cao Liquan, Wu Jiangbo. Blood flow restriction training intervention in the elderly with sarcopenic obesity [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6963-6970. |
| [15] | Wang Jiaqian, , Jiang Changjun, Peng Yi, Ma Mi, Li Junhan. Study on the role of aerobic exercise in regulating the CNPY2-mediated AKT/GSK3β pathway for improving non-alcoholic fatty liver [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6441-6448. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||